2023-2024学年高中化学苏教版(2019)选择性必修二 3-2离子键 离子晶体 课件(共30张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版(2019)选择性必修二 3-2离子键 离子晶体 课件(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 14:33:44 | ||
图片预览






文档简介
(共30张PPT)
3.2离子键 离子晶体
一、离子键的形成
钠原子与氯原子是如何结合形成氯化钠的?
思考
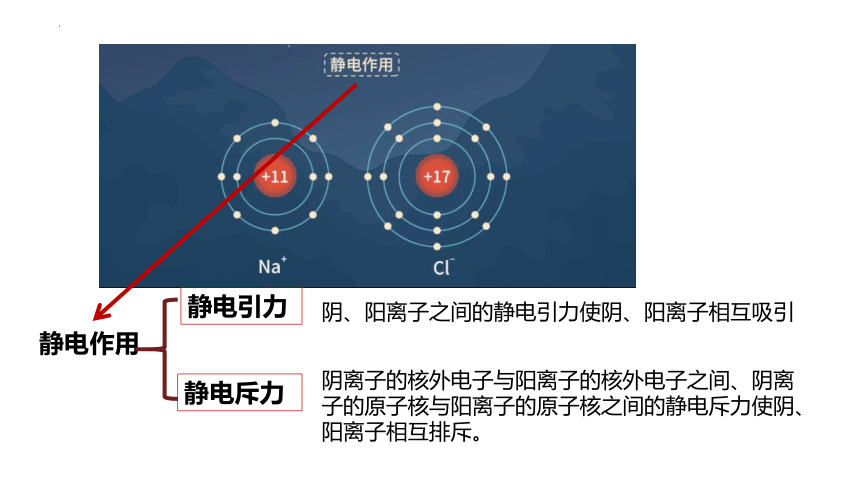
阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。
静电作用
静电引力
静电斥力
阴、阳离子之间的静电引力使阴、阳离子相互吸引
当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态。
只存在于离子化合物中:大多数盐、强碱、活泼金属氧化物、氢化物等。
成键条件:
成键元素的原子得、失电子的能力差别很大,电负性差值大于1.7。
存在:
离子化合物中的化学键
有的离子化合物中只含有离子键,如MgO、NaF、MgCl2等;
有的离子化合物中既含有离子键又含有共价键,如NaOH等。
表示方法:电子式
离子键有方向性和饱和性吗?
思考
通常情况下,阴、阳离子可以看成是球形对称的。阴、阳离子的电荷分布也是球形对称的,它们在空间各个方向上的静电作用相同,所以在各个方向上都可以与带相反电荷的离子发生静电作用,且在静电作用能达到的范围内,只要空间条件允许,一个离子可以同时吸引多个带相反电荷的离子。
因此,离子键没有方向性和饱和性。
二、离子晶体
1、定义:由阴、阳离子按一定方式有规则地排列形成的晶体。
2、成键粒子:
阴、阳离子
3、相互作用力:
离子键
强碱、活泼金属氧化物、大部分的盐类。
4、常见的离子晶体:
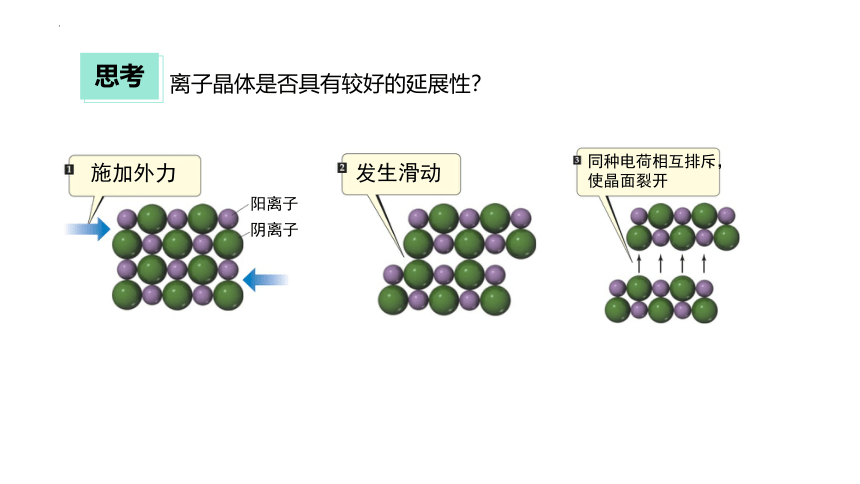
离子晶体是否具有较好的延展性?
思考
施加外力
发生滑动
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
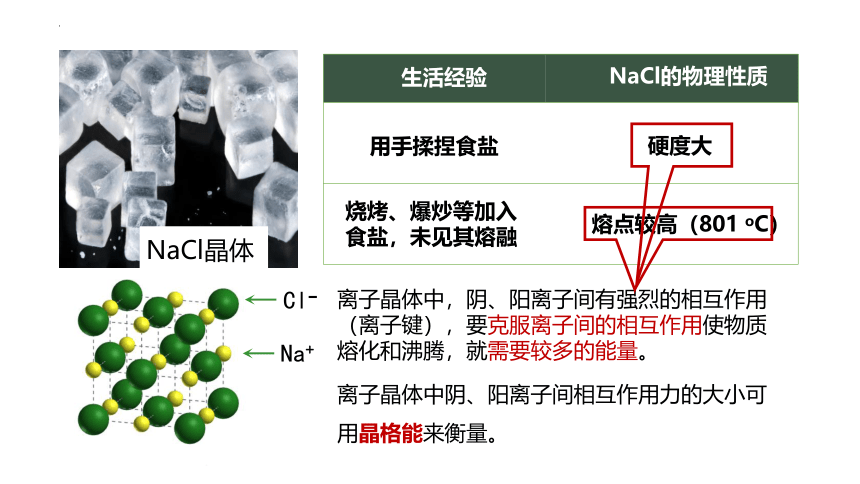
NaCl晶体
用手揉捏食盐
硬度大
生活经验
NaCl的物理性质
烧烤、爆炒等加入食盐,未见其熔融
熔点较高(801 oC)
离子晶体中阴、阳离子间相互作用力的大小可用晶格能来衡量。
Cl
Na+
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
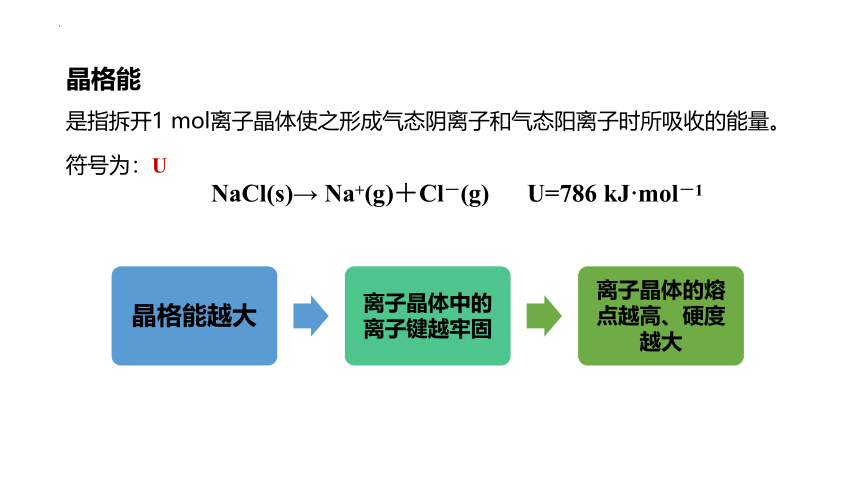
是指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量。
NaCl(s)→ Na+(g)+Cl-(g) U=786 kJ·mol-1
晶格能
符号为:U
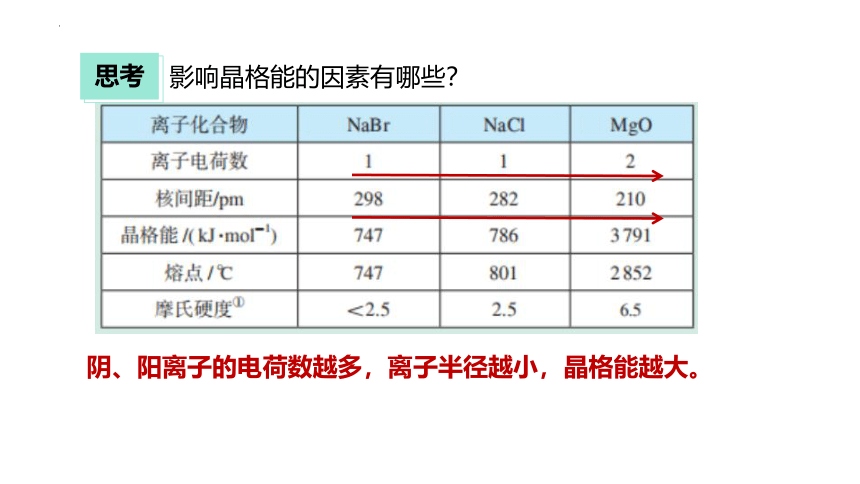
影响晶格能的因素有哪些?
思考
阴、阳离子的电荷数越多,离子半径越小,晶格能越大。
离子晶体的结构
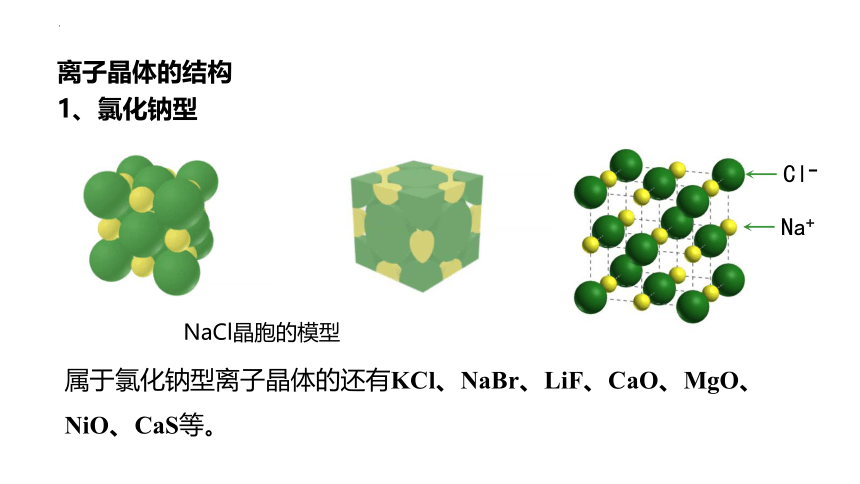
1、氯化钠型
属于氯化钠型离子晶体的还有KCl、NaBr、LiF、CaO、MgO、NiO、CaS等。
Cl
Na+
NaCl晶胞的模型
每个NaCl晶胞中含有4个Na+和4个Cl-, 个数比1:1。
每个NaCl晶胞中微粒数是多少?
思考
Cl
Na+
Cl
Na+
8
1
2
1
4
1
离子晶体中不存在单个分子,其化学式表示离子的个数比。
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
每个Cl- 周围与之最接近且距离相等的Na+共有6个,每个Cl- 周围与它最近且等距的Cl- 有12个。
这几个Na+在空间构成的几何构型为正八面体
配位数
配位数:一个离子周围最邻近的异电性离子的数目
1、氯化钠型
Cl
Cs+
2、氯化铯型
CsCl、CsBr、CsI、NH4Cl等晶体都属于氯化铯型离子晶体。
Cl
Cs+
1
8
1
每个CsCl晶胞中含有1个Cs+和1个Cl-, 个数比1:1。
8× =1
Cs+和Cl-
配位数均为8
NaCl、CsCl都是AB型离子化合物,其中一种离子周围紧邻的带相反电荷的离子数目却不同。原因是什么?
思考
两者的数目之所以不同,主要在于离子半径的差异。Cs+的半径要大于Na+,因而可以吸引更多的Cl-。
在NaCl晶体中,每个Na+的周围有6个Cl-,
而在CsCl晶体中,每个Cs+的周围有8个Cl-。
可见,离子晶体中不同离子周围异电性离子数目的多少主要取决于阴、阳离子的相对大小。
硫酸铵晶体的结构
硫酸铵晶体的结构
实验测得,图中“H…O”原子间的距离为199 pm,小于H与O的范德华半径之和272 pm,大于H—O共价键的键长96 pm,说明二者之间的作用力大小在范德华力和共价键之间,且N—H与H…O之间的角度为156°,也符合形成氢键的条件。
由此,可以判断SO42-与NH4+之间形成的是氢键(N—H…O),而非离子键。
晶体相关计算
晶体的化学式表示的是晶体(也可以说是晶胞)中各类原子或离子数目的最简整数比
A
B
化学式:
AB
(A表示阳离子)
1、晶体化学式的确定
(A表示阳离子)
A
B
化学式:
A2B
A
B
化学式:
AB
(A表示阳离子)
B
化学式:
A
C
ABC3
(A表示阳离子)
晶体相关计算
2、晶体密度
ρ= m/V
根据晶胞结构确定各种粒子的数目
根据晶胞的边长或微粒间的距离
晶胞质量
晶胞体积
求
求
单位:g·cm-3
若氯化钠晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
NA×a3×10-30
4×58.5
a pm
=
Cl
Na+
8
1
2
1
4
1
a pm=a×10-10cm
NA×a3×10-30
234
=
g·cm-3
若氯化铯晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
NA×a3×10-30
168.5
a pm
=
g·cm-3
性质差异较大
离子晶体
阳离子
离子键
阴离子
晶格能
结构
计算
氯化钠型
氯化铯型
分子式
密度
课堂总结
1、 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
课堂练习
D
课堂练习
2、下列为离子晶体空间结构示意图,图中 为阳离子, 为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为( )
B
3、下图所示为某离子化合物的晶胞结构示意图,X、Y、Z表示该晶胞中三种不同的微粒,该化合物的化学式可表示为 。
XY3Z
4、某离子化合物A3B的晶胞结构示意图如上图所示。晶胞中与一个B相紧邻的A有 个,与一个A相紧邻的B有 个。
6
2
3.2离子键 离子晶体
一、离子键的形成
钠原子与氯原子是如何结合形成氯化钠的?
思考
阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。
静电作用
静电引力
静电斥力
阴、阳离子之间的静电引力使阴、阳离子相互吸引
当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态。
只存在于离子化合物中:大多数盐、强碱、活泼金属氧化物、氢化物等。
成键条件:
成键元素的原子得、失电子的能力差别很大,电负性差值大于1.7。
存在:
离子化合物中的化学键
有的离子化合物中只含有离子键,如MgO、NaF、MgCl2等;
有的离子化合物中既含有离子键又含有共价键,如NaOH等。
表示方法:电子式
离子键有方向性和饱和性吗?
思考
通常情况下,阴、阳离子可以看成是球形对称的。阴、阳离子的电荷分布也是球形对称的,它们在空间各个方向上的静电作用相同,所以在各个方向上都可以与带相反电荷的离子发生静电作用,且在静电作用能达到的范围内,只要空间条件允许,一个离子可以同时吸引多个带相反电荷的离子。
因此,离子键没有方向性和饱和性。
二、离子晶体
1、定义:由阴、阳离子按一定方式有规则地排列形成的晶体。
2、成键粒子:
阴、阳离子
3、相互作用力:
离子键
强碱、活泼金属氧化物、大部分的盐类。
4、常见的离子晶体:
离子晶体是否具有较好的延展性?
思考
施加外力
发生滑动
阳离子
阴离子
同种电荷相互排斥,使晶面裂开
NaCl晶体
用手揉捏食盐
硬度大
生活经验
NaCl的物理性质
烧烤、爆炒等加入食盐,未见其熔融
熔点较高(801 oC)
离子晶体中阴、阳离子间相互作用力的大小可用晶格能来衡量。
Cl
Na+
离子晶体中,阴、阳离子间有强烈的相互作用(离子键),要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。
是指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量。
NaCl(s)→ Na+(g)+Cl-(g) U=786 kJ·mol-1
晶格能
符号为:U
影响晶格能的因素有哪些?
思考
阴、阳离子的电荷数越多,离子半径越小,晶格能越大。
离子晶体的结构
1、氯化钠型
属于氯化钠型离子晶体的还有KCl、NaBr、LiF、CaO、MgO、NiO、CaS等。
Cl
Na+
NaCl晶胞的模型
每个NaCl晶胞中含有4个Na+和4个Cl-, 个数比1:1。
每个NaCl晶胞中微粒数是多少?
思考
Cl
Na+
Cl
Na+
8
1
2
1
4
1
离子晶体中不存在单个分子,其化学式表示离子的个数比。
Na+
Cl-
3
1
5
6
2
4
1
5
4
2
3
6
每个Cl- 周围与之最接近且距离相等的Na+共有6个,每个Cl- 周围与它最近且等距的Cl- 有12个。
这几个Na+在空间构成的几何构型为正八面体
配位数
配位数:一个离子周围最邻近的异电性离子的数目
1、氯化钠型
Cl
Cs+
2、氯化铯型
CsCl、CsBr、CsI、NH4Cl等晶体都属于氯化铯型离子晶体。
Cl
Cs+
1
8
1
每个CsCl晶胞中含有1个Cs+和1个Cl-, 个数比1:1。
8× =1
Cs+和Cl-
配位数均为8
NaCl、CsCl都是AB型离子化合物,其中一种离子周围紧邻的带相反电荷的离子数目却不同。原因是什么?
思考
两者的数目之所以不同,主要在于离子半径的差异。Cs+的半径要大于Na+,因而可以吸引更多的Cl-。
在NaCl晶体中,每个Na+的周围有6个Cl-,
而在CsCl晶体中,每个Cs+的周围有8个Cl-。
可见,离子晶体中不同离子周围异电性离子数目的多少主要取决于阴、阳离子的相对大小。
硫酸铵晶体的结构
硫酸铵晶体的结构
实验测得,图中“H…O”原子间的距离为199 pm,小于H与O的范德华半径之和272 pm,大于H—O共价键的键长96 pm,说明二者之间的作用力大小在范德华力和共价键之间,且N—H与H…O之间的角度为156°,也符合形成氢键的条件。
由此,可以判断SO42-与NH4+之间形成的是氢键(N—H…O),而非离子键。
晶体相关计算
晶体的化学式表示的是晶体(也可以说是晶胞)中各类原子或离子数目的最简整数比
A
B
化学式:
AB
(A表示阳离子)
1、晶体化学式的确定
(A表示阳离子)
A
B
化学式:
A2B
A
B
化学式:
AB
(A表示阳离子)
B
化学式:
A
C
ABC3
(A表示阳离子)
晶体相关计算
2、晶体密度
ρ= m/V
根据晶胞结构确定各种粒子的数目
根据晶胞的边长或微粒间的距离
晶胞质量
晶胞体积
求
求
单位:g·cm-3
若氯化钠晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
NA×a3×10-30
4×58.5
a pm
=
Cl
Na+
8
1
2
1
4
1
a pm=a×10-10cm
NA×a3×10-30
234
=
g·cm-3
若氯化铯晶胞参数(晶胞正方形的边长)为a pm,请计算其密度。
NA×a3×10-30
168.5
a pm
=
g·cm-3
性质差异较大
离子晶体
阳离子
离子键
阴离子
晶格能
结构
计算
氯化钠型
氯化铯型
分子式
密度
课堂总结
1、 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
课堂练习
D
课堂练习
2、下列为离子晶体空间结构示意图,图中 为阳离子, 为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为( )
B
3、下图所示为某离子化合物的晶胞结构示意图,X、Y、Z表示该晶胞中三种不同的微粒,该化合物的化学式可表示为 。
XY3Z
4、某离子化合物A3B的晶胞结构示意图如上图所示。晶胞中与一个B相紧邻的A有 个,与一个A相紧邻的B有 个。
6
2
