2024年高三化学专题复习 离子交换膜在高考电化学中的应用 课件(共21张PPT)
文档属性
| 名称 | 2024年高三化学专题复习 离子交换膜在高考电化学中的应用 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 14:39:03 | ||
图片预览





文档简介
(共21张PPT)
离子交换膜在高考电化学中的应用
前置作业
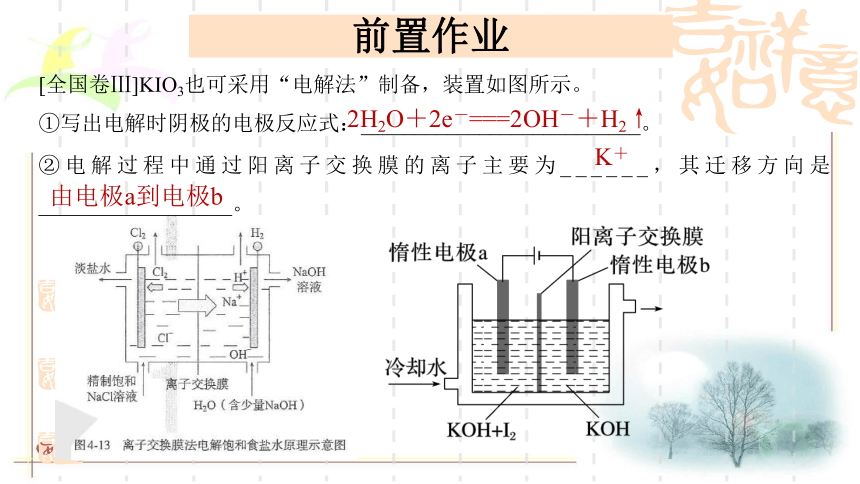
[全国卷Ⅲ]KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式:__________________________。
②电解过程中通过阳离子交换膜的离子主要为______,其迁移方向是__________________。
2H2O+2e-===2OH-+H2↑
K+
由电极a到电极b
【课标要求】
1.认识化学能与电能相互转化的实际意义及其重要应用。了解原电池及常见化学电源的工作原理。了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。
2.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。
【高考热点】
1.电极的判断及其电极反应式的书写或判断。
2. 两极产物及两极反应类型的判断。
3. 两极附近溶液的pH变化。(难点)
4. 电子、电流、离子移动方向,离子交换膜及其判断(重难点) 。
5. 电子守恒的相关计算。(难点)
主题一、单膜电化学装置及相关计算
1.离子交换膜的种类
2.原电池
负极:发生_______反应,电子______,电流______ ,______移向,电势___
正极:发生_________ 反应,电子______,电流______,______移向,电势___
氧化
还原
流出
流入
阴离子
低
高
流入
流出
阳离子
必备知识
阳离子交换膜(阳膜)只允许阳离子通过
阴离子交换膜(阴膜)只允许阴离子通过
质子交换膜(只允许H+通过)
双极膜(BP)阴阳复合膜,能解离出H+和OH-
主题一、单膜电化学装置及相关计算
3.电解池
阳极:发生_______反应,电子______,电流______ ,______移向,电势___
阴极:发生_________ 反应,电子______,电流______,______移向,电势___
氧化
还原
流出
流入
阴离子
高
低
流入
流出
阳离子
必备知识
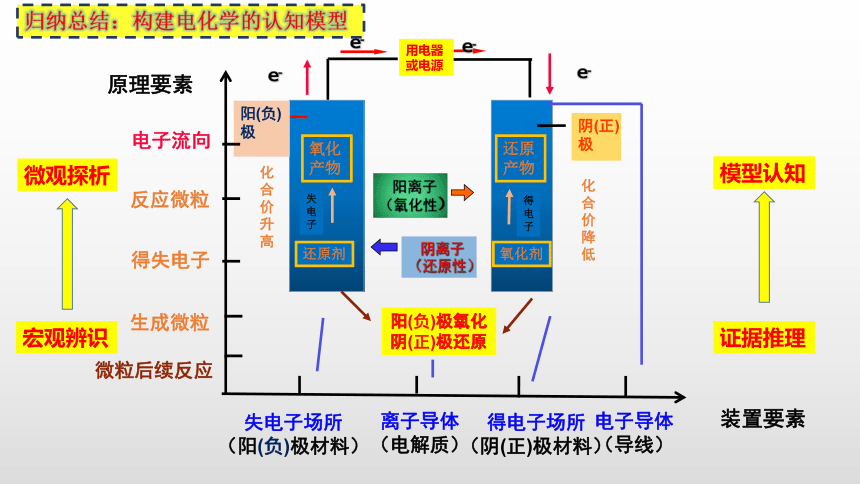
归纳总结:构建电化学的认知模型
e-
e-
阴(正)极
阳(负)极
化合
价升高
阳(负)极氧化
阴(正)极还原
氧化产物
阳离子(氧化性)
阴离子(还原性)
还原剂
失电子
还原产物
氧化剂
得电子
化合
价降低
装置要素
失电子场所
(阳(负)极材料)
离子导体
(电解质)
电子导体
(导线)
得电子场所
(阴(正)极材料)
反应微粒
生成微粒
电子流向
得失电子
微粒后续反应
原理要素
e-
e-
宏观辨识
微观探析
证据推理
模型认知
用电器或电源
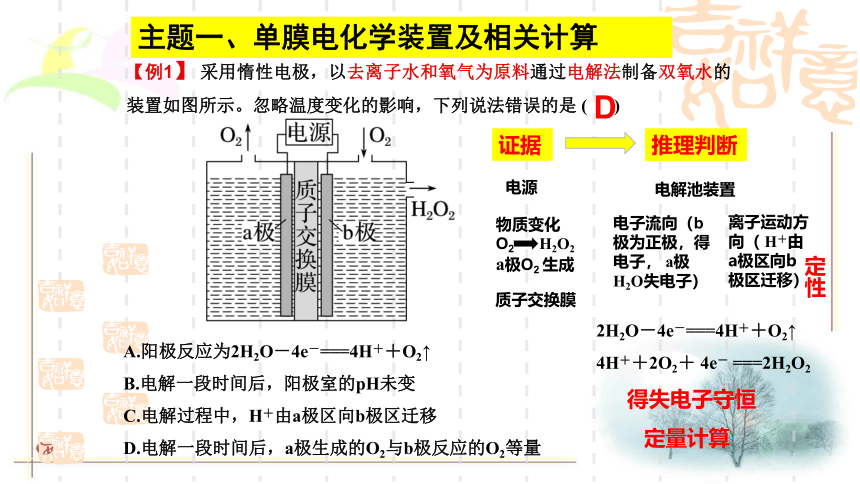
【例1】 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是 ( )
A.阳极反应为2H2O-4e-===4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
D
主题一、单膜电化学装置及相关计算
证据
推理判断
电源
离子运动方向( H+由a极区向b极区迁移)
物质变化
O2 H2O2
a极O2 生成
电子流向(b极为正极,得电子, a极H2O失电子)
电解池装置
定性
2H2O-4e-===4H++O2↑
4H++2O2+ 4e- ===2H2O2
质子交换膜
定量计算
得失电子守恒
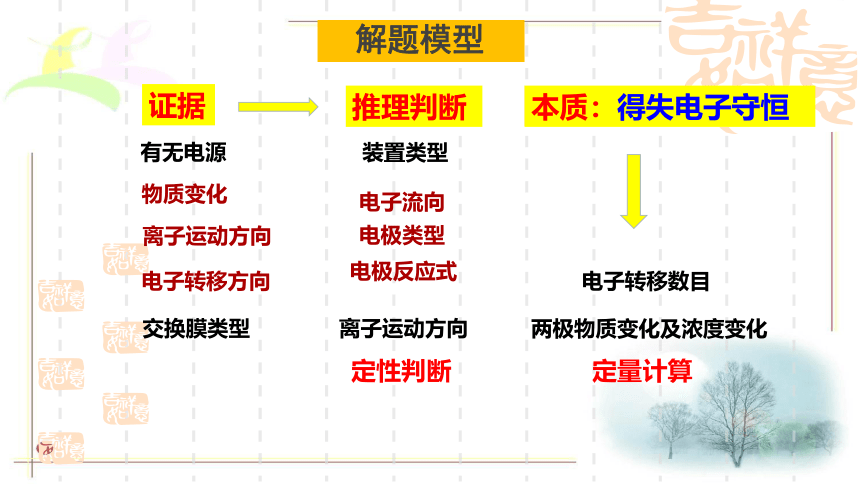
解题模型
证据
推理判断
有无电源
装置类型
物质变化
电子转移方向
离子运动方向
离子运动方向
交换膜类型
电子转移数目
两极物质变化及浓度变化
电子流向
电极类型
电极反应式
本质:得失电子守恒
定性判断
定量计算
【练习1】 微生物燃料电池能将污水中的乙二胺(H2NCH2CH2NH2)氧化成环境友好的物质,示意图如图所示,a、b均为石墨电极。下列说法错误的是( )
A.电池工作时质子通过质子交换膜由负极区向正极区移动
B.a电极的电极反应为H2NCH2CH2NH2-16e-+16OH-===2CO2↑+N2↑+ 12H2O
C.a电极上的电势比b电极上的电势低
D.电池工作时b电极附近溶液的pH保持不变
证据推理与模型认知
BD
H2NCH2CH2NH2-16e-+4H2O===2CO2↑+N2↑+16H+
【例2】 H3PO2(次磷酸)具有较强还原性,可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
阳极室的H+穿过阳膜至产品室,原料室的H2PO2-穿过阴膜至产品室,二者反应得到H3PO2
①分析产品室可得到H3PO2的原因
。
主题二、双膜及多膜电化学装置与相关计算
设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )
A. 装置工作时,甲室溶液pH逐渐增大
B. 装置工作一段时间后,乙室应补充盐酸
C. 乙室电极反应式为LiCoO2+2H2O+e-=Li++Co2++ 4OH-
D. 若甲室Co2+减少200mg ,乙室Co2+增加 300mg ,则此时已进行过溶液转移
证据推理与模型认知
【练习2】
解题模型
证据
推理判断
右侧装置为原电池
原电池和电解池串联
离子运动方向:(H+)移向正(阴)极
交换膜类型:阳膜
回收金属钴,
降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2转化为Co2+
阳极:
CH3COO--8 e-+2H2O =2CO2↑+7 H+
阴极:
Co2++2e- =Co
负极:
CH3COO- -8 e-+2H2O =2CO2↑+7 H+
正极:
LiCoO2+e-+4H+=Li++Co2++2H2O
定性判断
本质:得失电子守恒
定量计算
2e- ~ Co2+ ~ 2Co2+
【例3】微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是 ( )
A.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
B
主题三、离子交换膜类型的判断
证据
推理判断
获得电能
物质变化
CH3COO- CO2
电子流向(a极为负极,失电子 )
原电池装置
海水淡化
定量计算
得失 电子
守恒
Na+,Cl-定向移动
本质
双极膜能够在直流电场作用下将H2O解离为H+和OH-。以维生素C的钠盐(C6H7O6Na)为原料制备维生素C(C6H8O6,具有弱酸性和还原性)的装置示意图如图。下列说法错误的是( )
A.X极右侧的离子交换膜能有效阻止H+、Na+通过
B.将X极区的Na2SO4替换为C6H7O6Na,可以提高维生素C的产率
C.a离子是OH-,b离子是H+
D.阴极区附近pH增大
AB
【练习3】
证据推理与模型认知
高考预测
低成本双膜结构液流电池
来源:Nature Communications 2022.5.2
一种稳定且具有低成本效益的碱性混合多硫化物-空气氧化还原液流电池可广泛应用于再生能源储能和智能电网的备用电源等,结构如图所示。图中贮液器可储存电解质溶液,提高电池的容量下列说法正确的是( )
A.膜a为阴离子膜,膜b为阳离子膜
B.放电时,左侧贮液室中含S42-的多硫电解质减少
C.充电时的总反应为: 4OH- + 2S42- =4S22- + O2 + 2H2O
D.放电时,外电路通过2mol电子,理论上II室及右侧贮液器中的NaOH总共减少2mol
科学精神与创新意识
c
科学态度与社会责任
原电池
电解池
知识小结(必备知识)
二次电池
多池串联
阳极
失电子
氧化反应
得电子
阴极
还原反应
定性
负极
正极
得失电子守恒
定 量
阴离子移向
阳离子移向
关键能力:抓住反应目的,识别有效证据,科学推理论证。先定性,后定量。
反应
看特征
抓实质
定性
电池电极种类、书写
书写模型
粒子变化,离子交换膜种类,离子迁移方向
定量
抓得失电子守恒
计算
列物质
标得失
看环境
配守恒
Zn-Cu原电池
氯碱工业
原电池是自发进行的氧化还原反应,电解是外加电源下的非自发氧化还原反应
个别
一般
转化观
微粒观
思维方法
认识层面
认识角度
认识水平
微粒转化
物质转化
能量转化
化学观念
推理与验证
类比与迁移
分析与归纳
宏观辨识
微观探析
证据推理
模型认知
科学探究
创新意识
科学态度社会责任
课堂小结
“宏观-微观-符号“三重表征
能量观
电能 化学能
阳离子
阴(正)极(还原反应)
阴离子
阳(负)极(氧化反应)
交换膜
课后
作业
谢谢!
离子交换膜在高考电化学中的应用
前置作业
[全国卷Ⅲ]KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式:__________________________。
②电解过程中通过阳离子交换膜的离子主要为______,其迁移方向是__________________。
2H2O+2e-===2OH-+H2↑
K+
由电极a到电极b
【课标要求】
1.认识化学能与电能相互转化的实际意义及其重要应用。了解原电池及常见化学电源的工作原理。了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。
2.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。
【高考热点】
1.电极的判断及其电极反应式的书写或判断。
2. 两极产物及两极反应类型的判断。
3. 两极附近溶液的pH变化。(难点)
4. 电子、电流、离子移动方向,离子交换膜及其判断(重难点) 。
5. 电子守恒的相关计算。(难点)
主题一、单膜电化学装置及相关计算
1.离子交换膜的种类
2.原电池
负极:发生_______反应,电子______,电流______ ,______移向,电势___
正极:发生_________ 反应,电子______,电流______,______移向,电势___
氧化
还原
流出
流入
阴离子
低
高
流入
流出
阳离子
必备知识
阳离子交换膜(阳膜)只允许阳离子通过
阴离子交换膜(阴膜)只允许阴离子通过
质子交换膜(只允许H+通过)
双极膜(BP)阴阳复合膜,能解离出H+和OH-
主题一、单膜电化学装置及相关计算
3.电解池
阳极:发生_______反应,电子______,电流______ ,______移向,电势___
阴极:发生_________ 反应,电子______,电流______,______移向,电势___
氧化
还原
流出
流入
阴离子
高
低
流入
流出
阳离子
必备知识
归纳总结:构建电化学的认知模型
e-
e-
阴(正)极
阳(负)极
化合
价升高
阳(负)极氧化
阴(正)极还原
氧化产物
阳离子(氧化性)
阴离子(还原性)
还原剂
失电子
还原产物
氧化剂
得电子
化合
价降低
装置要素
失电子场所
(阳(负)极材料)
离子导体
(电解质)
电子导体
(导线)
得电子场所
(阴(正)极材料)
反应微粒
生成微粒
电子流向
得失电子
微粒后续反应
原理要素
e-
e-
宏观辨识
微观探析
证据推理
模型认知
用电器或电源
【例1】 采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是 ( )
A.阳极反应为2H2O-4e-===4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
D
主题一、单膜电化学装置及相关计算
证据
推理判断
电源
离子运动方向( H+由a极区向b极区迁移)
物质变化
O2 H2O2
a极O2 生成
电子流向(b极为正极,得电子, a极H2O失电子)
电解池装置
定性
2H2O-4e-===4H++O2↑
4H++2O2+ 4e- ===2H2O2
质子交换膜
定量计算
得失电子守恒
解题模型
证据
推理判断
有无电源
装置类型
物质变化
电子转移方向
离子运动方向
离子运动方向
交换膜类型
电子转移数目
两极物质变化及浓度变化
电子流向
电极类型
电极反应式
本质:得失电子守恒
定性判断
定量计算
【练习1】 微生物燃料电池能将污水中的乙二胺(H2NCH2CH2NH2)氧化成环境友好的物质,示意图如图所示,a、b均为石墨电极。下列说法错误的是( )
A.电池工作时质子通过质子交换膜由负极区向正极区移动
B.a电极的电极反应为H2NCH2CH2NH2-16e-+16OH-===2CO2↑+N2↑+ 12H2O
C.a电极上的电势比b电极上的电势低
D.电池工作时b电极附近溶液的pH保持不变
证据推理与模型认知
BD
H2NCH2CH2NH2-16e-+4H2O===2CO2↑+N2↑+16H+
【例2】 H3PO2(次磷酸)具有较强还原性,可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
阳极室的H+穿过阳膜至产品室,原料室的H2PO2-穿过阴膜至产品室,二者反应得到H3PO2
①分析产品室可得到H3PO2的原因
。
主题二、双膜及多膜电化学装置与相关计算
设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )
A. 装置工作时,甲室溶液pH逐渐增大
B. 装置工作一段时间后,乙室应补充盐酸
C. 乙室电极反应式为LiCoO2+2H2O+e-=Li++Co2++ 4OH-
D. 若甲室Co2+减少200mg ,乙室Co2+增加 300mg ,则此时已进行过溶液转移
证据推理与模型认知
【练习2】
解题模型
证据
推理判断
右侧装置为原电池
原电池和电解池串联
离子运动方向:(H+)移向正(阴)极
交换膜类型:阳膜
回收金属钴,
降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2转化为Co2+
阳极:
CH3COO--8 e-+2H2O =2CO2↑+7 H+
阴极:
Co2++2e- =Co
负极:
CH3COO- -8 e-+2H2O =2CO2↑+7 H+
正极:
LiCoO2+e-+4H+=Li++Co2++2H2O
定性判断
本质:得失电子守恒
定量计算
2e- ~ Co2+ ~ 2Co2+
【例3】微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是 ( )
A.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
B
主题三、离子交换膜类型的判断
证据
推理判断
获得电能
物质变化
CH3COO- CO2
电子流向(a极为负极,失电子 )
原电池装置
海水淡化
定量计算
得失 电子
守恒
Na+,Cl-定向移动
本质
双极膜能够在直流电场作用下将H2O解离为H+和OH-。以维生素C的钠盐(C6H7O6Na)为原料制备维生素C(C6H8O6,具有弱酸性和还原性)的装置示意图如图。下列说法错误的是( )
A.X极右侧的离子交换膜能有效阻止H+、Na+通过
B.将X极区的Na2SO4替换为C6H7O6Na,可以提高维生素C的产率
C.a离子是OH-,b离子是H+
D.阴极区附近pH增大
AB
【练习3】
证据推理与模型认知
高考预测
低成本双膜结构液流电池
来源:Nature Communications 2022.5.2
一种稳定且具有低成本效益的碱性混合多硫化物-空气氧化还原液流电池可广泛应用于再生能源储能和智能电网的备用电源等,结构如图所示。图中贮液器可储存电解质溶液,提高电池的容量下列说法正确的是( )
A.膜a为阴离子膜,膜b为阳离子膜
B.放电时,左侧贮液室中含S42-的多硫电解质减少
C.充电时的总反应为: 4OH- + 2S42- =4S22- + O2 + 2H2O
D.放电时,外电路通过2mol电子,理论上II室及右侧贮液器中的NaOH总共减少2mol
科学精神与创新意识
c
科学态度与社会责任
原电池
电解池
知识小结(必备知识)
二次电池
多池串联
阳极
失电子
氧化反应
得电子
阴极
还原反应
定性
负极
正极
得失电子守恒
定 量
阴离子移向
阳离子移向
关键能力:抓住反应目的,识别有效证据,科学推理论证。先定性,后定量。
反应
看特征
抓实质
定性
电池电极种类、书写
书写模型
粒子变化,离子交换膜种类,离子迁移方向
定量
抓得失电子守恒
计算
列物质
标得失
看环境
配守恒
Zn-Cu原电池
氯碱工业
原电池是自发进行的氧化还原反应,电解是外加电源下的非自发氧化还原反应
个别
一般
转化观
微粒观
思维方法
认识层面
认识角度
认识水平
微粒转化
物质转化
能量转化
化学观念
推理与验证
类比与迁移
分析与归纳
宏观辨识
微观探析
证据推理
模型认知
科学探究
创新意识
科学态度社会责任
课堂小结
“宏观-微观-符号“三重表征
能量观
电能 化学能
阳离子
阴(正)极(还原反应)
阴离子
阳(负)极(氧化反应)
交换膜
课后
作业
谢谢!
同课章节目录
