2023-2024学年人教版高中化学必修二 5.1.1硫及其化合物 课件(共37张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学必修二 5.1.1硫及其化合物 课件(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 47.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 14:39:44 | ||
图片预览






文档简介
(共37张PPT)
《 硫及其化合物》(第一课时)
硫和二氧化硫
[学科核心素养发展目标]
1.能运用模型认知从物质类别、元素化合价的角度分析与推测硫和二氧化硫的性质。
2. 能科学的探究二氧化硫的性质。
3.能结合SO2的性质理解SO2在生活中的用途,
并能建立定量思维及辩证认识问题的科学态度。
自然界中的硫元素
火山喷发口的硫单质
自然界中的含硫矿物
生石膏CaSO4·2H2O
重晶石BaSO4
芒硝Na2SO4·10H2O
绿矾FeSO4·7H2O
蓝矾CuSO4·5H2O
明矾KAl(SO4)2·12H2O
黄铜矿CuFeS2
硫铁矿FeS2
朱砂HgS
煤和石油等
化石燃料
蛋白质
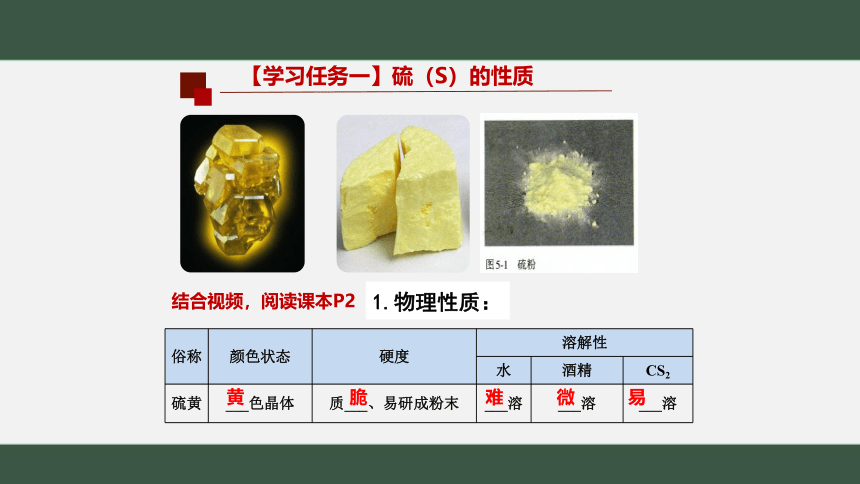
1.物理性质:
【学习任务一】硫(S)的性质
俗称 颜色状态 硬度 溶解性
水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
结合视频,阅读课本P2
难 微 易
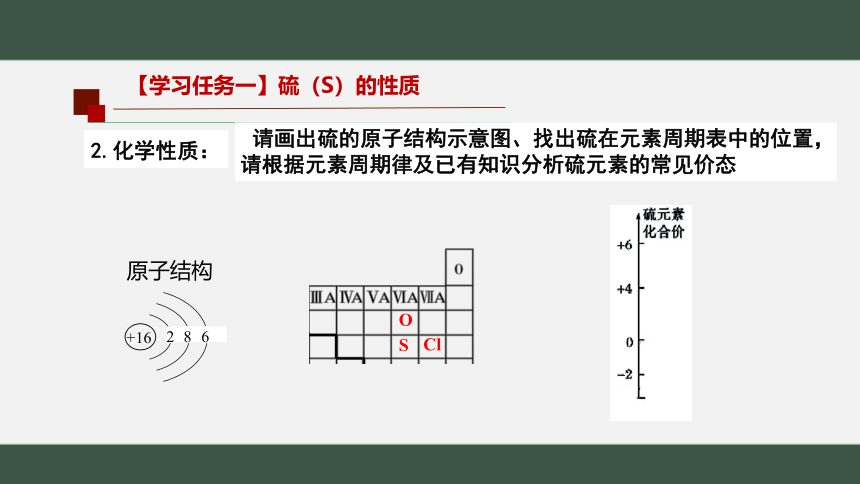
【学习任务一】硫(S)的性质
请画出硫的原子结构示意图、找出硫在元素周期表中的位置,
请根据元素周期律及已有知识分析硫元素的常见价态
2.化学性质:
原子结构
+16
2
8
6
O
S
Cl
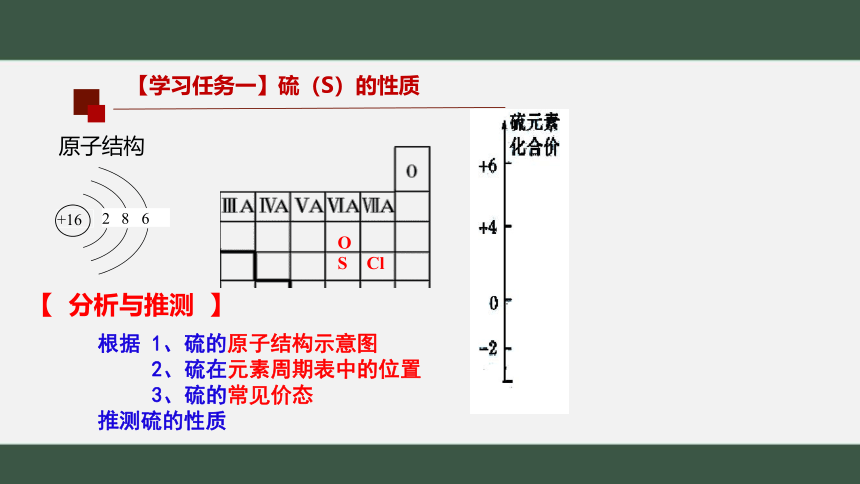
【学习任务一】硫(S)的性质
根据 1、硫的原子结构示意图
2、硫在元素周期表中的位置
3、硫的常见价态
推测硫的性质
原子结构
+16
2
8
6
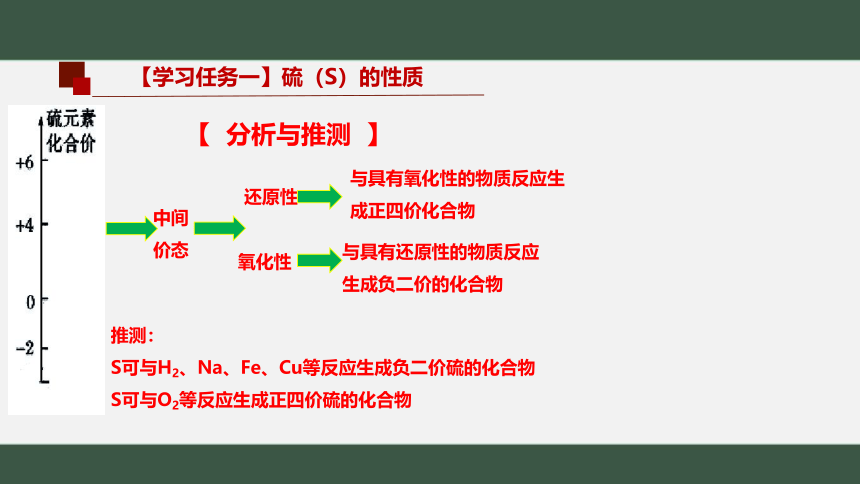
【 分析与推测 】
O
S
Cl
【学习任务一】硫(S)的性质
原子结构
+16
2
8
6
【 分析与推测 】
易
得电子
表现出
氧化性
可与具有还原性的金属或非金属单质反应
推测:S可与H2、Na、Fe、Cu等反应
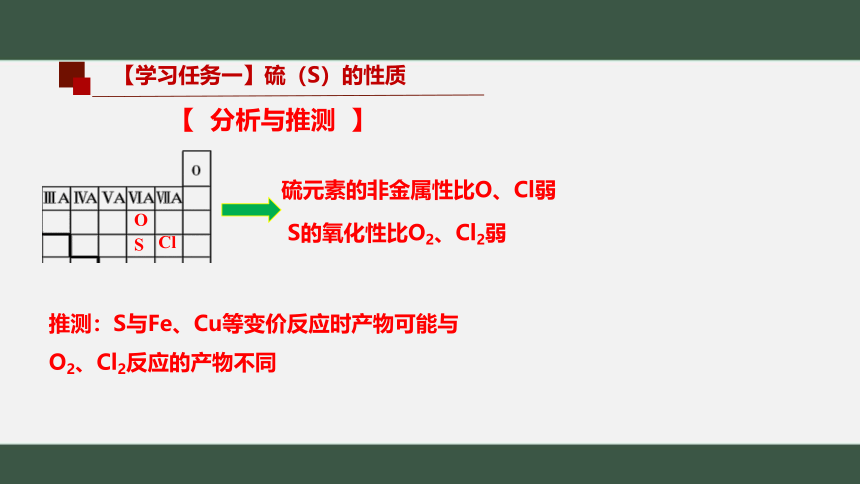
【学习任务一】硫(S)的性质
【 分析与推测 】
硫元素的非金属性比O、Cl弱
O
S
Cl
S的氧化性比O2、Cl2弱
推测:S与Fe、Cu等变价反应时产物可能与O2、Cl2反应的产物不同
【学习任务一】硫(S)的性质
【 分析与推测 】
中间
价态
还原性
与具有氧化性的物质反应生成正四价化合物
与具有还原性的物质反应生成负二价的化合物
氧化性
推测:
S可与H2、Na、Fe、Cu等反应生成负二价硫的化合物
S可与O2等反应生成正四价硫的化合物
【学习任务一】硫(S)的性质
硫与氧气
硫与铁
【学习任务一】硫(S)的性质
还原性
氧化性
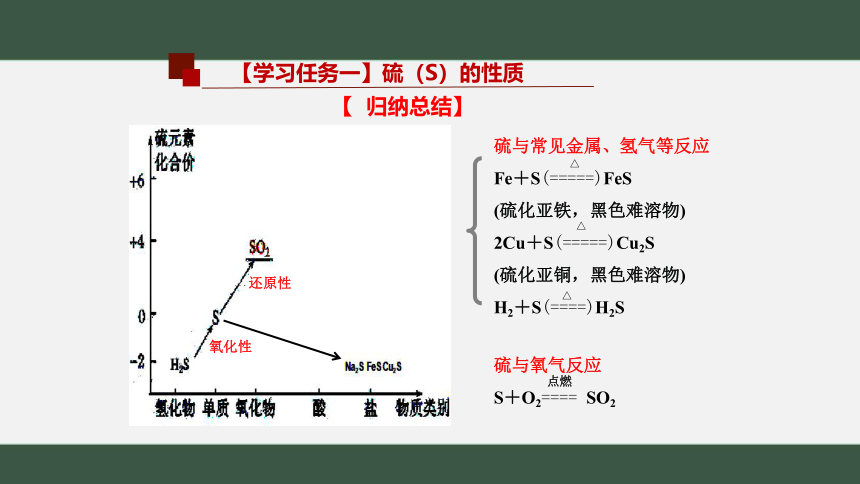
【 归纳总结】
硫与常见金属、氢气等反应
Fe+S(=====)FeS
(硫化亚铁,黑色难溶物)
2Cu+S(=====)Cu2S
(硫化亚铜,黑色难溶物)
H2+S(====)H2S
△
△
△
硫与氧气反应
S+O2==== SO2
点燃
物质组成
物质类别
类别通性
物质结构
核心元素
化合价
氧化性
还原性
原子结构
元素性质
元素周期律
物质
【思维建模】-----元素化合物
【 一硫二硝(KNO3)三木炭 】
【学习任务一】硫(S)的性质 :硫单质的用途
二氧化硫溶于水演示实验视频:
观看视频总结:SO2的物理性质有哪些?
【学习任务二】二氧化硫(SO2)的性质
无色
气态
刺激性
大
【学习任务二】二氧化硫(SO2)的性质
1.物理性质:
颜色 状态 气味 毒性 密度 溶解性
_____ 气味 有毒 比空气___
易溶于水
(1∶40)
【学习任务二】二氧化硫(SO2)的性质
课本P3
2.化学性质:
【学习任务二】二氧化硫(SO2)的性质
根据硫及其化合物的价类二维图从物质类别、元素价态的角度推测SO2的性质
分析与推测
还原性
与具有氧化性的物质反应生成正六价化合物
氧化性
与具有还原性的物质反应生成硫单质或更低价态的化合物
中间
价态
【 分析与推测 】
酸性
氧化物
物质
类别
氧化
还原
与水反应生成酸
与碱反应生成盐和水
与碱性氧化物反应生成盐
【学习任务二】二氧化硫(SO2)的性质
【学习任务二】二氧化硫(SO2)的性质
实验用品 二氧化硫、石蕊试液、澄清石灰水、高锰酸钾溶液、硫化氢溶液
设计 实验方案
实验操作
实验现象
实验结论
2.化学性质:
【学习任务二】二氧化硫(SO2)的性质
二氧化硫性质演示实验视频:
【学习任务二】二氧化硫(SO2)的性质
二氧化硫性质演示实验视频:
【学习任务二】二氧化硫(SO2)的性质
实验 现象 方程式 结论
石蕊
石灰水
高锰酸钾溶液
硫化钠溶液
H2O +SO2 ≒ H2SO3
SO2具有
酸性氧化物的通性
Ca(OH)2+SO2 = CaSO3 ↓+ H2O
【实验探究】选取试剂设计实验验证SO2的性质
溶液
变浑浊
变红
褪色
黄色沉淀
5 SO2 + 2KMnO4 + 2 H2O = K2SO4 + 2MnSO4 + 2H2SO4
SO2具有还原性
SO2 + 2H2S =3 S ↓ +2 H2O
SO2具有氧化性
【学习任务二】二氧化硫(SO2)的性质
二氧化硫
酸性
氧化物
与水反应
与碱性氧化物反应
与碱反应
+4价
还原性
氧化性
归纳总结
SO2具有较强的还原性,可以被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化
【学习任务二】二氧化硫(SO2)的性质
学以致用
请利用硫元素的价类二维图分析如何用二氧化硫制得硫酸?
【学习任务二】二氧化硫(SO2)的性质
课本P3
【学习任务二】二氧化硫(SO2)的性质
实验探究:
向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化
【学习任务二】二氧化硫(SO2)的性质
实验探究:
向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化
实验内容
实验现象
结论
品红溶液褪色
SO2具有漂白性
向品红溶液中通SO2
将褪色后的溶液加热
恢复红色
SO2 漂白作用不稳定
【学习任务二】二氧化硫(SO2)的性质
几种具有漂白性物质的性质比较:
物质 氯水、Na2O2 SO2 木炭
原理
实质
效果
范围
可漂白大多数有色物质,能使酸碱指示剂褪色。
可漂白某些有色物质,不能使酸碱指示剂褪色。
可吸附某些有色物质的分子
利用其氧化性将有色物质氧化为
稳定的无色物质
与某些有色物质
化合生成不稳定的无色物质
将有色物质的分子吸附在其表面
永久性
暂时性
暂时性
氧化还原反应
非氧化还原反应
物理吸附
【学习任务二】二氧化硫(SO2)的性质
二氧化硫
特性
漂白性
酸性氧化物
与水反应
与碱性氧化物反应
与碱反应
+4价
还原性
氧化性
归纳总结
用途
【学习任务二】二氧化硫(SO2)的性质
食品和干果防腐剂
漂白纸张
制造硫酸
学以致用
杀死葡萄皮表面的杂菌
抗氧化剂
【学习任务二】二氧化硫(SO2)的性质
课本P4
【学习任务二】二氧化硫(SO2)的性质
【学习任务二】二氧化硫(SO2)的性质
酸雨对环境的危害
【学习任务二】二氧化硫(SO2)的性质
1、某学习小组同学在一硫酸厂附近采集了酸雨样品,每隔一段时间测定其pH,数据记录如下:
时间 开始 8小时 16小时 24小时 32小时 40小时
pH 4.7 4.5 4.1 4.0 4.0 4.0
试分析上述实验数据变化的可能原因。
2、如何防治酸雨?
【学习任务二】二氧化硫(SO2)的性质
如何看待SO2?
*危害:形成酸雨;造成大气污染;危害人体健康
*用途:制造硫酸;漂白纸浆、草帽等;杀菌、抗氧化、防腐
*任何事物都具有两面性,看问题应一分为二
*不合理利用化学物质会危害人类,
合理利用化学物质可以造福人类
物质组成
物质类别
类别通性
物质结构
核心元素
化合价
氧化性
还原性
物质特性
学习方法
科学探究
物质性质
程序模型
预测性质
设计方案
实验验证
得出结论
思维模型
结构决定性质
定量思维
辩证认识问题
【思维建模】-----元素化合物
《 硫及其化合物》(第一课时)
硫和二氧化硫
[学科核心素养发展目标]
1.能运用模型认知从物质类别、元素化合价的角度分析与推测硫和二氧化硫的性质。
2. 能科学的探究二氧化硫的性质。
3.能结合SO2的性质理解SO2在生活中的用途,
并能建立定量思维及辩证认识问题的科学态度。
自然界中的硫元素
火山喷发口的硫单质
自然界中的含硫矿物
生石膏CaSO4·2H2O
重晶石BaSO4
芒硝Na2SO4·10H2O
绿矾FeSO4·7H2O
蓝矾CuSO4·5H2O
明矾KAl(SO4)2·12H2O
黄铜矿CuFeS2
硫铁矿FeS2
朱砂HgS
煤和石油等
化石燃料
蛋白质
1.物理性质:
【学习任务一】硫(S)的性质
俗称 颜色状态 硬度 溶解性
水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
结合视频,阅读课本P2
难 微 易
【学习任务一】硫(S)的性质
请画出硫的原子结构示意图、找出硫在元素周期表中的位置,
请根据元素周期律及已有知识分析硫元素的常见价态
2.化学性质:
原子结构
+16
2
8
6
O
S
Cl
【学习任务一】硫(S)的性质
根据 1、硫的原子结构示意图
2、硫在元素周期表中的位置
3、硫的常见价态
推测硫的性质
原子结构
+16
2
8
6
【 分析与推测 】
O
S
Cl
【学习任务一】硫(S)的性质
原子结构
+16
2
8
6
【 分析与推测 】
易
得电子
表现出
氧化性
可与具有还原性的金属或非金属单质反应
推测:S可与H2、Na、Fe、Cu等反应
【学习任务一】硫(S)的性质
【 分析与推测 】
硫元素的非金属性比O、Cl弱
O
S
Cl
S的氧化性比O2、Cl2弱
推测:S与Fe、Cu等变价反应时产物可能与O2、Cl2反应的产物不同
【学习任务一】硫(S)的性质
【 分析与推测 】
中间
价态
还原性
与具有氧化性的物质反应生成正四价化合物
与具有还原性的物质反应生成负二价的化合物
氧化性
推测:
S可与H2、Na、Fe、Cu等反应生成负二价硫的化合物
S可与O2等反应生成正四价硫的化合物
【学习任务一】硫(S)的性质
硫与氧气
硫与铁
【学习任务一】硫(S)的性质
还原性
氧化性
【 归纳总结】
硫与常见金属、氢气等反应
Fe+S(=====)FeS
(硫化亚铁,黑色难溶物)
2Cu+S(=====)Cu2S
(硫化亚铜,黑色难溶物)
H2+S(====)H2S
△
△
△
硫与氧气反应
S+O2==== SO2
点燃
物质组成
物质类别
类别通性
物质结构
核心元素
化合价
氧化性
还原性
原子结构
元素性质
元素周期律
物质
【思维建模】-----元素化合物
【 一硫二硝(KNO3)三木炭 】
【学习任务一】硫(S)的性质 :硫单质的用途
二氧化硫溶于水演示实验视频:
观看视频总结:SO2的物理性质有哪些?
【学习任务二】二氧化硫(SO2)的性质
无色
气态
刺激性
大
【学习任务二】二氧化硫(SO2)的性质
1.物理性质:
颜色 状态 气味 毒性 密度 溶解性
_____ 气味 有毒 比空气___
易溶于水
(1∶40)
【学习任务二】二氧化硫(SO2)的性质
课本P3
2.化学性质:
【学习任务二】二氧化硫(SO2)的性质
根据硫及其化合物的价类二维图从物质类别、元素价态的角度推测SO2的性质
分析与推测
还原性
与具有氧化性的物质反应生成正六价化合物
氧化性
与具有还原性的物质反应生成硫单质或更低价态的化合物
中间
价态
【 分析与推测 】
酸性
氧化物
物质
类别
氧化
还原
与水反应生成酸
与碱反应生成盐和水
与碱性氧化物反应生成盐
【学习任务二】二氧化硫(SO2)的性质
【学习任务二】二氧化硫(SO2)的性质
实验用品 二氧化硫、石蕊试液、澄清石灰水、高锰酸钾溶液、硫化氢溶液
设计 实验方案
实验操作
实验现象
实验结论
2.化学性质:
【学习任务二】二氧化硫(SO2)的性质
二氧化硫性质演示实验视频:
【学习任务二】二氧化硫(SO2)的性质
二氧化硫性质演示实验视频:
【学习任务二】二氧化硫(SO2)的性质
实验 现象 方程式 结论
石蕊
石灰水
高锰酸钾溶液
硫化钠溶液
H2O +SO2 ≒ H2SO3
SO2具有
酸性氧化物的通性
Ca(OH)2+SO2 = CaSO3 ↓+ H2O
【实验探究】选取试剂设计实验验证SO2的性质
溶液
变浑浊
变红
褪色
黄色沉淀
5 SO2 + 2KMnO4 + 2 H2O = K2SO4 + 2MnSO4 + 2H2SO4
SO2具有还原性
SO2 + 2H2S =3 S ↓ +2 H2O
SO2具有氧化性
【学习任务二】二氧化硫(SO2)的性质
二氧化硫
酸性
氧化物
与水反应
与碱性氧化物反应
与碱反应
+4价
还原性
氧化性
归纳总结
SO2具有较强的还原性,可以被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化
【学习任务二】二氧化硫(SO2)的性质
学以致用
请利用硫元素的价类二维图分析如何用二氧化硫制得硫酸?
【学习任务二】二氧化硫(SO2)的性质
课本P3
【学习任务二】二氧化硫(SO2)的性质
实验探究:
向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化
【学习任务二】二氧化硫(SO2)的性质
实验探究:
向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化
实验内容
实验现象
结论
品红溶液褪色
SO2具有漂白性
向品红溶液中通SO2
将褪色后的溶液加热
恢复红色
SO2 漂白作用不稳定
【学习任务二】二氧化硫(SO2)的性质
几种具有漂白性物质的性质比较:
物质 氯水、Na2O2 SO2 木炭
原理
实质
效果
范围
可漂白大多数有色物质,能使酸碱指示剂褪色。
可漂白某些有色物质,不能使酸碱指示剂褪色。
可吸附某些有色物质的分子
利用其氧化性将有色物质氧化为
稳定的无色物质
与某些有色物质
化合生成不稳定的无色物质
将有色物质的分子吸附在其表面
永久性
暂时性
暂时性
氧化还原反应
非氧化还原反应
物理吸附
【学习任务二】二氧化硫(SO2)的性质
二氧化硫
特性
漂白性
酸性氧化物
与水反应
与碱性氧化物反应
与碱反应
+4价
还原性
氧化性
归纳总结
用途
【学习任务二】二氧化硫(SO2)的性质
食品和干果防腐剂
漂白纸张
制造硫酸
学以致用
杀死葡萄皮表面的杂菌
抗氧化剂
【学习任务二】二氧化硫(SO2)的性质
课本P4
【学习任务二】二氧化硫(SO2)的性质
【学习任务二】二氧化硫(SO2)的性质
酸雨对环境的危害
【学习任务二】二氧化硫(SO2)的性质
1、某学习小组同学在一硫酸厂附近采集了酸雨样品,每隔一段时间测定其pH,数据记录如下:
时间 开始 8小时 16小时 24小时 32小时 40小时
pH 4.7 4.5 4.1 4.0 4.0 4.0
试分析上述实验数据变化的可能原因。
2、如何防治酸雨?
【学习任务二】二氧化硫(SO2)的性质
如何看待SO2?
*危害:形成酸雨;造成大气污染;危害人体健康
*用途:制造硫酸;漂白纸浆、草帽等;杀菌、抗氧化、防腐
*任何事物都具有两面性,看问题应一分为二
*不合理利用化学物质会危害人类,
合理利用化学物质可以造福人类
物质组成
物质类别
类别通性
物质结构
核心元素
化合价
氧化性
还原性
物质特性
学习方法
科学探究
物质性质
程序模型
预测性质
设计方案
实验验证
得出结论
思维模型
结构决定性质
定量思维
辩证认识问题
【思维建模】-----元素化合物
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
