6.3二氧化碳和一氧化碳 练习-2023-2024学年九年级化学人教版上册(word 无答案)
文档属性
| 名称 | 6.3二氧化碳和一氧化碳 练习-2023-2024学年九年级化学人教版上册(word 无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 151.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 00:00:00 | ||
图片预览

文档简介
人教版九年级上6.3二氧化碳和一氧化碳
一、选择题
1. 空气中能参与光合作用的气体是
A.二氧化碳 B.氮气 C.稀有气体 D.氧气
2. 二氧化碳在生产、生活中具有多种用途。下列有关二氧化碳的用途不正确的是
A.灭火 B.气体肥料
C.光合作用 D.冰箱除味剂
3. 我国承诺力争在2030年前实现“碳达峰”,2060年前实现"碳中和”。这里的“碳”指的是
A.一氧化碳 B.碳单质 C.二氧化碳 D.碳元素
4. 下列有关空气成分的说法错误的是
A.利用氦气可制作霓虹灯 B.食品包装中充入氮气用来防腐
C.利用二氧化碳可以制作碳酸饮料 D.发射火箭时用氧气作燃料
5. 化学变化是人们改造和应用物质的重要途径,下列过程可通过化学变化实现的是
A.工业上分离液态空气制得液氧 B.O2分子转化成O3分子
C.干冰用于人工降雨 D.滑雪场以水为原料用造雪机人工造雪
6. 关于CO和CO2的说法正确的是
A.CO和CO2组成元素相同,故化学性质也相同
B.两者都可以通过木炭燃烧得到
C.CO能燃烧,故可用于冶炼金属
D.CO2易溶于水,故不能用排水法收集
7. 2022年6月5日是第50个世界环境日,中国主题是“共建清洁美丽世界”,旨在进一步深化“绿水青山就是金山银山”的发展理念。下列做法不符合这一主题的是
A.开发新能源,替代化石燃料,实现节能减排
B.限制燃放烟花爆竹,文明庆贺节日
C.大力提倡农作物秸秆就地焚烧,为土壤提供肥料
D.积极植树造林,严禁乱砍乱伐,促进达成“碳中和”目标
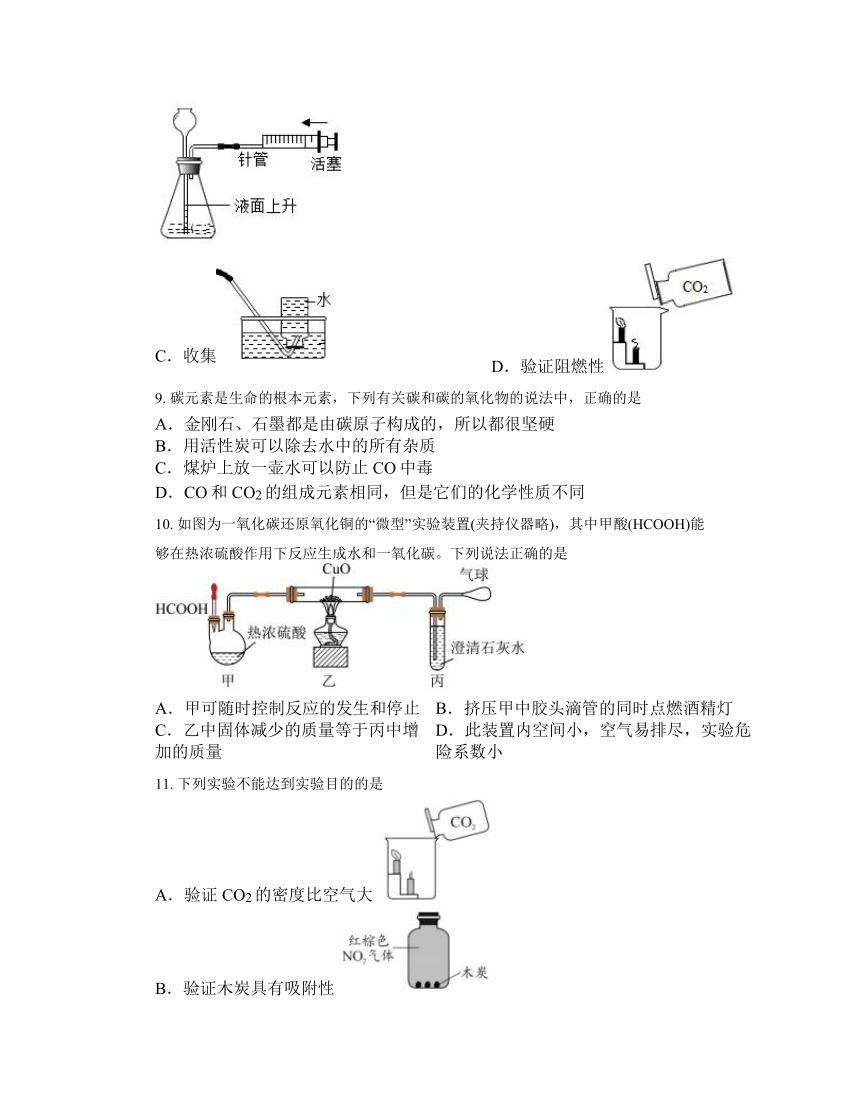
8. 下列是实验室制取二氧化碳并验证相关性质的操作,其中不正确的是
A.检查装置气密性 B.装入石灰石
C.收集 D.验证阻燃性
9. 碳元素是生命的根本元素,下列有关碳和碳的氧化物的说法中,正确的是
A.金刚石、石墨都是由碳原子构成的,所以都很坚硬
B.用活性炭可以除去水中的所有杂质
C.煤炉上放一壶水可以防止CO中毒
D.CO和CO2的组成元素相同,但是它们的化学性质不同
10. 如图为一氧化碳还原氧化铜的“微型”实验装置(夹持仪器略),其中甲酸(HCOOH)能够在热浓硫酸作用下反应生成水和一氧化碳。下列说法正确的是
A.甲可随时控制反应的发生和停止 B.挤压甲中胶头滴管的同时点燃酒精灯
C.乙中固体减少的质量等于丙中增加的质量 D.此装置内空间小,空气易排尽,实验危险系数小
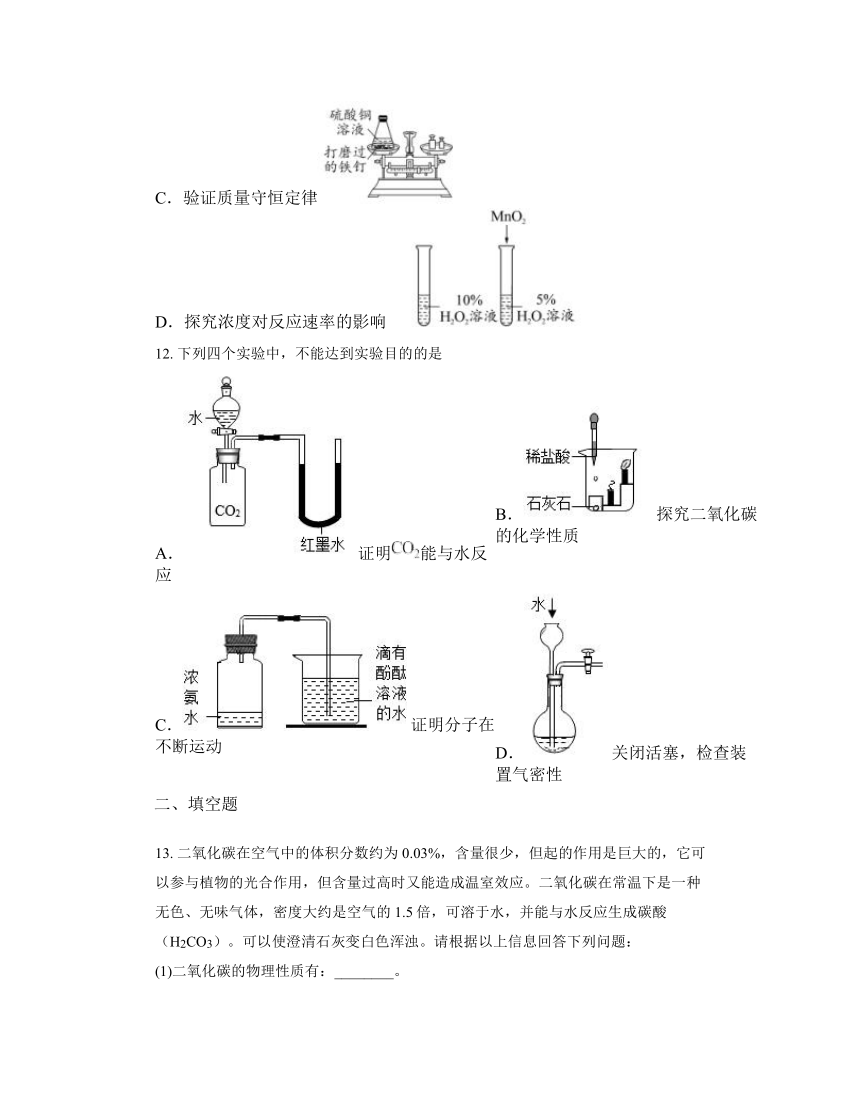
11. 下列实验不能达到实验目的的是
A.验证CO2的密度比空气大
B.验证木炭具有吸附性
C.验证质量守恒定律
D.探究浓度对反应速率的影响
12. 下列四个实验中,不能达到实验目的的是
A. 证明能与水反应 B. 探究二氧化碳的化学性质
C. 证明分子在不断运动 D. 关闭活塞,检查装置气密性
二、填空题
13. 二氧化碳在空气中的体积分数约为0.03%,含量很少,但起的作用是巨大的,它可以参与植物的光合作用,但含量过高时又能造成温室效应。二氧化碳在常温下是一种无色、无味气体,密度大约是空气的1.5倍,可溶于水,并能与水反应生成碳酸(H2CO3)。可以使澄清石灰变白色浑浊。请根据以上信息回答下列问题:
(1)二氧化碳的物理性质有:________。
(2)二氧化碳的化学性质有:________。
(3)请写出二氧化碳与水反应的符号表达式:________。
14. 用如图装置验证二氧化碳的性质。打开K,一段时间后,观察到纸花变红且短蜡烛熄灭,关闭K,片刻后长蜡烛熄灭。
由该实验得出的结论 _____________,发生反应的化学方程式为 _____________。
15. 小致同学为探究二氧化碳的性质,设计了下列实验。回答问题:
(1)实验A应______(填“缓慢”或“快速”)倾倒气体;
(2)实验B,向装满的软塑料瓶中倾倒约体积的澄清石灰水,迅速盖好瓶塞,振荡,观察到的现象是______;
(3)实验C中湿润的石蕊小花变红,原因是______。
三、综合题
16. 二氧化碳是自然界中一种重要的资源。
一、二氧化碳的用途
(1)下图实验,观察到的现象是________,说明二氧化碳可用于________。
(2)自然界中,二氧化碳可通过________作用,产生氧气。
(3)将二氧化碳加压、降温制成固态二氧化碳,俗称______,可用于人工降雨、舞台云雾等。
二、二氧化碳的制取
(1)实验室可用下图装置A制CO2,a中加入的物质是_____。反应的符号表达式是______。
(2)装置B和C均可以收集CO2,若用B收集则气体应从_____端(选填“b”或“c”)通入。若用C装置收集,植物油的作用是_____。
三、二氧化碳的测定
测定石灰石(主要成分为碳酸钙,其他物质不与酸反应)与稀盐酸(实验中酸均足量)反应生成CO2的质量和体积,并处理数据。
【实验设计】通过下列两个实验分别测定CO2的质量和体积,并处理数据。
【分析与思考】
(1)实验1时,将小烧杯中稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中碳酸钙完全反应的操作及实验现象是:最后一次加入稀盐酸,________。
(2)实验2时,先连接装置,再_______(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。
【记录与处理】
(1)实验1中电子天平的精确度较高,已知:反应前的总质量【m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)】,要计算生成CO2的质量,至少还需要的数据是_______。(填字母)
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
(2)实验2的实验记录如下(表中数据在相同温度、相同压强条件下测定)
时间/min 1 2 3 4 5 6 7 8 9 10
注射器读数/ml 60.0 85.0 88.0 89.0 89.5 89.8 89.9 90.0 90.0 90.0
①综合分析,最终生成CO2的体积是________ml。
②在坐标图中用曲线绘制出0-10min生成CO2体积随时间变化的曲线._______
【反思与评价】请你综合各方面原因分析
(1)实验1操作简单,便于读数,但最终CO2质量的测量值比理论值偏大,可能的原因是_____。
(2)实验Ⅱ的优点是_______。
一、选择题
1. 空气中能参与光合作用的气体是
A.二氧化碳 B.氮气 C.稀有气体 D.氧气
2. 二氧化碳在生产、生活中具有多种用途。下列有关二氧化碳的用途不正确的是
A.灭火 B.气体肥料
C.光合作用 D.冰箱除味剂
3. 我国承诺力争在2030年前实现“碳达峰”,2060年前实现"碳中和”。这里的“碳”指的是
A.一氧化碳 B.碳单质 C.二氧化碳 D.碳元素
4. 下列有关空气成分的说法错误的是
A.利用氦气可制作霓虹灯 B.食品包装中充入氮气用来防腐
C.利用二氧化碳可以制作碳酸饮料 D.发射火箭时用氧气作燃料
5. 化学变化是人们改造和应用物质的重要途径,下列过程可通过化学变化实现的是
A.工业上分离液态空气制得液氧 B.O2分子转化成O3分子
C.干冰用于人工降雨 D.滑雪场以水为原料用造雪机人工造雪
6. 关于CO和CO2的说法正确的是
A.CO和CO2组成元素相同,故化学性质也相同
B.两者都可以通过木炭燃烧得到
C.CO能燃烧,故可用于冶炼金属
D.CO2易溶于水,故不能用排水法收集
7. 2022年6月5日是第50个世界环境日,中国主题是“共建清洁美丽世界”,旨在进一步深化“绿水青山就是金山银山”的发展理念。下列做法不符合这一主题的是
A.开发新能源,替代化石燃料,实现节能减排
B.限制燃放烟花爆竹,文明庆贺节日
C.大力提倡农作物秸秆就地焚烧,为土壤提供肥料
D.积极植树造林,严禁乱砍乱伐,促进达成“碳中和”目标
8. 下列是实验室制取二氧化碳并验证相关性质的操作,其中不正确的是
A.检查装置气密性 B.装入石灰石
C.收集 D.验证阻燃性
9. 碳元素是生命的根本元素,下列有关碳和碳的氧化物的说法中,正确的是
A.金刚石、石墨都是由碳原子构成的,所以都很坚硬
B.用活性炭可以除去水中的所有杂质
C.煤炉上放一壶水可以防止CO中毒
D.CO和CO2的组成元素相同,但是它们的化学性质不同
10. 如图为一氧化碳还原氧化铜的“微型”实验装置(夹持仪器略),其中甲酸(HCOOH)能够在热浓硫酸作用下反应生成水和一氧化碳。下列说法正确的是
A.甲可随时控制反应的发生和停止 B.挤压甲中胶头滴管的同时点燃酒精灯
C.乙中固体减少的质量等于丙中增加的质量 D.此装置内空间小,空气易排尽,实验危险系数小
11. 下列实验不能达到实验目的的是
A.验证CO2的密度比空气大
B.验证木炭具有吸附性
C.验证质量守恒定律
D.探究浓度对反应速率的影响
12. 下列四个实验中,不能达到实验目的的是
A. 证明能与水反应 B. 探究二氧化碳的化学性质
C. 证明分子在不断运动 D. 关闭活塞,检查装置气密性
二、填空题
13. 二氧化碳在空气中的体积分数约为0.03%,含量很少,但起的作用是巨大的,它可以参与植物的光合作用,但含量过高时又能造成温室效应。二氧化碳在常温下是一种无色、无味气体,密度大约是空气的1.5倍,可溶于水,并能与水反应生成碳酸(H2CO3)。可以使澄清石灰变白色浑浊。请根据以上信息回答下列问题:
(1)二氧化碳的物理性质有:________。
(2)二氧化碳的化学性质有:________。
(3)请写出二氧化碳与水反应的符号表达式:________。
14. 用如图装置验证二氧化碳的性质。打开K,一段时间后,观察到纸花变红且短蜡烛熄灭,关闭K,片刻后长蜡烛熄灭。
由该实验得出的结论 _____________,发生反应的化学方程式为 _____________。
15. 小致同学为探究二氧化碳的性质,设计了下列实验。回答问题:
(1)实验A应______(填“缓慢”或“快速”)倾倒气体;
(2)实验B,向装满的软塑料瓶中倾倒约体积的澄清石灰水,迅速盖好瓶塞,振荡,观察到的现象是______;
(3)实验C中湿润的石蕊小花变红,原因是______。
三、综合题
16. 二氧化碳是自然界中一种重要的资源。
一、二氧化碳的用途
(1)下图实验,观察到的现象是________,说明二氧化碳可用于________。
(2)自然界中,二氧化碳可通过________作用,产生氧气。
(3)将二氧化碳加压、降温制成固态二氧化碳,俗称______,可用于人工降雨、舞台云雾等。
二、二氧化碳的制取
(1)实验室可用下图装置A制CO2,a中加入的物质是_____。反应的符号表达式是______。
(2)装置B和C均可以收集CO2,若用B收集则气体应从_____端(选填“b”或“c”)通入。若用C装置收集,植物油的作用是_____。
三、二氧化碳的测定
测定石灰石(主要成分为碳酸钙,其他物质不与酸反应)与稀盐酸(实验中酸均足量)反应生成CO2的质量和体积,并处理数据。
【实验设计】通过下列两个实验分别测定CO2的质量和体积,并处理数据。
【分析与思考】
(1)实验1时,将小烧杯中稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中碳酸钙完全反应的操作及实验现象是:最后一次加入稀盐酸,________。
(2)实验2时,先连接装置,再_______(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。
【记录与处理】
(1)实验1中电子天平的精确度较高,已知:反应前的总质量【m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)】,要计算生成CO2的质量,至少还需要的数据是_______。(填字母)
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
(2)实验2的实验记录如下(表中数据在相同温度、相同压强条件下测定)
时间/min 1 2 3 4 5 6 7 8 9 10
注射器读数/ml 60.0 85.0 88.0 89.0 89.5 89.8 89.9 90.0 90.0 90.0
①综合分析,最终生成CO2的体积是________ml。
②在坐标图中用曲线绘制出0-10min生成CO2体积随时间变化的曲线._______
【反思与评价】请你综合各方面原因分析
(1)实验1操作简单,便于读数,但最终CO2质量的测量值比理论值偏大,可能的原因是_____。
(2)实验Ⅱ的优点是_______。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
