化学人教版(2019)选择性必修2 3.1物质的聚集状态与晶体的常识 课件(共40张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.1物质的聚集状态与晶体的常识 课件(共40张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 17:15:57 | ||
图片预览









文档简介
(共40张PPT)
第三章
第一节 物质的聚集状态和晶体的常识
本课件版权归四川嘉祥教育集团所有,未经授权,禁止传播
晶体是固体物质的常见聚集状态
书P68-69阅读并勾画
战
总结
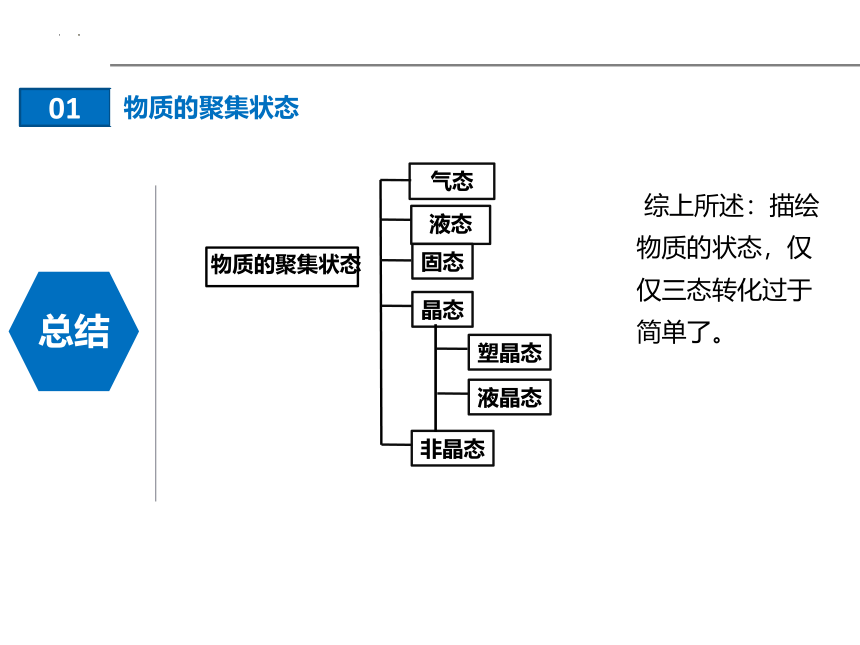
物质的聚集状态
气态
固态
液态
晶态
塑晶态
液晶态
非晶态
综上所述:描绘物质的状态,仅仅三态转化过于简单了。
01
物质的聚集状态
1、定义:
晶体:具有规则几何外形的固体
非晶体:没有规则几何外形的固体
二、晶体与非晶体
又称玻璃体,
比如:塑料、玻璃、松香、橡胶
晶体一定有规则的几何外形,但有规则几何外形的不一定是晶体。
晶体SiO2和非晶体SiO2的投影示意图
水晶
硅藻土
为什么晶体呈现规则的几何外形,而非晶体没有规则的几何外形呢?你认为可能和什么因素有关?
原子周期性有序排列
排列相对无序
内部微粒在空间按一定规律做周期性重复排列构成的固体物质称为晶体。
晶体SiO2和非晶体SiO2的投影示意图
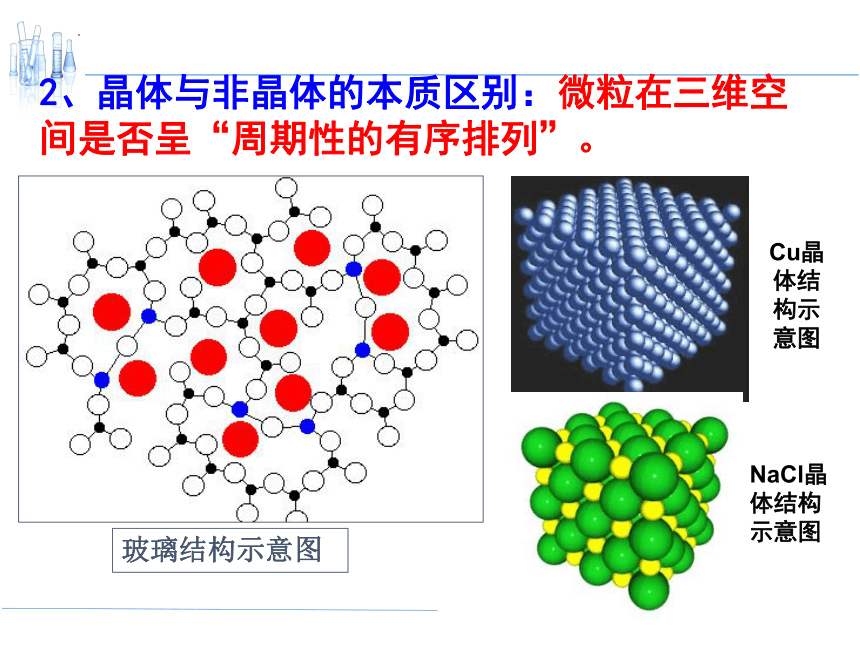
玻璃结构示意图
Cu晶体结构示意图
NaCl晶体结构示意图
2、晶体与非晶体的本质区别:微粒在三维空间是否呈“周期性的有序排列”。
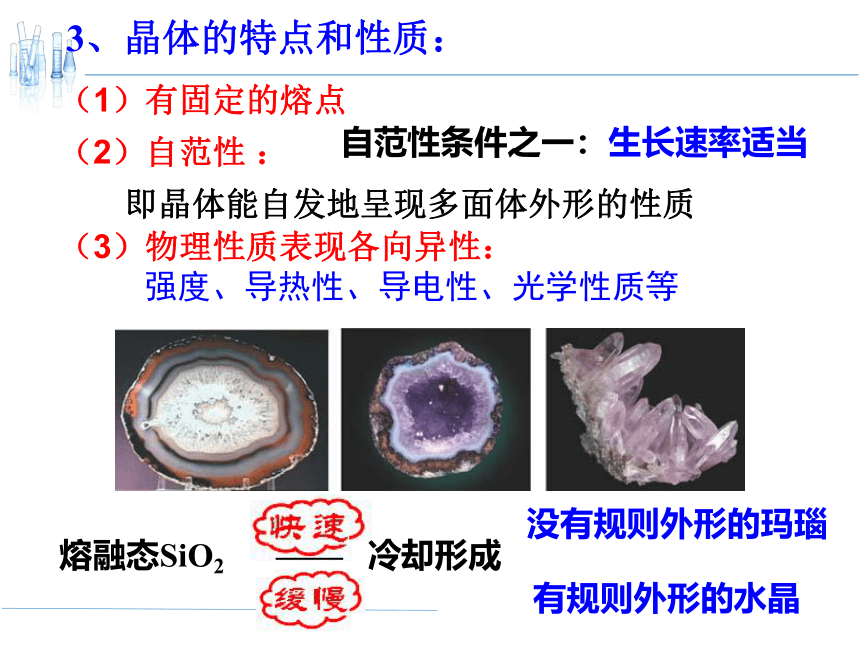
3、晶体的特点和性质:
(1)有固定的熔点
(2)自范性 :
即晶体能自发地呈现多面体外形的性质
(3)物理性质表现各向异性:
强度、导热性、导电性、光学性质等
熔融态SiO2
有规则外形的水晶
自范性条件之一:生长速率适当
—— 冷却形成
没有规则外形的玛瑙
探究实验
【实验1】 硫晶体的结晶
取少量硫粉置于蒸发皿中,加热至熔融态,停止加热,观察硫晶体的析出。
【实验2】 碘的凝华
在一小烧杯中加入少量碘,用一个表面皿盖在小烧杯上,并在表面皿上加少量冷水。把小烧杯放在石棉网上加热,观察实验现象。
【实验3】 硫酸铜晶体的析出
取硫酸铜粉末配制高温饱和溶液,冷却析晶。
4. 晶体形成的途径
(1)熔融态物质凝固
(2)气态物质冷却不经液态直接凝固(凝华)
(3)溶质从溶液中析出
许多固体粉末用肉眼看不到晶体外形,但在光学显微镜下可观察到规则的晶体外形。
玻璃的结构示意图
2.根据晶体的物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举一些可能有效的方法鉴别假宝石吗?
1.某同学在网站上找到一张玻璃的结构示意图,如右图,这张图说明玻璃是不是晶体?为什么?
非晶体
多面体外形;硬度;宝石的折光率;X-射线
(1)物理性质差异
如:熔点、外形、硬度、折光率
(2)区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验。
5.鉴别晶体和非晶体
④晶体不一定都有规则的几何外形。如玛瑙。
①同一物质可以是晶体,也可以是非晶体。如晶体SiO2和非晶体SiO2。
②有规则几何外形或者美观、对称外形的固体,不一定是晶体。如玻璃制品可以塑造出规则的几何外形,也可以具有美观对称的外观。
③具有固定组成的物质不一定是晶体。如某些无定形体也有固定组成。
⑤晶体的固体粉末同样是晶体。晶粒太小无法用肉眼观察。
注意
1、定义:描述晶体结构的基本单元
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻。
然而,蜂室是有形的,晶胞是无形的,是人为划定的。
三、晶胞
铜晶体
铜晶胞
NaCl晶体结构和晶胞
思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
CO2晶胞
平行六面体
无隙并置
晶胞一般是平行六面体,整块晶体可看作数量巨大的晶胞“无隙并置”而成
2、晶胞的特点
(1)无隙:相邻晶胞之间无任何缝隙。
(2)并置:所有晶胞都是平行排列的,取向相同。
三种典型立方晶体结构:
体心立方
简单立方
面心立方
3、晶胞中微粒个数的计算
思考:铜晶胞含有4个铜原子,为什么不是14个?
均摊法:
晶胞任意位置上的一个原子如果是被 x 个晶胞所共有,则每个晶胞对这个原子分得的份额就是 1/x
2
1
2
1
3
4
1
体心:1
面上:1/2
顶点:1/8
棱上:1/4
2
4
3
7
6
1
8
5
铜晶体
晶胞 顶角 棱上 面上 体心
立方体 1/8 1/4 1/2 1
顶点:8× 1/8 = 1
面上:6× 1/2= 3
总共:1+3=4
铜晶胞
铜晶体的一个晶胞中含有多少个铜原子
立方晶胞中质点的占有率
学与问:下图依次为Na、Zn晶胞的示意图,
数一数,它们平均分别含几个原子?
学与问:下图依次为I2、金刚石晶胞的示意图,数一数,它们平均分别含几个原子?
下列是NaCl晶胞示意图,晶胞中Na+和Cl 的个数比是多少?
晶体化学式确定:
晶胞内不同微粒个数的最简整数比
现有甲、乙、丙、丁四种晶体结构,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。
1∶1;C2D;EF;XY2Z
石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。
(2)碳原子数目与碳碳化学键数目之比为_____。
2 3 2:3
(1)简单立方:
在立方体顶点的微粒为8个晶胞共享
微粒数为:8×1/8 = 1
常见晶胞中微粒数的计算
简单立方晶胞
(2)体心立方:
在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。
微粒数为:8×1/8 + 1 = 2
常见晶胞中微粒数的计算
(3)面心立方:
在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。
微粒数为:8×1/8 + 6×1/2 = 4
(3)六方晶胞:
在六方体顶点的微粒为6个晶胞共有,在面心的为2个晶胞共有,在体内的微粒全属于该晶胞。
微粒数为:12×1/6 + 2×1/2 + 3 = 6
A. 90° B. 60°
C. 120° D. 109°28′
1、某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为:
2、如图是CsCl晶体的晶胞(晶体中最小的重复单元)已知晶体中2个最近的Cs+核间距离为a cm,氯化铯的相对分子质量为M,NA为阿佛加德罗常数,则CsCl晶体的密度(g/cm3)为( )
A、8M/a3NA
B、a3M/8NA
C、M/a3NA
D、a3M/NA
3、图是超导化合物一钙钛矿晶体中最小重复单元(晶胞)的结构。请回答:
(1)该化合物的化学式为_______.
CaTiO3
6
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有_____个.
(3)设该化合物的相对分子质量为M,密度为 a g/cm3 ,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为 _____.
X射线管
铅板
晶体
1、测定晶体结构仪器、方法及原理
最常用的仪器是X射线衍射仪
04
晶体结构的测定书P75-76
X射线衍射原理:单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
03
晶体结构的测定
衍射图
计算获得
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
原子在晶胞里的数目和位置
结合晶体化学组成的信息推出原子之间的相互关系
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
03
晶体结构的测定
乙酸晶胞
03
晶体结构的测定
第三章
第一节 物质的聚集状态和晶体的常识
本课件版权归四川嘉祥教育集团所有,未经授权,禁止传播
晶体是固体物质的常见聚集状态
书P68-69阅读并勾画
战
总结
物质的聚集状态
气态
固态
液态
晶态
塑晶态
液晶态
非晶态
综上所述:描绘物质的状态,仅仅三态转化过于简单了。
01
物质的聚集状态
1、定义:
晶体:具有规则几何外形的固体
非晶体:没有规则几何外形的固体
二、晶体与非晶体
又称玻璃体,
比如:塑料、玻璃、松香、橡胶
晶体一定有规则的几何外形,但有规则几何外形的不一定是晶体。
晶体SiO2和非晶体SiO2的投影示意图
水晶
硅藻土
为什么晶体呈现规则的几何外形,而非晶体没有规则的几何外形呢?你认为可能和什么因素有关?
原子周期性有序排列
排列相对无序
内部微粒在空间按一定规律做周期性重复排列构成的固体物质称为晶体。
晶体SiO2和非晶体SiO2的投影示意图
玻璃结构示意图
Cu晶体结构示意图
NaCl晶体结构示意图
2、晶体与非晶体的本质区别:微粒在三维空间是否呈“周期性的有序排列”。
3、晶体的特点和性质:
(1)有固定的熔点
(2)自范性 :
即晶体能自发地呈现多面体外形的性质
(3)物理性质表现各向异性:
强度、导热性、导电性、光学性质等
熔融态SiO2
有规则外形的水晶
自范性条件之一:生长速率适当
—— 冷却形成
没有规则外形的玛瑙
探究实验
【实验1】 硫晶体的结晶
取少量硫粉置于蒸发皿中,加热至熔融态,停止加热,观察硫晶体的析出。
【实验2】 碘的凝华
在一小烧杯中加入少量碘,用一个表面皿盖在小烧杯上,并在表面皿上加少量冷水。把小烧杯放在石棉网上加热,观察实验现象。
【实验3】 硫酸铜晶体的析出
取硫酸铜粉末配制高温饱和溶液,冷却析晶。
4. 晶体形成的途径
(1)熔融态物质凝固
(2)气态物质冷却不经液态直接凝固(凝华)
(3)溶质从溶液中析出
许多固体粉末用肉眼看不到晶体外形,但在光学显微镜下可观察到规则的晶体外形。
玻璃的结构示意图
2.根据晶体的物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举一些可能有效的方法鉴别假宝石吗?
1.某同学在网站上找到一张玻璃的结构示意图,如右图,这张图说明玻璃是不是晶体?为什么?
非晶体
多面体外形;硬度;宝石的折光率;X-射线
(1)物理性质差异
如:熔点、外形、硬度、折光率
(2)区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验。
5.鉴别晶体和非晶体
④晶体不一定都有规则的几何外形。如玛瑙。
①同一物质可以是晶体,也可以是非晶体。如晶体SiO2和非晶体SiO2。
②有规则几何外形或者美观、对称外形的固体,不一定是晶体。如玻璃制品可以塑造出规则的几何外形,也可以具有美观对称的外观。
③具有固定组成的物质不一定是晶体。如某些无定形体也有固定组成。
⑤晶体的固体粉末同样是晶体。晶粒太小无法用肉眼观察。
注意
1、定义:描述晶体结构的基本单元
蜂巢与蜂室
铜晶体
铜晶胞
晶体与晶胞的关系可用蜂巢与峰室的关系比喻。
然而,蜂室是有形的,晶胞是无形的,是人为划定的。
三、晶胞
铜晶体
铜晶胞
NaCl晶体结构和晶胞
思考与交流:
1.上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构形呈什么形状?
2.在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
CO2晶胞
平行六面体
无隙并置
晶胞一般是平行六面体,整块晶体可看作数量巨大的晶胞“无隙并置”而成
2、晶胞的特点
(1)无隙:相邻晶胞之间无任何缝隙。
(2)并置:所有晶胞都是平行排列的,取向相同。
三种典型立方晶体结构:
体心立方
简单立方
面心立方
3、晶胞中微粒个数的计算
思考:铜晶胞含有4个铜原子,为什么不是14个?
均摊法:
晶胞任意位置上的一个原子如果是被 x 个晶胞所共有,则每个晶胞对这个原子分得的份额就是 1/x
2
1
2
1
3
4
1
体心:1
面上:1/2
顶点:1/8
棱上:1/4
2
4
3
7
6
1
8
5
铜晶体
晶胞 顶角 棱上 面上 体心
立方体 1/8 1/4 1/2 1
顶点:8× 1/8 = 1
面上:6× 1/2= 3
总共:1+3=4
铜晶胞
铜晶体的一个晶胞中含有多少个铜原子
立方晶胞中质点的占有率
学与问:下图依次为Na、Zn晶胞的示意图,
数一数,它们平均分别含几个原子?
学与问:下图依次为I2、金刚石晶胞的示意图,数一数,它们平均分别含几个原子?
下列是NaCl晶胞示意图,晶胞中Na+和Cl 的个数比是多少?
晶体化学式确定:
晶胞内不同微粒个数的最简整数比
现有甲、乙、丙、丁四种晶体结构,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。
1∶1;C2D;EF;XY2Z
石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。
(2)碳原子数目与碳碳化学键数目之比为_____。
2 3 2:3
(1)简单立方:
在立方体顶点的微粒为8个晶胞共享
微粒数为:8×1/8 = 1
常见晶胞中微粒数的计算
简单立方晶胞
(2)体心立方:
在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。
微粒数为:8×1/8 + 1 = 2
常见晶胞中微粒数的计算
(3)面心立方:
在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。
微粒数为:8×1/8 + 6×1/2 = 4
(3)六方晶胞:
在六方体顶点的微粒为6个晶胞共有,在面心的为2个晶胞共有,在体内的微粒全属于该晶胞。
微粒数为:12×1/6 + 2×1/2 + 3 = 6
A. 90° B. 60°
C. 120° D. 109°28′
1、某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为:
2、如图是CsCl晶体的晶胞(晶体中最小的重复单元)已知晶体中2个最近的Cs+核间距离为a cm,氯化铯的相对分子质量为M,NA为阿佛加德罗常数,则CsCl晶体的密度(g/cm3)为( )
A、8M/a3NA
B、a3M/8NA
C、M/a3NA
D、a3M/NA
3、图是超导化合物一钙钛矿晶体中最小重复单元(晶胞)的结构。请回答:
(1)该化合物的化学式为_______.
CaTiO3
6
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有_____个.
(3)设该化合物的相对分子质量为M,密度为 a g/cm3 ,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为 _____.
X射线管
铅板
晶体
1、测定晶体结构仪器、方法及原理
最常用的仪器是X射线衍射仪
04
晶体结构的测定书P75-76
X射线衍射原理:单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
03
晶体结构的测定
衍射图
计算获得
晶胞形状和大小
分子或原子在微观空间有序排列呈现的对称类型
原子在晶胞里的数目和位置
结合晶体化学组成的信息推出原子之间的相互关系
根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
03
晶体结构的测定
乙酸晶胞
03
晶体结构的测定
