化学人教版(2019)选择性必修2 2.3分子的结构与物质的性质 课件(共45张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3分子的结构与物质的性质 课件(共45张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 17:16:28 | ||
图片预览







文档简介
(共45张PPT)
第二章
第三节 分子的性质
本课件版权归四川嘉祥教育集团所有,未经授权,禁止传播
1、什么是电负性?有何意义?
描述不同元素原子对键合电子吸引能力大小的物理量
复习回顾
2、什么是共价键?
原子间通过共用电子对而形成的化学键
3 、写出 H2 Cl2 N2 HCl H2O的结构式,并分析共用电子对是否发生偏移。
一、键的极性和分子的极性
1、键的极性
A—A
A—B
(1)非极性键:
(2)极性键:
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
书P52
分子的极性呢?
H
Cl
共用电子对
HCl分子中,共用电子对偏向Cl原子
Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀
HCl为极性分子
δ+
δ-
2、分子的极性
正电中心和负电中心不重合的分子
极性分子:
正电中心和负电中心重合的分子
非极性分子:
(1)概念
分子的极性
分子的空间结构
键角
决定
键的极性
决定
方法一:根据正电中心和负电中心是否重合
正电中心和负电中心不重合
极性分子
正电中心和负电中心不重合
正电中心和负电中心不重合
极性分子
非极性分子
02
分子的极性
分子的极性判断方法
方法二:根据分子的极性向量和是否为0
极性向量和为0
非极性分子
极性向量和为0
非极性分子
δ+
δ-
δ-
极性向量和不为0
极性分子
分子的极性判断方法
书P54思考与讨论
总结1:
1、单原子分子:非极性分子
2、双原子分子:
(1)同种原子:非极性分子
(2)不同种原子:极性分子
3、三原子分子:
(1)直线形:
①周围原子都相同:非极性分子
②周围原子不同:极性分子
(2)V形:极性分子
4、四原子分子:
(1)平面三角形:
①周围原子都相同:非极性分子
②周围原子不都相同:极性分子
(2)三角锥形:极性分子
5、五、六、七原子分子:
四面体形,三角双锥形、八面体形
①周围原子都相同:非极性分子
②周围原子不都相同:极性分子
总结2:
1、全是非极性键的分子是非极性分子。
2、全是极性键的分子可能是极性分子,也可能是非极性分子。
3、极性分子中一定有极性键,可能有非极性键。
4、非极性分子中:
(1)可能都是极性键
(2)可能都是非极性键
(3)可能既有极性键,又有非极性键
资料卡片
试分析O3、H2O2是极性分子还是非极性分子?
臭氧分子的空间结构与水相似,其分子有极性,但很弱。
臭氧分子中共价键是极性键,中心氧原子呈正电性,端位氧原子呈负电性
由于臭氧的极性很弱,在四氯化碳中的溶解度高于在水中的溶解度。
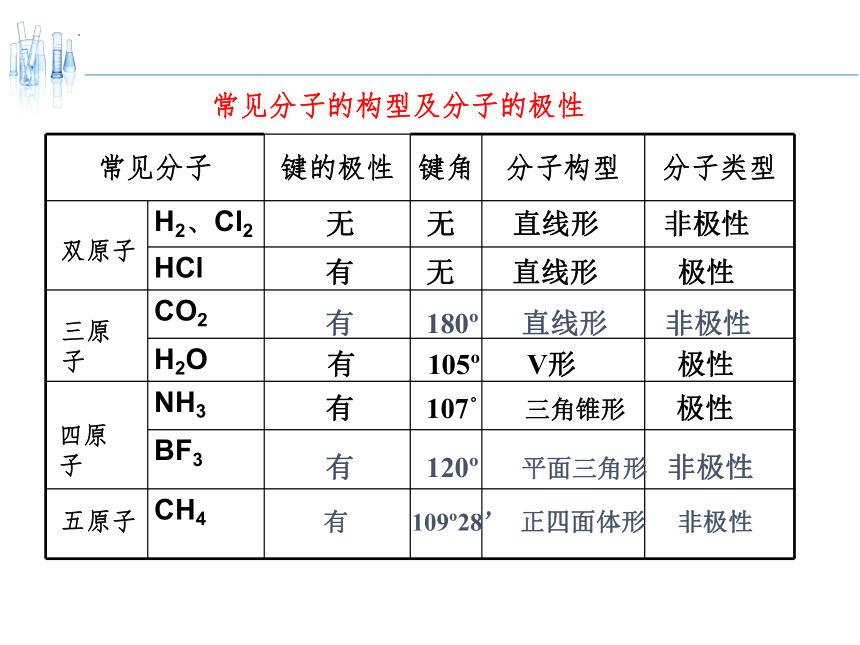
常见分子 键的极性 键角 分子构型 分子类型
H2、Cl2
HCl
CO2
H2O
NH3
BF3
CH4
常见分子的构型及分子的极性
双原子
无 无 直线形 非极性
有 无 直线形 极性
有 105 V形 极性
有 180 直线形 非极性
三原子
四原子
有 107° 三角锥形 极性
有 120 平面三角形 非极性
有 109 28’ 正四面体形 非极性
五原子
键的极性对化学性质的影响
羧酸是一大类含羧基(--COOH)的有机酸,羧基可以电离出H+而显酸性;羧酸的酸性可用 pKa 来衡量,pKa越小,酸性越强。
pKa= - lgKa
O
一 C 一 O 一 H
CH3
一 C 一 O
O
CH3
+ H +
1、对有机酸酸性的影响
书P53-55
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1、比较丙酸、乙酸、甲酸的酸性强弱,你能分析原因吗?
甲酸>乙酸>丙酸
CH3
O
H
O
C
C2H5
O
H
O
C
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1、比较丙酸、乙酸、甲酸的酸性强弱,你能分析原因吗?
烃基是推电子基团,烃基越长,推电子效应越大(即将电子推向羟基),使羧基中的羟基极性减弱,更难电离出H+,酸性越弱
甲酸>乙酸>丙酸
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2、比较氯乙酸、二氯乙酸、三氯乙酸的酸性强弱,你能分析原因吗?
三氯乙酸>二氯乙酸>氯乙酸
O
CH2
O
H
C
δ-
δ+
Cl
O
CH
O
H
C
δ-
δ+
Cl
Cl
O
C
O
H
C
δ-
δ+
Cl
Cl
Cl
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2、比较氯乙酸、二氯乙酸、三氯乙酸的酸性强弱,你能分析原因吗?
Cl的电负性大于H(吸引电子能力强),Cl原子越多,-CX3的极性越大,使羧基中的羟基极性越大,越容易电离出H+
三氯乙酸>二氯乙酸>氯乙酸
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
3、比较氯乙酸、二氯乙酸、三氯乙酸的酸性强弱,你能分析原因吗?
F的电负性大于Cl ,-CF3的极性大于-CCl3,使羧基中的羟基极性更大,更容易电离出H+
三氟乙酸>三氯乙酸
无机含氧酸酸性强弱判断
我们常把H2SO4、HNO3等无机含氧酸看成由H+和酸根离子组成的,实际上在她们的分子结构中,H+却是和酸根中的一个氧原子相连接的,如
不难看出无机含氧酸的酸性也是取决于羟基的极性,电离出H+的能力
思考讨论
1、酸性强弱:HClO4>HClO3>HClO2>HClO
H2SO4>H2SO3 HNO3>HNO2
你能发现什么规律吗?如何解释这种规律呢?
规律:对于含同一种元素的含氧酸来说,中心原子的化合价越高,其含氧酸的酸性越强
原因:含氧酸的通式可以写成(HO)mROn,如果R相同,则n越大,R的正电性越高,导致R-O-H中O的电子向R偏移,羟基的极性越大,越容易电离出H+
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强。如:HF②同一周期元素的非金属氢化物的酸性从左向右逐渐增强。如:H2S常见酸的酸性强弱比较
③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱。
如:HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强。如:H3PO4根据化学反应判断:强酸制弱酸
有一种神奇的力,让壁虎可以飞檐走壁
1、定义:分子之间存在的相互作用力称为范德华力
2、与化学键的区别:
(1) 范德华力的大小比化学键的键能小得多,不是化学键
(2)范德华力存在于分子之间,气体分子间几乎无。而化学键存在于原子之间
(4)范德华力主要影响物质的物理性质,而化学键主要影响物质的化学性质
二、范德华力及其对物质性质的影响
(3)范德华力没有方向性和饱和性
3、影响范德华力大小的因素:
相对分子质量:
组成与结构相似时,相对分子质量越大,范德华力越大
分子的极性:
分子的极性越大,范德华力越大。
4、范德华力对物质性质的影响
分子间的范德华力越大,该物质的熔沸点越高。
书P56+科学视野
你是否知道:
常见的物质中,水是熔、沸点较高的液体之一?
冰的密度比液态的水小?
1、氢键的概念及表示方法
(1)概念
氢键是由已经与电负性很大的原子形成共价键的_______与另一个电负性很大的原子之间的作用力,是一种静电作用力。
(2)表示方法
氢键的通式可用A—H…B—表示。式中A和B表示_________,“—”表示_______,“…”表示_____。
氢原子
F、O、N
共价键
氢键
三、氢键及其对物质性质的影响
2、氢键的形成条件
(1)要有一个与电负性很大的元素A形成强极性键的氢原子,如H2O中的氢原子。
(2)要有一个电负性很大,含有_________并带有部分电荷的原子B,如H2O中的氧原子。
(3)A和B的_________要小,这样空间位阻较小。
一般来说,能形成氢键的元素有N、O、F。所以氢键一般存在于含N—H、H—O、H—F键的物质中,或有机化合物中的醇类和羧酸类等物质中。
孤电子对
原子半径
【思考】是不是只要有N、O、F和H,就可以形成氢键呢?
CH3CH2OH 和 CH3OCH3分子间都可以形成氢键吗?
3、氢键的特征
(1)氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。
(2)氢键的大小,介于化学键与范德华力之间,不属于化学键,但也有键长、键能。
F—H···F
O—H ··· O
N—H ··· N
氢键键能
(kJ/mol)
28.1
18.8
5.4
共价键键能
(kJ/mol)
568
462.8
390.8
4、氢键的类型
(1)分子间氢键
如:HF、H2O、NH3 分子相互之间
C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键
(不属于分子间作用力)
当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构
书P57
5、氢键对物质性质的影响
(1)对熔点和沸点的影响
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时使溶质溶解度减小。
(3)氢键与水分子的性质
①水的沸点反常地 。
②水结冰时,体积膨胀,密度_____。
③接近沸点时形成“缔合分子”,水蒸气的相对分子质量的测定值比用化学式H2O计算出来的相对分子质量_____。
分子间氢键使物质熔、沸点升高。
分子内氢键使物质熔、沸点降低。
减小
偏大
高
注:分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
典例:比较下列各组物质的沸点:
① HF HCl
② H2O H2S
邻羟基苯甲醛 对羟基苯甲醛
甲烷 硅烷
>
>
<
<
四、物质溶解性
(1)内因:相似相溶原理
极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
相似相溶原理还适用于分子结构的相似性。
(2)外因:温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,
如:SO2。
书P59-思考与讨论
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
青蒿素
青蒿素
为什么需要用乙醚来提取青蒿素,用水不可以呢?
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,
在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
CH3CH2—O—CH2CH3
乙醚
青蒿素
思考讨论
青蒿素
观察一下两组图片,有何特征?
一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。中心原子称为手性原子。
五、手性
1、手性异构体
具有完全相同的 和 的一对分子,如同左手和右手一样互为镜像,在三维空间无论如何旋转都不能重叠。
组成
原子排列
有手性异构体的分子
2、手性分子:
书P60-61
最常见的手性分子是含手性碳原子的分子
3、手性碳原子
连有四个不同的原子或原子团的碳原子
用﹡C表示
也有一些手性物质没有手性碳原子
乳酸分子CH3CH(OH)COOH
有以下两种异构体:
具有手性碳原子的有机物具有光学活性.
(1)下列分子中,没有光学活性的是______,含有两个手性碳原子的是________.
A.乳酸 —CHOH—COOH
B.甘油 —CHOH—
C.脱氧核糖 —CHOH—CHOH—CHO
D.核糖 —CHOH—CHOH—CHOH—CHO
B
C
右旋与左旋
4、自然界中的手性
珍贵的法螺左旋贝。百万分之一,十分罕见。
【2019年全国I卷】上图的有机物分子中有 个手性碳原子。
【2020天津卷14题】上图分子中含有 个手性碳原子。
1
2
【2022年全国甲卷节选】下图的有机物分子中有 个手性碳原子。
第二章
第三节 分子的性质
本课件版权归四川嘉祥教育集团所有,未经授权,禁止传播
1、什么是电负性?有何意义?
描述不同元素原子对键合电子吸引能力大小的物理量
复习回顾
2、什么是共价键?
原子间通过共用电子对而形成的化学键
3 、写出 H2 Cl2 N2 HCl H2O的结构式,并分析共用电子对是否发生偏移。
一、键的极性和分子的极性
1、键的极性
A—A
A—B
(1)非极性键:
(2)极性键:
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
书P52
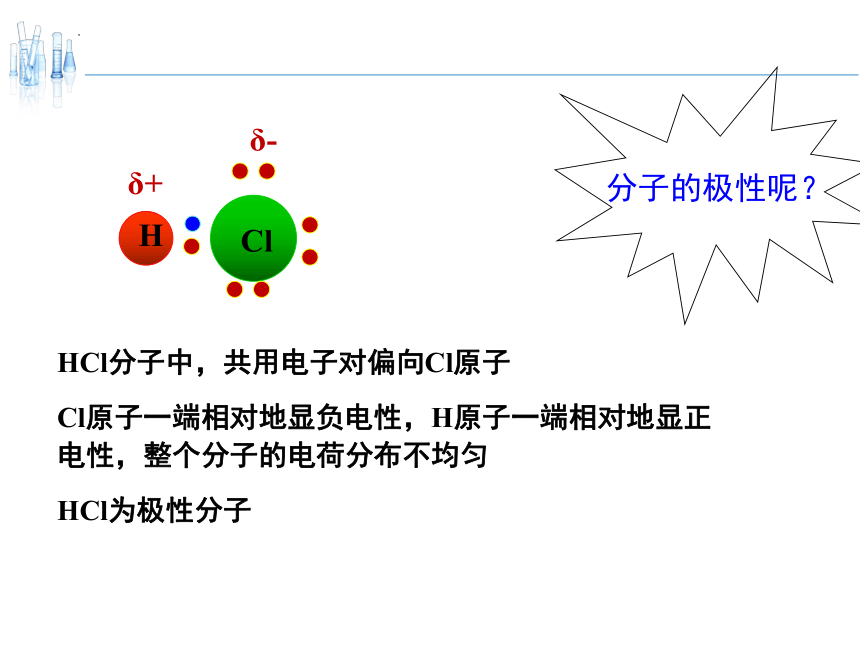
分子的极性呢?
H
Cl
共用电子对
HCl分子中,共用电子对偏向Cl原子
Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀
HCl为极性分子
δ+
δ-
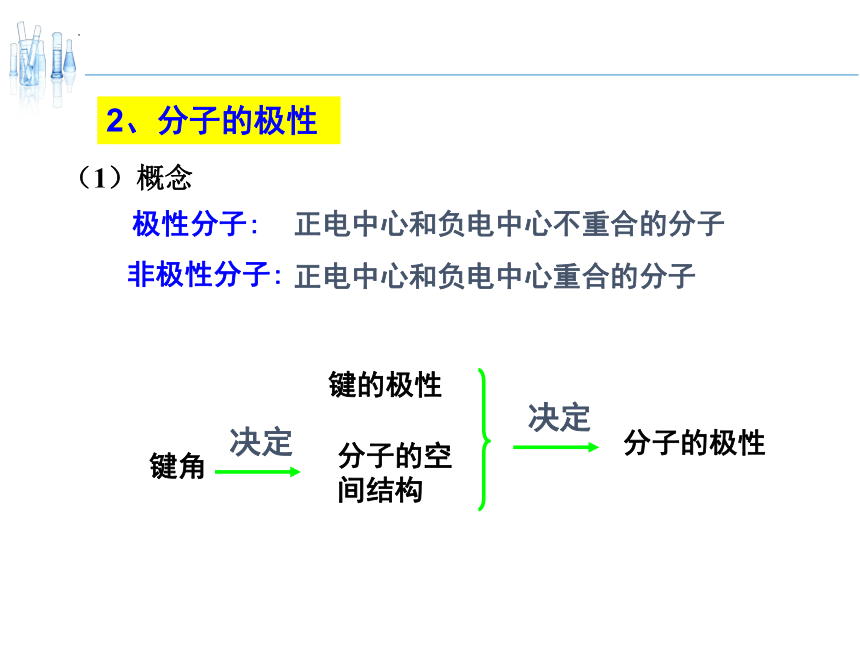
2、分子的极性
正电中心和负电中心不重合的分子
极性分子:
正电中心和负电中心重合的分子
非极性分子:
(1)概念
分子的极性
分子的空间结构
键角
决定
键的极性
决定
方法一:根据正电中心和负电中心是否重合
正电中心和负电中心不重合
极性分子
正电中心和负电中心不重合
正电中心和负电中心不重合
极性分子
非极性分子
02
分子的极性
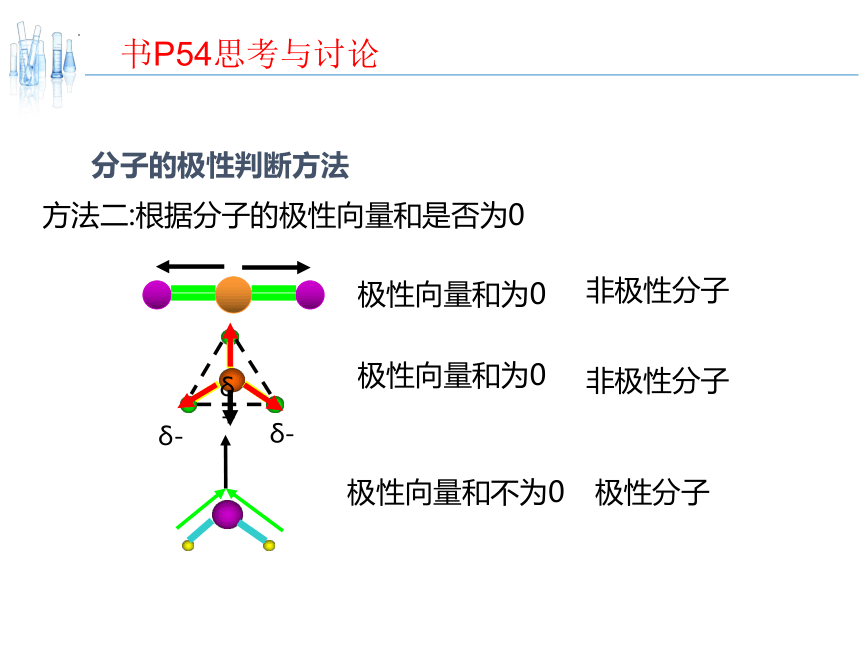
分子的极性判断方法
方法二:根据分子的极性向量和是否为0
极性向量和为0
非极性分子
极性向量和为0
非极性分子
δ+
δ-
δ-
极性向量和不为0
极性分子
分子的极性判断方法
书P54思考与讨论
总结1:
1、单原子分子:非极性分子
2、双原子分子:
(1)同种原子:非极性分子
(2)不同种原子:极性分子
3、三原子分子:
(1)直线形:
①周围原子都相同:非极性分子
②周围原子不同:极性分子
(2)V形:极性分子
4、四原子分子:
(1)平面三角形:
①周围原子都相同:非极性分子
②周围原子不都相同:极性分子
(2)三角锥形:极性分子
5、五、六、七原子分子:
四面体形,三角双锥形、八面体形
①周围原子都相同:非极性分子
②周围原子不都相同:极性分子
总结2:
1、全是非极性键的分子是非极性分子。
2、全是极性键的分子可能是极性分子,也可能是非极性分子。
3、极性分子中一定有极性键,可能有非极性键。
4、非极性分子中:
(1)可能都是极性键
(2)可能都是非极性键
(3)可能既有极性键,又有非极性键
资料卡片
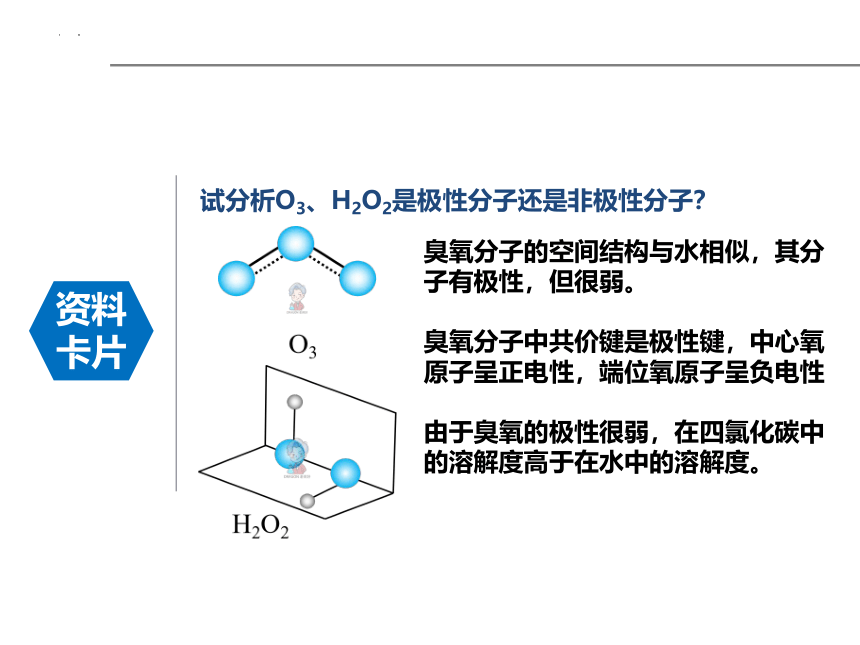
试分析O3、H2O2是极性分子还是非极性分子?
臭氧分子的空间结构与水相似,其分子有极性,但很弱。
臭氧分子中共价键是极性键,中心氧原子呈正电性,端位氧原子呈负电性
由于臭氧的极性很弱,在四氯化碳中的溶解度高于在水中的溶解度。
常见分子 键的极性 键角 分子构型 分子类型
H2、Cl2
HCl
CO2
H2O
NH3
BF3
CH4
常见分子的构型及分子的极性
双原子
无 无 直线形 非极性
有 无 直线形 极性
有 105 V形 极性
有 180 直线形 非极性
三原子
四原子
有 107° 三角锥形 极性
有 120 平面三角形 非极性
有 109 28’ 正四面体形 非极性
五原子
键的极性对化学性质的影响
羧酸是一大类含羧基(--COOH)的有机酸,羧基可以电离出H+而显酸性;羧酸的酸性可用 pKa 来衡量,pKa越小,酸性越强。
pKa= - lgKa
O
一 C 一 O 一 H
CH3
一 C 一 O
O
CH3
+ H +
1、对有机酸酸性的影响
书P53-55
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1、比较丙酸、乙酸、甲酸的酸性强弱,你能分析原因吗?
甲酸>乙酸>丙酸
CH3
O
H
O
C
C2H5
O
H
O
C
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1、比较丙酸、乙酸、甲酸的酸性强弱,你能分析原因吗?
烃基是推电子基团,烃基越长,推电子效应越大(即将电子推向羟基),使羧基中的羟基极性减弱,更难电离出H+,酸性越弱
甲酸>乙酸>丙酸
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2、比较氯乙酸、二氯乙酸、三氯乙酸的酸性强弱,你能分析原因吗?
三氯乙酸>二氯乙酸>氯乙酸
O
CH2
O
H
C
δ-
δ+
Cl
O
CH
O
H
C
δ-
δ+
Cl
Cl
O
C
O
H
C
δ-
δ+
Cl
Cl
Cl
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2、比较氯乙酸、二氯乙酸、三氯乙酸的酸性强弱,你能分析原因吗?
Cl的电负性大于H(吸引电子能力强),Cl原子越多,-CX3的极性越大,使羧基中的羟基极性越大,越容易电离出H+
三氯乙酸>二氯乙酸>氯乙酸
思考讨论
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
3、比较氯乙酸、二氯乙酸、三氯乙酸的酸性强弱,你能分析原因吗?
F的电负性大于Cl ,-CF3的极性大于-CCl3,使羧基中的羟基极性更大,更容易电离出H+
三氟乙酸>三氯乙酸
无机含氧酸酸性强弱判断
我们常把H2SO4、HNO3等无机含氧酸看成由H+和酸根离子组成的,实际上在她们的分子结构中,H+却是和酸根中的一个氧原子相连接的,如
不难看出无机含氧酸的酸性也是取决于羟基的极性,电离出H+的能力
思考讨论
1、酸性强弱:HClO4>HClO3>HClO2>HClO
H2SO4>H2SO3 HNO3>HNO2
你能发现什么规律吗?如何解释这种规律呢?
规律:对于含同一种元素的含氧酸来说,中心原子的化合价越高,其含氧酸的酸性越强
原因:含氧酸的通式可以写成(HO)mROn,如果R相同,则n越大,R的正电性越高,导致R-O-H中O的电子向R偏移,羟基的极性越大,越容易电离出H+
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强。如:HF
③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱。
如:HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强。如:H3PO4
有一种神奇的力,让壁虎可以飞檐走壁
1、定义:分子之间存在的相互作用力称为范德华力
2、与化学键的区别:
(1) 范德华力的大小比化学键的键能小得多,不是化学键
(2)范德华力存在于分子之间,气体分子间几乎无。而化学键存在于原子之间
(4)范德华力主要影响物质的物理性质,而化学键主要影响物质的化学性质
二、范德华力及其对物质性质的影响
(3)范德华力没有方向性和饱和性
3、影响范德华力大小的因素:
相对分子质量:
组成与结构相似时,相对分子质量越大,范德华力越大
分子的极性:
分子的极性越大,范德华力越大。
4、范德华力对物质性质的影响
分子间的范德华力越大,该物质的熔沸点越高。
书P56+科学视野
你是否知道:
常见的物质中,水是熔、沸点较高的液体之一?
冰的密度比液态的水小?
1、氢键的概念及表示方法
(1)概念
氢键是由已经与电负性很大的原子形成共价键的_______与另一个电负性很大的原子之间的作用力,是一种静电作用力。
(2)表示方法
氢键的通式可用A—H…B—表示。式中A和B表示_________,“—”表示_______,“…”表示_____。
氢原子
F、O、N
共价键
氢键
三、氢键及其对物质性质的影响
2、氢键的形成条件
(1)要有一个与电负性很大的元素A形成强极性键的氢原子,如H2O中的氢原子。
(2)要有一个电负性很大,含有_________并带有部分电荷的原子B,如H2O中的氧原子。
(3)A和B的_________要小,这样空间位阻较小。
一般来说,能形成氢键的元素有N、O、F。所以氢键一般存在于含N—H、H—O、H—F键的物质中,或有机化合物中的醇类和羧酸类等物质中。
孤电子对
原子半径
【思考】是不是只要有N、O、F和H,就可以形成氢键呢?
CH3CH2OH 和 CH3OCH3分子间都可以形成氢键吗?
3、氢键的特征
(1)氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。
(2)氢键的大小,介于化学键与范德华力之间,不属于化学键,但也有键长、键能。
F—H···F
O—H ··· O
N—H ··· N
氢键键能
(kJ/mol)
28.1
18.8
5.4
共价键键能
(kJ/mol)
568
462.8
390.8
4、氢键的类型
(1)分子间氢键
如:HF、H2O、NH3 分子相互之间
C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键
(不属于分子间作用力)
当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构
书P57
5、氢键对物质性质的影响
(1)对熔点和沸点的影响
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子内氢键时使溶质溶解度减小。
(3)氢键与水分子的性质
①水的沸点反常地 。
②水结冰时,体积膨胀,密度_____。
③接近沸点时形成“缔合分子”,水蒸气的相对分子质量的测定值比用化学式H2O计算出来的相对分子质量_____。
分子间氢键使物质熔、沸点升高。
分子内氢键使物质熔、沸点降低。
减小
偏大
高
注:分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
典例:比较下列各组物质的沸点:
① HF HCl
② H2O H2S
邻羟基苯甲醛 对羟基苯甲醛
甲烷 硅烷
>
>
<
<
四、物质溶解性
(1)内因:相似相溶原理
极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
相似相溶原理还适用于分子结构的相似性。
(2)外因:温度和压强。
(3)其他因素:
A)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键越强,溶解性越好。如:NH3。
B)溶质与水发生反应时可增大其溶解度,
如:SO2。
书P59-思考与讨论
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
青蒿素
青蒿素
为什么需要用乙醚来提取青蒿素,用水不可以呢?
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,
在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
CH3CH2—O—CH2CH3
乙醚
青蒿素
思考讨论
青蒿素
观察一下两组图片,有何特征?
一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。中心原子称为手性原子。
五、手性
1、手性异构体
具有完全相同的 和 的一对分子,如同左手和右手一样互为镜像,在三维空间无论如何旋转都不能重叠。
组成
原子排列
有手性异构体的分子
2、手性分子:
书P60-61
最常见的手性分子是含手性碳原子的分子
3、手性碳原子
连有四个不同的原子或原子团的碳原子
用﹡C表示
也有一些手性物质没有手性碳原子
乳酸分子CH3CH(OH)COOH
有以下两种异构体:
具有手性碳原子的有机物具有光学活性.
(1)下列分子中,没有光学活性的是______,含有两个手性碳原子的是________.
A.乳酸 —CHOH—COOH
B.甘油 —CHOH—
C.脱氧核糖 —CHOH—CHOH—CHO
D.核糖 —CHOH—CHOH—CHOH—CHO
B
C
右旋与左旋
4、自然界中的手性
珍贵的法螺左旋贝。百万分之一,十分罕见。
【2019年全国I卷】上图的有机物分子中有 个手性碳原子。
【2020天津卷14题】上图分子中含有 个手性碳原子。
1
2
【2022年全国甲卷节选】下图的有机物分子中有 个手性碳原子。
