1.1.1 物质的分类 课件(共27张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册+
文档属性
| 名称 | 1.1.1 物质的分类 课件(共27张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册+ |  | |
| 格式 | pptx | ||
| 文件大小 | 43.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 21:18:27 | ||
图片预览




文档简介
(共27张PPT)
高中化学同步课程
化学必修第一册
第一章 物质及其变化
第一节 物质的分类及转化
第1课时 简单分类法及其应用、物质的转化
机器人对快递件的高速分拣
科学分类的前提是建立科学准确的分类标准 。
科学的分类能够反映事物的本质特征,有利于深入研究,那么怎样才能保证分类的科学性?
分类是提高效率的一种重要手段
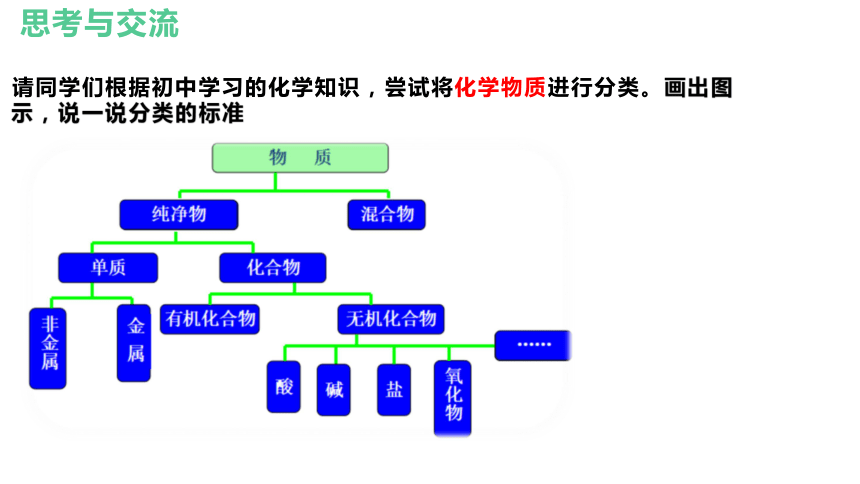
一、根据物质的组成和性质分类
任何物质都是由元素组成的,根据元素组成对物质进行分类是化学研究的基础。
只有一种元素组成的纯净物叫单质;
由两种或两种以上种类元素组成的纯净物是化合物。
(一)、元素与物质分类的关系
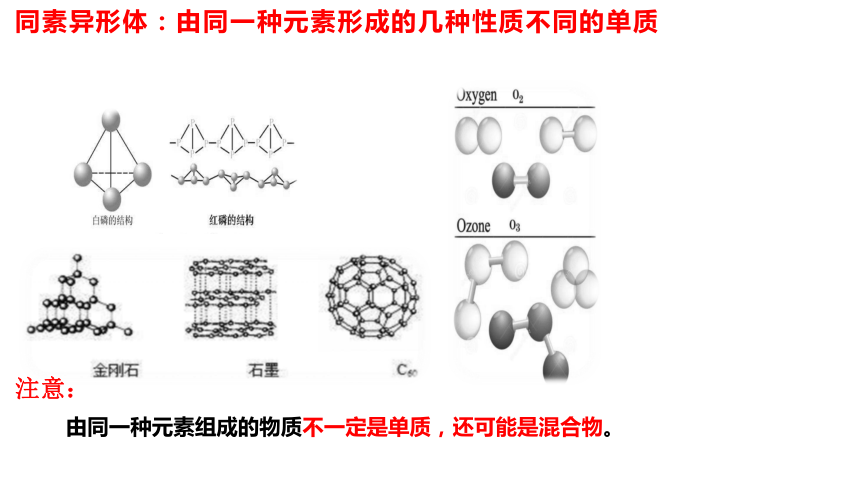
同素异形体:由同一种元素形成的几种性质不同的单质
注意:
由同一种元素组成的物质不一定是单质,还可能是混合物。
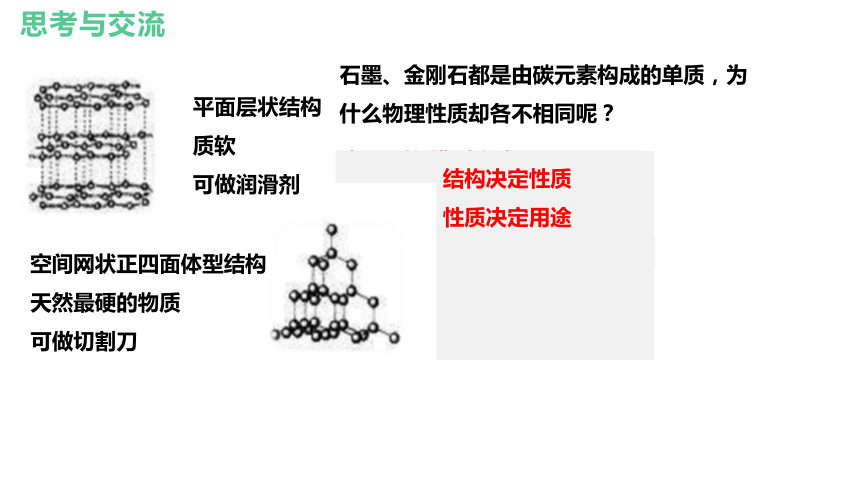
石墨、金刚石都是由碳元素构成的单质,为什么物理性质却各不相同呢?
碳原子的 排列方式不 同
结 构 不同
性 质 不 同
平面层状结构
质软
可做润滑剂
空间网状正四面体型结构
天然最硬的物质
可做切割刀
用 途 不 同
结构决定性质
性质决定用途
思考与交流
请同学们根据初中学习的化学知识,尝试将化学物质进行分类。画出图示,说一说分类的标准
思考与交流
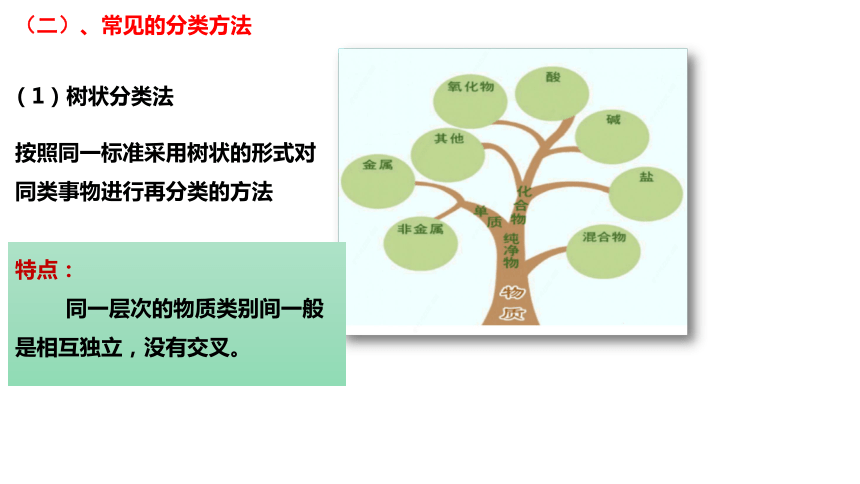
特点:
同一层次的物质类别间一般是相互独立,没有交叉。
(1)树状分类法
(二)、常见的分类方法
按照同一标准采用树状的形式对
同类事物进行再分类的方法
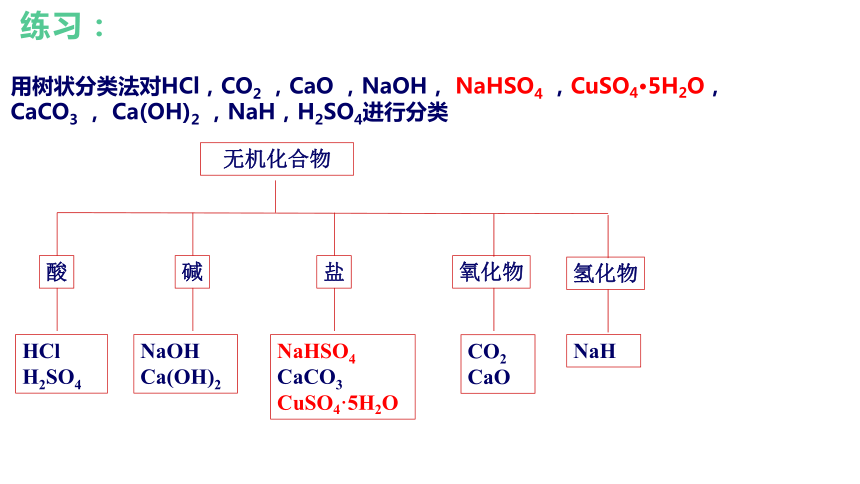
用树状分类法对HCl,CO2 ,CaO ,NaOH, NaHSO4 ,CuSO4·5H2O, CaCO3 , Ca(OH)2 ,NaH,H2SO4进行分类
无机化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
NaHSO4 CaCO3
CuSO4·5H2O
CO2 CaO
氢化物
NaH
练习:
1、 酸的分类
酸:电离时生成的阳离子全部为氢离子的化合物。如H2SO4
按是否含氧分为含氧酸和无氧酸
HNO3 HCl
按有无挥发性分为挥发性酸和难挥发性酸
HNO3 HCl H2SO4
按最多电离H+个数分为一元酸 、二元酸和多元酸
HCl H2CO3 H3PO4
按在水溶液中是否完全电离分为强酸和弱酸
六大强酸:HNO3 、HCl 、H2SO4 、HBr、HI、HClO4
已知H3PO3(亚磷酸)与足量的NaOH完全反应最终生成Na2HPO3,反应方程式为 H3PO3+2NaOH==Na2HPO3+2H2O
请试着分析H3PO3(亚磷酸)属于几元酸?
提示: HCl+NaOH==NaCl+H2O
答案:H3PO3(亚磷酸)是二元酸
思考与交流
酸的通性 反应条件 反应类型
指示剂 使紫色石蕊试液变红色,无色酚酞试液不变色
活泼金属 置换反应
碱性氧化物 复分解反应
碱 复分解反应
某些盐 复分解反应
酸+活泼金属 →盐+氢气
酸+碱性氧化物→盐+水
酸+碱→盐+水
酸+盐→新酸+新盐
酸的通性
2、碱的分类
碱:电离时生成的阴离子全部为氢氧根的化合物。如NaOH
按最多电离OH-个数分为一元碱 、二元碱和多元碱
NaOH Ca(OH)2 Fe(OH)3
按在水溶液中是否完全电离分为强碱和弱碱
四大强碱: NaOH、KOH、Ba(OH)2 、Ca(OH)2
按溶解性
可溶性碱:NaOH、KOH、Ba(OH)2等
难溶性碱:Cu(OH)2 、 Fe(OH)3等
碱的通性 反应特征 反应类型
指示剂 使紫色石蕊试液变蓝色,无色酚酞试液变红色
酸
酸性氧化物
某些盐
酸+碱→盐+水
碱+酸性氧化物→盐+水
复分解反应
复分解反应
碱的通性
碱+盐→新碱+新盐
3、盐的分类
盐:电离时生成金属阳离子(或铵根)和酸根的化合物。
按在水溶液的溶解性分为可溶性盐 和难溶性盐
按在水溶液中能否电离H+、OH-分为酸式盐、碱式盐和正盐
酸式盐:在水溶液中能电离出H+ 如NaHCO3
碱式盐:在水溶液中能电离OH- 如Cu2(OH)2CO3
正盐:电离时只生成金属阳离子(或铵根)和酸根 如NaCl
按盐电离出的阳离子或阴离子称为某盐。
物质类别 反应特征 反应类型
活泼金属
某些酸
某些碱
某些盐
复分解反应
活泼金属+不活泼金属盐→不活泼金属+活泼金属盐
置换反应
复分解反应
复分解反应
Fe +CuSO4 =Cu+FeSO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
生成沉淀/气体/水
生成沉淀/气体/水
生成沉淀/气体/水
盐的主要性质
氧化
物
按组成元素
金属氧化物
非金属氧化物
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
按性质
4、氧化物的分类
氧化物:含有两种元素,其中一种是氧元素的化合物
能与碱反应生成盐和水的氧化物,如CO2、SO3等
能与酸反应生成盐和水的氧化物,如CaO、Na2O等
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3等
既不能与酸反应生成盐和水,又不能与碱反应生成盐和水的氧化物,如CO、NO等。
思考与交流
概念辨析
1、金属氧化物一定是碱性氧化物?
2、非金属氧化物一定是酸性氧化物
3、酸性氧化物都能溶于水生成相应的酸?
×
×
×
Mn2O7是酸性氧化物
NO、CO
如SiO2是酸性氧化物,但不溶于水
经验规律:
大多数非金属氧化物属于酸性氧化物,
大多数金属氧化物属于碱性氧化物
碱性氧化物一定是金属氧化物。
除了CO、NO、NO2等
除了Al2O3、Mn2O7、Na2O2等
碱性氧化物性质:
(1)+H2O----可溶性碱
(2)+酸-----盐+水
(3)+酸性氧化物------盐
酸性氧化物性质:
(1)+水---可溶性酸(比如SiO2不行)
(2)+碱---盐和水
(3)+碱性氧化物---盐
总结
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
按阳离子分
按阴离子分
(2) 交叉分类法
同一种事物可以按不同标准(角度)进行分类。标准不同进行分类产生的分类结果就不同。
特点:
物质类别间有交叉的部分
(二)、常见的分类方法
可溶性碱
难溶性碱
一元碱
多元碱
用交叉分类法对下列碱进行分类
NaOH
Ba(OH)2
Fe(OH)3
Mg(OH)2
练习:
C → CO2 → H2CO3 → CaCO3
Ca → CaO → Ca(OH)2 → CaSO4
观察下列转化关系,从物质分类的角度,你发现了什么规律?
非金属
酸性氧化物
酸
盐
金属
碱性氧化物
碱
盐
二、物质的转化
酸、碱、盐、氧化物之间的转化关系
二、物质的转化
碳酸钙
CaCO3
HCl
CaCl2
CO2(实验室制CO2)
我可以通过石灰石(CaCO3)得到哪些物质呢?
加热
CaO生石灰
H2O
Ca(OH)2熟石灰
盐
酸性
氧化物
盐
碱性
氧化物
碱
最适当方法的选择:
实例——工业上制取NaOH,可以用以下3种方法:
①Na2O+H2O══ 2NaOH ;
②电解饱和食盐水:2NaCl+2H2O H2↑+Cl2↑+2NaOH;
③用纯碱和熟石灰反应:
Na2CO3+Ca(OH)2══CaCO3↓+2NaOH。
(Na2O作为原料,来源少、成本高)
综合考虑反应进行的可能性,选取的最适当的方法为方法②。
CaO+H2O==Ca(OH)2
Ca(OH)2 +CO2==CaCO3↓ +H2O
CaCO3 = = CaO+CO2↑
高温
思考与交流
高中化学同步课程
化学必修第一册
第一章 物质及其变化
第一节 物质的分类及转化
第1课时 简单分类法及其应用、物质的转化
机器人对快递件的高速分拣
科学分类的前提是建立科学准确的分类标准 。
科学的分类能够反映事物的本质特征,有利于深入研究,那么怎样才能保证分类的科学性?
分类是提高效率的一种重要手段
一、根据物质的组成和性质分类
任何物质都是由元素组成的,根据元素组成对物质进行分类是化学研究的基础。
只有一种元素组成的纯净物叫单质;
由两种或两种以上种类元素组成的纯净物是化合物。
(一)、元素与物质分类的关系
同素异形体:由同一种元素形成的几种性质不同的单质
注意:
由同一种元素组成的物质不一定是单质,还可能是混合物。
石墨、金刚石都是由碳元素构成的单质,为什么物理性质却各不相同呢?
碳原子的 排列方式不 同
结 构 不同
性 质 不 同
平面层状结构
质软
可做润滑剂
空间网状正四面体型结构
天然最硬的物质
可做切割刀
用 途 不 同
结构决定性质
性质决定用途
思考与交流
请同学们根据初中学习的化学知识,尝试将化学物质进行分类。画出图示,说一说分类的标准
思考与交流
特点:
同一层次的物质类别间一般是相互独立,没有交叉。
(1)树状分类法
(二)、常见的分类方法
按照同一标准采用树状的形式对
同类事物进行再分类的方法
用树状分类法对HCl,CO2 ,CaO ,NaOH, NaHSO4 ,CuSO4·5H2O, CaCO3 , Ca(OH)2 ,NaH,H2SO4进行分类
无机化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
NaHSO4 CaCO3
CuSO4·5H2O
CO2 CaO
氢化物
NaH
练习:
1、 酸的分类
酸:电离时生成的阳离子全部为氢离子的化合物。如H2SO4
按是否含氧分为含氧酸和无氧酸
HNO3 HCl
按有无挥发性分为挥发性酸和难挥发性酸
HNO3 HCl H2SO4
按最多电离H+个数分为一元酸 、二元酸和多元酸
HCl H2CO3 H3PO4
按在水溶液中是否完全电离分为强酸和弱酸
六大强酸:HNO3 、HCl 、H2SO4 、HBr、HI、HClO4
已知H3PO3(亚磷酸)与足量的NaOH完全反应最终生成Na2HPO3,反应方程式为 H3PO3+2NaOH==Na2HPO3+2H2O
请试着分析H3PO3(亚磷酸)属于几元酸?
提示: HCl+NaOH==NaCl+H2O
答案:H3PO3(亚磷酸)是二元酸
思考与交流
酸的通性 反应条件 反应类型
指示剂 使紫色石蕊试液变红色,无色酚酞试液不变色
活泼金属 置换反应
碱性氧化物 复分解反应
碱 复分解反应
某些盐 复分解反应
酸+活泼金属 →盐+氢气
酸+碱性氧化物→盐+水
酸+碱→盐+水
酸+盐→新酸+新盐
酸的通性
2、碱的分类
碱:电离时生成的阴离子全部为氢氧根的化合物。如NaOH
按最多电离OH-个数分为一元碱 、二元碱和多元碱
NaOH Ca(OH)2 Fe(OH)3
按在水溶液中是否完全电离分为强碱和弱碱
四大强碱: NaOH、KOH、Ba(OH)2 、Ca(OH)2
按溶解性
可溶性碱:NaOH、KOH、Ba(OH)2等
难溶性碱:Cu(OH)2 、 Fe(OH)3等
碱的通性 反应特征 反应类型
指示剂 使紫色石蕊试液变蓝色,无色酚酞试液变红色
酸
酸性氧化物
某些盐
酸+碱→盐+水
碱+酸性氧化物→盐+水
复分解反应
复分解反应
碱的通性
碱+盐→新碱+新盐
3、盐的分类
盐:电离时生成金属阳离子(或铵根)和酸根的化合物。
按在水溶液的溶解性分为可溶性盐 和难溶性盐
按在水溶液中能否电离H+、OH-分为酸式盐、碱式盐和正盐
酸式盐:在水溶液中能电离出H+ 如NaHCO3
碱式盐:在水溶液中能电离OH- 如Cu2(OH)2CO3
正盐:电离时只生成金属阳离子(或铵根)和酸根 如NaCl
按盐电离出的阳离子或阴离子称为某盐。
物质类别 反应特征 反应类型
活泼金属
某些酸
某些碱
某些盐
复分解反应
活泼金属+不活泼金属盐→不活泼金属+活泼金属盐
置换反应
复分解反应
复分解反应
Fe +CuSO4 =Cu+FeSO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
生成沉淀/气体/水
生成沉淀/气体/水
生成沉淀/气体/水
盐的主要性质
氧化
物
按组成元素
金属氧化物
非金属氧化物
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
按性质
4、氧化物的分类
氧化物:含有两种元素,其中一种是氧元素的化合物
能与碱反应生成盐和水的氧化物,如CO2、SO3等
能与酸反应生成盐和水的氧化物,如CaO、Na2O等
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3等
既不能与酸反应生成盐和水,又不能与碱反应生成盐和水的氧化物,如CO、NO等。
思考与交流
概念辨析
1、金属氧化物一定是碱性氧化物?
2、非金属氧化物一定是酸性氧化物
3、酸性氧化物都能溶于水生成相应的酸?
×
×
×
Mn2O7是酸性氧化物
NO、CO
如SiO2是酸性氧化物,但不溶于水
经验规律:
大多数非金属氧化物属于酸性氧化物,
大多数金属氧化物属于碱性氧化物
碱性氧化物一定是金属氧化物。
除了CO、NO、NO2等
除了Al2O3、Mn2O7、Na2O2等
碱性氧化物性质:
(1)+H2O----可溶性碱
(2)+酸-----盐+水
(3)+酸性氧化物------盐
酸性氧化物性质:
(1)+水---可溶性酸(比如SiO2不行)
(2)+碱---盐和水
(3)+碱性氧化物---盐
总结
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
按阳离子分
按阴离子分
(2) 交叉分类法
同一种事物可以按不同标准(角度)进行分类。标准不同进行分类产生的分类结果就不同。
特点:
物质类别间有交叉的部分
(二)、常见的分类方法
可溶性碱
难溶性碱
一元碱
多元碱
用交叉分类法对下列碱进行分类
NaOH
Ba(OH)2
Fe(OH)3
Mg(OH)2
练习:
C → CO2 → H2CO3 → CaCO3
Ca → CaO → Ca(OH)2 → CaSO4
观察下列转化关系,从物质分类的角度,你发现了什么规律?
非金属
酸性氧化物
酸
盐
金属
碱性氧化物
碱
盐
二、物质的转化
酸、碱、盐、氧化物之间的转化关系
二、物质的转化
碳酸钙
CaCO3
HCl
CaCl2
CO2(实验室制CO2)
我可以通过石灰石(CaCO3)得到哪些物质呢?
加热
CaO生石灰
H2O
Ca(OH)2熟石灰
盐
酸性
氧化物
盐
碱性
氧化物
碱
最适当方法的选择:
实例——工业上制取NaOH,可以用以下3种方法:
①Na2O+H2O══ 2NaOH ;
②电解饱和食盐水:2NaCl+2H2O H2↑+Cl2↑+2NaOH;
③用纯碱和熟石灰反应:
Na2CO3+Ca(OH)2══CaCO3↓+2NaOH。
(Na2O作为原料,来源少、成本高)
综合考虑反应进行的可能性,选取的最适当的方法为方法②。
CaO+H2O==Ca(OH)2
Ca(OH)2 +CO2==CaCO3↓ +H2O
CaCO3 = = CaO+CO2↑
高温
思考与交流
