1.3 .1 氧化还原反应 课件(共29张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3 .1 氧化还原反应 课件(共29张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 41.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 21:19:54 | ||
图片预览





文档简介
(共29张PPT)
化学必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
思 考
将下列反应从四大基本反应的角度进行分类
5、
1、2H2 + O2 == 2H2O
2、Zn + H2SO4 = =ZnSO4 + H2↑
3、CaCO3 = =CaO + CO2↑
高温
4、NaCl + AgNO3 == AgCl ↓+ NaNO3
6、
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
初中从得失氧的角度来定义氧化反应和还原反应,请同学们根据这个定义填写下表:
反应 得氧物质 反应类型
C + 2CuO 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
有物质得氧的同时一定有物质失氧,即氧化反应和还原反应应该在一个反应中同时发生。
↑
标出以下两个反应中各物质所含元素的化合价,比较反应前后化合价有无变化
0
+2
-2
0
+4
-2
+3
-2
+2
-2
0
+4
-2
反应中元素的化合价有变化
一、氧化还原反应
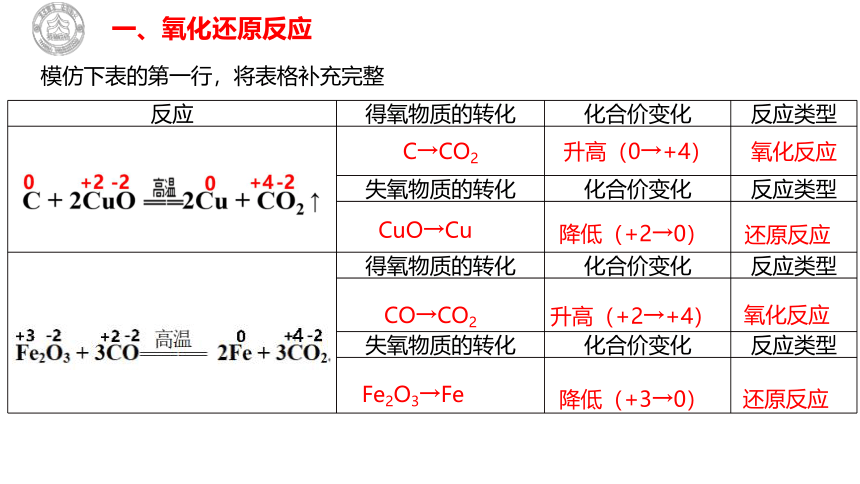
模仿下表的第一行,将表格补充完整
CuO→Cu
降低(+2→0)
还原反应
CO→CO2
升高(+2→+4)
氧化反应
Fe2O3→Fe
降低(+3→0)
还原反应
反应 得氧物质的转化 化合价变化 反应类型
C→CO2 升高(0→+4) 氧化反应
失氧物质的转化 化合价变化 反应类型
得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
一、氧化还原反应
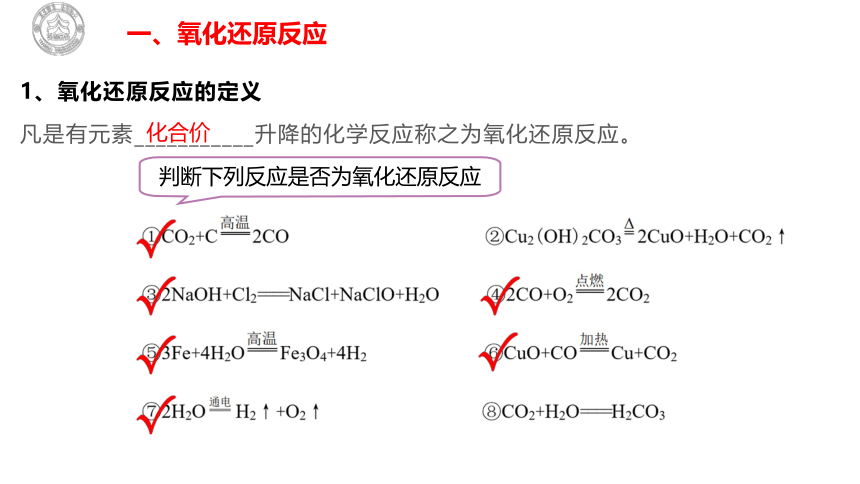
1、氧化还原反应的定义
凡是有元素___________升降的化学反应称之为氧化还原反应。
化合价
判断下列反应是否为氧化还原反应
一、氧化还原反应
2、氧化还原反应的特征
元素的化合价在反应前后发生了变化。
3、氧化反应、还原反应的定义(元素化合价角度)
①. 氧化反应:物质所含元素化合价________的反应叫做氧化反应。
②. 还原反应:物质所含元素化合价________的反应叫做还原反应。
升高
降低
氧化反应不一定得氧
还原反应不一定失氧
一、氧化还原反应
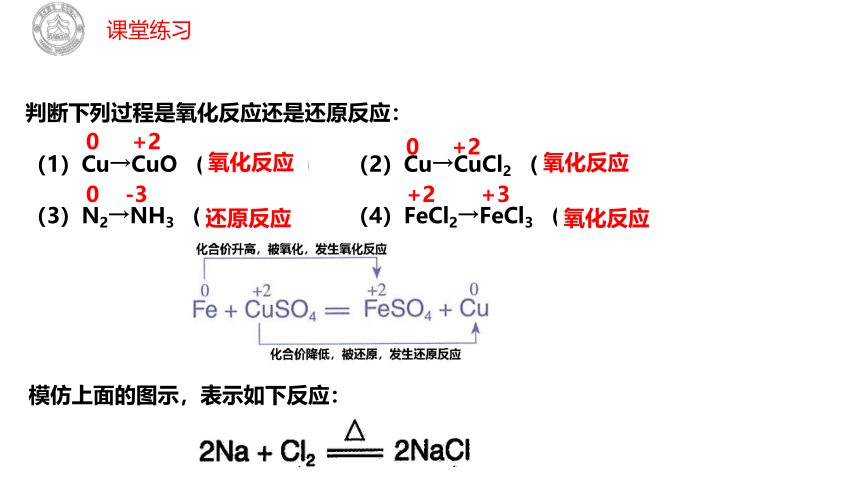
判断下列过程是氧化反应还是还原反应:
(1)Cu→CuO ( ) (2)Cu→CuCl2 ( )
(3)N2→NH3 ( ) (4)FeCl2→FeCl3 ( )
氧化反应
氧化反应
氧化反应
还原反应
0 +2
0 +2
+2 +3
0 -3
课堂练习
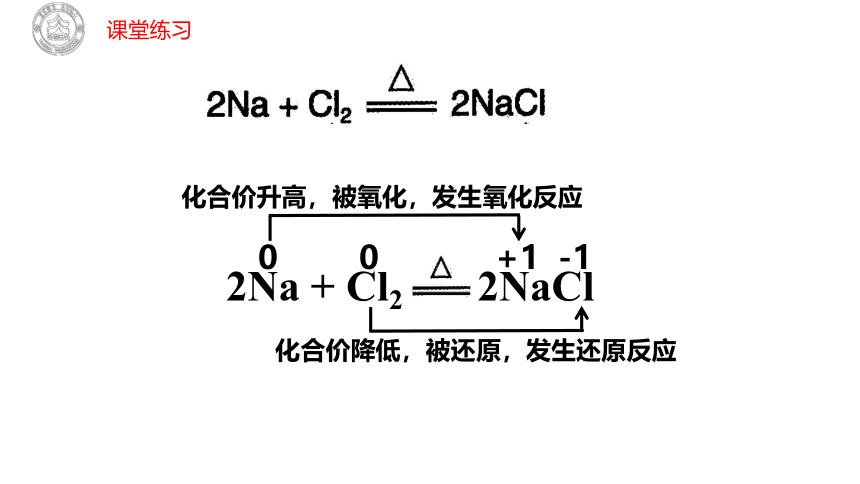
模仿上面的图示,表示如下反应:
0
+1
化合价升高,被氧化,发生氧化反应
-1
0
化合价降低,被还原,发生还原反应
2Na + Cl2 2NaCl
课堂练习
下列反应转化关系(未配平)肯定不正确的是 ( )
A.S+KOH→K2SO3+K2S+H2O
B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu2O+H2SO4→CuSO4+Cu+H2O
D.NH4NO3→N2O+H2O
0
+4
-2
+2
+3
+1
+2
0
-3
+5
+1
无化合价降低
B
课堂练习
氧化还原反应中一定同时存在元素化合价的升高与降低
氧化还原反应前后,元素化合价为什么会改变?
从原子结构来看,钠原子的最外电子层上有1个电子,氯原子的最外电子层上有7个电子
当Na与Cl2反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+)
氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-)
这样双方最外电子层都达到了8个电子的稳定结构
带相反电荷的Na+ 与Cl- 相互作用就形成了NaCl(氯化钠)
+11
2 8 1
+17
7 8 2
Na
Cl
-e-
+11
2 8
Na+
+17
8 8 2
Cl-
Na+
Cl-
+ e-
氯化钠的形成
反应中钠元素的化合价从0价升高到+1价,Na被氧化
氯元素的化合价从0价降低到-1价,Cl2被还原
在这个反应中,发生了电子的得失
Na发生了氧化反应,Cl2发生了还原反应
+11
2 8 1
+17
7 8 2
Na
Cl
-e-
+11
2 8
Na+
+17
8 8 2
Cl-
Na+
Cl-
+ e-
点燃
2 Na + Cl2 NaCl
氯化钠的形成
氯化氢的形成,是不是跟氯化钠一样,也是电子的得失呢?
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
HCl
氯化氢的形成
氢原子的最外电子层上有1个电子,可获得1个电子而形成2个电子的稳定结构;氯原子的最外电子层上有7个电子,也可获得1个电子而形成8个电子的稳定结构
在发生反应时,它们都未能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引,使双方最外电子层都达到稳定结构
由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
HCl
氯化氢的形成
氢元素的化合价从0价升高到+1价,H2被氧化
氯元素的化合价从0价降低到-1价,C12被还原
在这个反应中,发生了共用电子对的偏移
H2发生了氧化反应,C12发生了还原反应
点燃
H2 + Cl2 2 HCl
氧化剂/还原剂、得电子/失电子、化合价降低/升高,三者关系如下
4、氧化还原反应的本质
氧化还原反应的本质,是发生了电子的________,包括电子________、共用电子对的________两种情况。
转移
得失
偏移
一、氧化还原反应
易错提醒
氧化还原反应的本质是电子的转移(电子得失或共用电子对偏移),
特征是元素的化合价发生了变化。
5、氧化还原反应的基本概念
(1)氧化剂
①氧化剂是 电子(或电子对 )的物质,具有氧化性。
②氧化剂在反应时所含元素的化合价 ,本身被还原,生成 。
(2)还原剂
①还原剂是 电子(或电子对 )的物质,具有还原性。
②还原剂在反应时所含元素的化合价 ,本身被氧化,生成 。
得到
偏向
降低
失去
偏离
升高
还原产物
氧化产物
升失氧化还原剂
降得还原氧化剂
反应 氧化剂 还原剂 氧化产物 还原产物
Fe+CuSO4===FeSO4 + Cu
Cl2+2NaOH===NaCl+NaClO+H2O
SO2+2H2S===2H2O+3S↓
CuSO4
Fe
FeSO4
Cu
Cl2
Cl2
NaClO
NaCl
SO2
H2S
S
S
在氧化还原反应中,氧化剂与还原剂可能是同一物质,
氧化产物和还原产物也有可能是同一物质。
课堂练习
请指出下列各反应的四种基本反应类型:
①2NO+O2===2NO2______________
②CO2+CaO===CaCO3______________
③NH4HCO3 NH3↑+CO2↑+H2O______________
④2KClO3 2KCl+3O2↑______________
⑤Fe+2HCl===FeCl2+H2↑______________
化合反应
化合反应
分解反应
分解反应
置换反应
课堂练习
⑥Zn+CuSO4===ZnSO4+Cu______________
⑦HCl+KOH===KCl+H2O_________________
⑧BaCl2+Na2SO4===BaSO4↓+2NaCl_________________
上述各反应属于氧化还原反应的是 (填序号)。
置换反应
复分解反应
复分解反应
①④ ⑤⑥
四种基本反应类型与氧化还原反应的关系
6、四大基本反应类型与氧化还原的关系
1. 化合反应_____________是氧化还原反应;
2. 分解反应_____________是氧化还原反应;
3. 置换反应_____________是氧化还原反应;
4. 复分解反应___________是氧化还原反应。
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
不一定
不一定
一定
一定不
有单质参加的化合反应一定是氧化还原反应
有单质生成的分解反应一定是氧化还原反应
氧化还原反应的本质是电子的转移,怎么直观地表示电子的转移呢?
1. 双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
画法
标价态
连双线
注得失
标出反应前后有化合价变化的元素的化合价
箭头由反应物指向生成物,且两端对准同一种变价元素
标出“失去”或“得到”的电子总数(a × b e- )
a 表示得到或失去电子的原子的数目
b 表示每个原子失去或得到的电子数
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
二、氧化还原反应中电子转移的表示方法
2. 单线桥法:表示反应过程中不同元素原子间的电子转移情况。
画法
标价态
连单线
注数目
标出反应前后有化合价变化的元素的化合价(只标反应物)
用线桥将反应物连接起来,箭头由得电子的元素指向失电子的元素
在线桥上注明电子转移的总数目
4e-
0
+2
C + 2CuO
CO2↑ + 2Cu
高温
归纳总结
还原剂——升失氧(化合价升高、失去电子、被氧化、发生氧化反应、得到氧化产物)
氧化剂——降得还(化合价降低、得到电子、被还原、发生还原反应、得到还原产物)
得电子、化合价降低、被还原、发生还原反应
失电子、化合价升高、被氧化、发生氧化反应
氧化剂 + 还原剂
还原产物
+ 氧化产物
(氧化性)
(还原性)
(2021·内蒙古包头·)宋代著名法医学家宋慈所著的《洗冤集录》中有“银针验毒”的记载。“银针验毒”的原理是4Ag+2H2S+O2═2X+2H2O ,下列有关该反应的说法正确的是
A. H2S发生氧化反应,是还原剂 B.O2 被氧化,是氧化剂
C.Ag发生氧化反应,是还原剂 D.Ag2S是还原产物
C
课堂练习
用双线桥法和单线桥法表示电子转移的方向和数目。
(1)WO3+3H2 =W+3H2O_____________、_____________;
(2)2HgO =2Hg+O2↑______________、___________;
(3)H2O2+H2S=2H2O+S↓________________、_____________。
课堂练习
化学必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
思 考
将下列反应从四大基本反应的角度进行分类
5、
1、2H2 + O2 == 2H2O
2、Zn + H2SO4 = =ZnSO4 + H2↑
3、CaCO3 = =CaO + CO2↑
高温
4、NaCl + AgNO3 == AgCl ↓+ NaNO3
6、
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
初中从得失氧的角度来定义氧化反应和还原反应,请同学们根据这个定义填写下表:
反应 得氧物质 反应类型
C + 2CuO 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
有物质得氧的同时一定有物质失氧,即氧化反应和还原反应应该在一个反应中同时发生。
↑
标出以下两个反应中各物质所含元素的化合价,比较反应前后化合价有无变化
0
+2
-2
0
+4
-2
+3
-2
+2
-2
0
+4
-2
反应中元素的化合价有变化
一、氧化还原反应
模仿下表的第一行,将表格补充完整
CuO→Cu
降低(+2→0)
还原反应
CO→CO2
升高(+2→+4)
氧化反应
Fe2O3→Fe
降低(+3→0)
还原反应
反应 得氧物质的转化 化合价变化 反应类型
C→CO2 升高(0→+4) 氧化反应
失氧物质的转化 化合价变化 反应类型
得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
一、氧化还原反应
1、氧化还原反应的定义
凡是有元素___________升降的化学反应称之为氧化还原反应。
化合价
判断下列反应是否为氧化还原反应
一、氧化还原反应
2、氧化还原反应的特征
元素的化合价在反应前后发生了变化。
3、氧化反应、还原反应的定义(元素化合价角度)
①. 氧化反应:物质所含元素化合价________的反应叫做氧化反应。
②. 还原反应:物质所含元素化合价________的反应叫做还原反应。
升高
降低
氧化反应不一定得氧
还原反应不一定失氧
一、氧化还原反应
判断下列过程是氧化反应还是还原反应:
(1)Cu→CuO ( ) (2)Cu→CuCl2 ( )
(3)N2→NH3 ( ) (4)FeCl2→FeCl3 ( )
氧化反应
氧化反应
氧化反应
还原反应
0 +2
0 +2
+2 +3
0 -3
课堂练习
模仿上面的图示,表示如下反应:
0
+1
化合价升高,被氧化,发生氧化反应
-1
0
化合价降低,被还原,发生还原反应
2Na + Cl2 2NaCl
课堂练习
下列反应转化关系(未配平)肯定不正确的是 ( )
A.S+KOH→K2SO3+K2S+H2O
B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu2O+H2SO4→CuSO4+Cu+H2O
D.NH4NO3→N2O+H2O
0
+4
-2
+2
+3
+1
+2
0
-3
+5
+1
无化合价降低
B
课堂练习
氧化还原反应中一定同时存在元素化合价的升高与降低
氧化还原反应前后,元素化合价为什么会改变?
从原子结构来看,钠原子的最外电子层上有1个电子,氯原子的最外电子层上有7个电子
当Na与Cl2反应时,钠原子失去1个电子,带1个单位正电荷,成为钠离子(Na+)
氯原子得到1个电子,带1个单位负电荷,成为氯离子(Cl-)
这样双方最外电子层都达到了8个电子的稳定结构
带相反电荷的Na+ 与Cl- 相互作用就形成了NaCl(氯化钠)
+11
2 8 1
+17
7 8 2
Na
Cl
-e-
+11
2 8
Na+
+17
8 8 2
Cl-
Na+
Cl-
+ e-
氯化钠的形成
反应中钠元素的化合价从0价升高到+1价,Na被氧化
氯元素的化合价从0价降低到-1价,Cl2被还原
在这个反应中,发生了电子的得失
Na发生了氧化反应,Cl2发生了还原反应
+11
2 8 1
+17
7 8 2
Na
Cl
-e-
+11
2 8
Na+
+17
8 8 2
Cl-
Na+
Cl-
+ e-
点燃
2 Na + Cl2 NaCl
氯化钠的形成
氯化氢的形成,是不是跟氯化钠一样,也是电子的得失呢?
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
HCl
氯化氢的形成
氢原子的最外电子层上有1个电子,可获得1个电子而形成2个电子的稳定结构;氯原子的最外电子层上有7个电子,也可获得1个电子而形成8个电子的稳定结构
在发生反应时,它们都未能把对方的电子夺取过来,而是双方各以最外层的1个电子组成一个共用电子对,这个电子对受到两个原子核的共同吸引,使双方最外电子层都达到稳定结构
由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
HCl
氯化氢的形成
氢元素的化合价从0价升高到+1价,H2被氧化
氯元素的化合价从0价降低到-1价,C12被还原
在这个反应中,发生了共用电子对的偏移
H2发生了氧化反应,C12发生了还原反应
点燃
H2 + Cl2 2 HCl
氧化剂/还原剂、得电子/失电子、化合价降低/升高,三者关系如下
4、氧化还原反应的本质
氧化还原反应的本质,是发生了电子的________,包括电子________、共用电子对的________两种情况。
转移
得失
偏移
一、氧化还原反应
易错提醒
氧化还原反应的本质是电子的转移(电子得失或共用电子对偏移),
特征是元素的化合价发生了变化。
5、氧化还原反应的基本概念
(1)氧化剂
①氧化剂是 电子(或电子对 )的物质,具有氧化性。
②氧化剂在反应时所含元素的化合价 ,本身被还原,生成 。
(2)还原剂
①还原剂是 电子(或电子对 )的物质,具有还原性。
②还原剂在反应时所含元素的化合价 ,本身被氧化,生成 。
得到
偏向
降低
失去
偏离
升高
还原产物
氧化产物
升失氧化还原剂
降得还原氧化剂
反应 氧化剂 还原剂 氧化产物 还原产物
Fe+CuSO4===FeSO4 + Cu
Cl2+2NaOH===NaCl+NaClO+H2O
SO2+2H2S===2H2O+3S↓
CuSO4
Fe
FeSO4
Cu
Cl2
Cl2
NaClO
NaCl
SO2
H2S
S
S
在氧化还原反应中,氧化剂与还原剂可能是同一物质,
氧化产物和还原产物也有可能是同一物质。
课堂练习
请指出下列各反应的四种基本反应类型:
①2NO+O2===2NO2______________
②CO2+CaO===CaCO3______________
③NH4HCO3 NH3↑+CO2↑+H2O______________
④2KClO3 2KCl+3O2↑______________
⑤Fe+2HCl===FeCl2+H2↑______________
化合反应
化合反应
分解反应
分解反应
置换反应
课堂练习
⑥Zn+CuSO4===ZnSO4+Cu______________
⑦HCl+KOH===KCl+H2O_________________
⑧BaCl2+Na2SO4===BaSO4↓+2NaCl_________________
上述各反应属于氧化还原反应的是 (填序号)。
置换反应
复分解反应
复分解反应
①④ ⑤⑥
四种基本反应类型与氧化还原反应的关系
6、四大基本反应类型与氧化还原的关系
1. 化合反应_____________是氧化还原反应;
2. 分解反应_____________是氧化还原反应;
3. 置换反应_____________是氧化还原反应;
4. 复分解反应___________是氧化还原反应。
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
不一定
不一定
一定
一定不
有单质参加的化合反应一定是氧化还原反应
有单质生成的分解反应一定是氧化还原反应
氧化还原反应的本质是电子的转移,怎么直观地表示电子的转移呢?
1. 双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
画法
标价态
连双线
注得失
标出反应前后有化合价变化的元素的化合价
箭头由反应物指向生成物,且两端对准同一种变价元素
标出“失去”或“得到”的电子总数(a × b e- )
a 表示得到或失去电子的原子的数目
b 表示每个原子失去或得到的电子数
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
二、氧化还原反应中电子转移的表示方法
2. 单线桥法:表示反应过程中不同元素原子间的电子转移情况。
画法
标价态
连单线
注数目
标出反应前后有化合价变化的元素的化合价(只标反应物)
用线桥将反应物连接起来,箭头由得电子的元素指向失电子的元素
在线桥上注明电子转移的总数目
4e-
0
+2
C + 2CuO
CO2↑ + 2Cu
高温
归纳总结
还原剂——升失氧(化合价升高、失去电子、被氧化、发生氧化反应、得到氧化产物)
氧化剂——降得还(化合价降低、得到电子、被还原、发生还原反应、得到还原产物)
得电子、化合价降低、被还原、发生还原反应
失电子、化合价升高、被氧化、发生氧化反应
氧化剂 + 还原剂
还原产物
+ 氧化产物
(氧化性)
(还原性)
(2021·内蒙古包头·)宋代著名法医学家宋慈所著的《洗冤集录》中有“银针验毒”的记载。“银针验毒”的原理是4Ag+2H2S+O2═2X+2H2O ,下列有关该反应的说法正确的是
A. H2S发生氧化反应,是还原剂 B.O2 被氧化,是氧化剂
C.Ag发生氧化反应,是还原剂 D.Ag2S是还原产物
C
课堂练习
用双线桥法和单线桥法表示电子转移的方向和数目。
(1)WO3+3H2 =W+3H2O_____________、_____________;
(2)2HgO =2Hg+O2↑______________、___________;
(3)H2O2+H2S=2H2O+S↓________________、_____________。
课堂练习
