1.3 第氧化还原反应的分类及其配平 课件(共31张PPT) 2023-2024学年高一化学同步精品课件+讲义(人教版2019必修第一册)
文档属性
| 名称 | 1.3 第氧化还原反应的分类及其配平 课件(共31张PPT) 2023-2024学年高一化学同步精品课件+讲义(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 21:23:39 | ||
图片预览










文档简介
(共31张PPT)
第08讲 氧化还原反应的分类及其配平
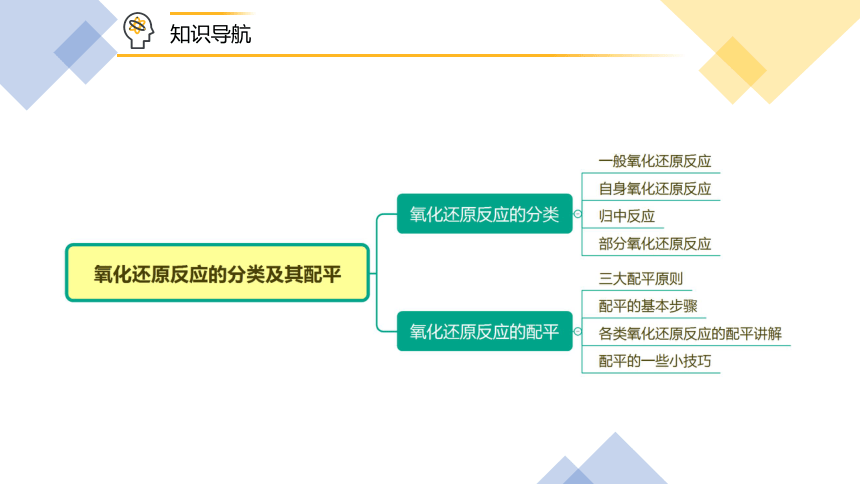
知识导航
1. 通过元素化合价的分析,对常见的氧化还原反应反应进行分类。
2. 掌握不同氧化还原反应的配平方法。
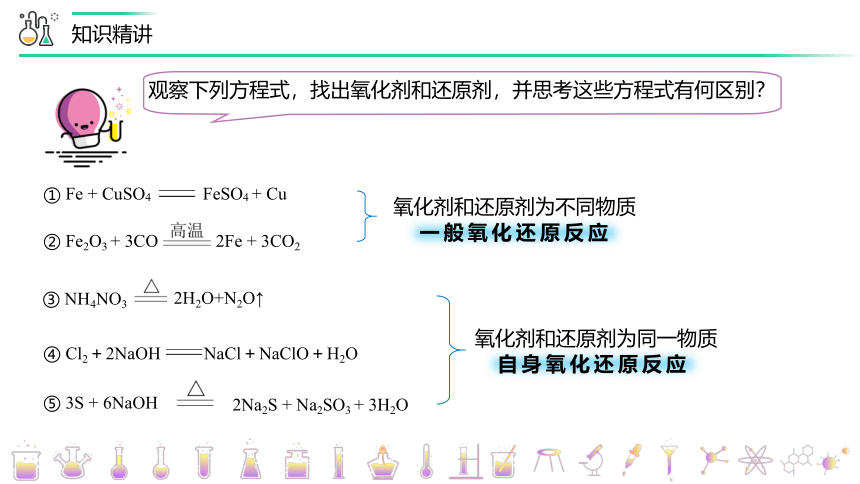
观察下列方程式,找出氧化剂和还原剂,并思考这些方程式有何区别?
① Fe + CuSO4 FeSO4 + Cu
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
② Fe2O3 + 3CO 2Fe + 3CO2
③ NH4NO3
2H2O+N2O↑
④ Cl2+2NaOH NaCl+NaClO+H2O
氧化剂和还原剂为不同物质
氧化剂和还原剂为同一物质
一般氧化还原反应
自身氧化还原反应
同为自身氧化还原反应,第③个和第④⑤个有什么区别吗?
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
③ NH4NO3
2H2O+N2O↑
④ Cl2+2NaOH NaCl+NaClO+H2O
自身氧化还原反应
④⑤的化合价升降发生在同一物质中同一价态的同一元素间。
歧化反应
观察下列方程式,从变价元素的化合价变化角度思考,这两个方程式有何相同之处?
⑥ SO2 + 2H2S 2H2O + 3S↓
⑦ H2S + H2SO4 S↓ + SO2↑ + 2H2O
元素的两种化合价向中间靠拢
归中反应
观察下列方程式,变价元素的化合价,是否全部发生了变化?
⑧ 3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑ + 4H2O
⑨ MnO2 + 4HCl(浓)
MnCl2 + 2H2O + Cl2↑
还原剂/氧化剂只有部分被氧化/还原
部分氧化还原反应
一、氧化还原反应的分类
1. 一般氧化还原反应,如①②
2. 自身氧化还原反应,如③④⑤,
其中,④⑤又称为歧化反应
3. 归中反应,如⑥⑦
4. 部分氧化还原反应,如⑧⑨
注意
对于部分氧化还原反应,氧化剂(还原剂)中被还原(氧化)与未被还原(氧化)的比例,要依据化学方程式或得失电子数来确定,只有被还原(氧化)的那部分才作氧化剂(还原剂)
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
4个HCl中只有____个作还原剂
△
3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑ + 4H2O
8个HNO3中只有____个作氧化剂
举两个例子
2
2
二、氧化还原反应的配平
1. 氧化还原反应的配平原则
(1)电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数 = 化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,所带电荷总数相等。
二、氧化还原反应的配平
2. 氧化还原反应配平的基本步骤
标变价
列得失
等升降
标出变价元素的化合价
列出化合价的变化值
最小公倍数法配平使化合价升降总数相等
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
只有离子方程式需要检查电荷是否守恒。
让我来举一大波例子~
2
1
2
1
1
1
2
2
2
2
一般氧化还原反应
____ FeCl3 + _____ H2S —— _____ FeCl2 + _____HCl + _____S↓
_____C + _____H2SO4(浓) —— _____CO2↑+ _____H2O + _____SO2↑
【总结】对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
——
——
自身氧化还原反应
_____HNO3 —— _____NO2↑+ _____O2↑+ _____H2O
4
4
1
2
3
1
1
2
3
6
2
1
3
_____NO2 + _____H2O —— _____HNO3 + _____NO
_____S + _____NaOH —— _____Na2S + _____Na2SO3 + _____H2O
【总结】对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
——
——
——
归中反应
_____NH3 + _____NO —— _____N2 + _____H2O
4
6
5
6
5
3
3
3
1
3
_____KI + _____KIO3 + _____H2SO4 —— _____K2SO4 + _____I2 + _____H2O
【总结】对于归中反应,一般从左边氧化剂、还原剂着手配平。
——
——
部分氧化还原反应
_____ Cu + _____H2SO4(浓) —— _____ CuSO4 + _____SO2↑+ _____H2O
1
2
1
4
1
2
1
2
1
1
_____Fe + _____HNO3(稀) —— _____Fe(NO3)3 + _____NO↑+ _____H2O
【总结】对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
——
——
氧化还原离子方程式
_____MnO + _____Fe2++ _____—— _____Mn2+ + _____Fe3+ + _____
_____MnO2 + ____+ _____OH- —— ____ + ____Cl- + ____H2O
6
1
3
5
1
5
1
3
1
3
8H+
4H2O
【总结】离子方程式中,若电荷不守恒,需根据溶液的酸碱性,利用H+ / OH- 配平电荷。
——
——
若变价元素在物质中有下标,配平时需要额外注意该元素的化合价变化数目。试着配平下面这个离子反应方程式
_____ + _____S2- + _____H+ —— _____Cr3+ + _____S↓+ _____H2O
1
3
14
2
3
7
不要忘记乘下标。
——
归纳总结
1. 一般从左配:对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
2. 自变从右配:对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
3. 归中从左配:对于归中反应,一般从左边氧化剂、还原剂着手配平。
4. 部分别忘加:对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
知识点都掌握了吗?来做几道题检测下~
【例1】分析下列四个反应,回答问题:
(1)氯元素部分被氧化的是 ;
(2)氯元素只被还原的是 ;
(3)氯元素既被氧化又被还原的是 ;
(4)氯元素既未被氧化又未被还原的是 ;
(5)反应①中每生成1个Cl2,转移电子数为 ;
(6)上面4个反应中,不属于氧化还原反应的是 。
题型一:元素化合价、转移电子的分析
①③
②
③
④
2
④
【例2】有一种用实际参加化学反应的离子符号来表示化学反应的式子叫离子方程式,在离子方程式中,反应前后电荷是守恒的,如下离子方程式:
2RO4n- +5C2O42- +16H+=2R2++10CO2↑+8H2O,由此可知在RO4n- 中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
题型二:判断元素化合价(得失电子守恒)
D
【例3】配平下列化学反应。
(1)_______HCl(浓)+______MnO2 ______Cl2↑+______MnCl2+______H2O
(2)_______Cu+______HNO3(稀) = _______Cu(NO3)2+______NO↑+_____H2O
(3)______ S+______KOH = ______K2S+_______K2SO3+_______H2O
(4)_______ ClO-+______Fe(OH)3+_______ = ______Cl-+_____ +______H2O
题型二:氧化还原方程式的配平
△
【答案】4HCl(浓)+MnO2
+5H2O
Cl2↑+MnCl2+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3S+6KOH=2K2S+1K2SO3+3H2O
3ClO-+2Fe(OH)3+4OH-=3Cl-+2
△
【例7】按要求完成下列问题:
(1)NO被H2O2氧化为NO 的离子方程式为_____________________________________。
(2)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:_____________________________________。
(3)水中的溶解氧是水生生物生存不可缺少的条件。将水样与Mn(OH)2碱性悬浊液混合,反应生成MnO(OH)2,实现氧的固定。“氧的固定”中发生反应的化学方程式为______________________________。
题型三:氧化还原方程式的书写
2NO+3H2O2+2OH-=2NO
+4H2O
2HNO2+(NH2)2CO=2N2+CO2+3H2O
2Mn(OH)2+O2=2MnO(OH)2
【例7】按要求完成下列问题:
4)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_____________________________________。
(5)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
①实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
_____________________
②联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_____________________________ 。
题型三:氧化还原方程式的书写
2As2S3+5O2+6H2O=4H3AsO4+6S
NaClO+2NH3=NaCl+N2H4+H2O
固体逐渐变黑,并有气泡产生
【例8】(2022秋·广东广州·高一西关外国语学校校考期中)某体系中发生的一个反应,反应物和生成物共六种微粒:Fe3+、Mn2+、MnO4- 、H2O、Fe2+、H+,已知MnO4- 为其中一种反应物,下列说法正确的是
A.只有MnO4- 和Fe2+是反应物 B.被还原的元素是Fe
C.发生氧化反应的物质是MnO4- D.氧化剂与还原剂的个数比为1∶5
题型四:氧化还原基础概念与方程式书写综合考查
D
【例9】储氢碳纳米管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式□C+□( )+□H2SO4=□( )+□( )+□Cr2(SO4)3+□H2O:
_________________________________________________________。
(2)上述反应中氧化剂是________ (填化学式),被氧化的元素是_________(填元素符号)。
(3) H2SO4在上述反应中表现的性质是______(填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
题型四:氧化还原基础概念与方程式书写综合考查
K2Cr2O7
C
C
【例11】稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
题型四:氧化还原基础概念与方程式书写综合考查
资料:①铈(Ce)常见的化合价为+3和+4;
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
题型四:氧化还原基础概念与方程式书写综合考查
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式__________________________________________。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____________________________。
(3)步骤Ⅲ的操作名称是__________。
(4)步骤Ⅳ中加入H2O2的目的是______________。
(5)步骤Ⅴ中发生反应的离子方程式是____________________________________________________。
【例11】
Ce4+和Ce3+
分液
作为还原剂
知识导航
第08讲 氧化还原反应的分类及其配平
知识导航
1. 通过元素化合价的分析,对常见的氧化还原反应反应进行分类。
2. 掌握不同氧化还原反应的配平方法。
观察下列方程式,找出氧化剂和还原剂,并思考这些方程式有何区别?
① Fe + CuSO4 FeSO4 + Cu
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
② Fe2O3 + 3CO 2Fe + 3CO2
③ NH4NO3
2H2O+N2O↑
④ Cl2+2NaOH NaCl+NaClO+H2O
氧化剂和还原剂为不同物质
氧化剂和还原剂为同一物质
一般氧化还原反应
自身氧化还原反应
同为自身氧化还原反应,第③个和第④⑤个有什么区别吗?
⑤ 3S + 6NaOH
2Na2S + Na2SO3 + 3H2O
③ NH4NO3
2H2O+N2O↑
④ Cl2+2NaOH NaCl+NaClO+H2O
自身氧化还原反应
④⑤的化合价升降发生在同一物质中同一价态的同一元素间。
歧化反应
观察下列方程式,从变价元素的化合价变化角度思考,这两个方程式有何相同之处?
⑥ SO2 + 2H2S 2H2O + 3S↓
⑦ H2S + H2SO4 S↓ + SO2↑ + 2H2O
元素的两种化合价向中间靠拢
归中反应
观察下列方程式,变价元素的化合价,是否全部发生了变化?
⑧ 3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑ + 4H2O
⑨ MnO2 + 4HCl(浓)
MnCl2 + 2H2O + Cl2↑
还原剂/氧化剂只有部分被氧化/还原
部分氧化还原反应
一、氧化还原反应的分类
1. 一般氧化还原反应,如①②
2. 自身氧化还原反应,如③④⑤,
其中,④⑤又称为歧化反应
3. 归中反应,如⑥⑦
4. 部分氧化还原反应,如⑧⑨
注意
对于部分氧化还原反应,氧化剂(还原剂)中被还原(氧化)与未被还原(氧化)的比例,要依据化学方程式或得失电子数来确定,只有被还原(氧化)的那部分才作氧化剂(还原剂)
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
4个HCl中只有____个作还原剂
△
3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2NO↑ + 4H2O
8个HNO3中只有____个作氧化剂
举两个例子
2
2
二、氧化还原反应的配平
1. 氧化还原反应的配平原则
(1)电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数 = 化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,所带电荷总数相等。
二、氧化还原反应的配平
2. 氧化还原反应配平的基本步骤
标变价
列得失
等升降
标出变价元素的化合价
列出化合价的变化值
最小公倍数法配平使化合价升降总数相等
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
只有离子方程式需要检查电荷是否守恒。
让我来举一大波例子~
2
1
2
1
1
1
2
2
2
2
一般氧化还原反应
____ FeCl3 + _____ H2S —— _____ FeCl2 + _____HCl + _____S↓
_____C + _____H2SO4(浓) —— _____CO2↑+ _____H2O + _____SO2↑
【总结】对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
——
——
自身氧化还原反应
_____HNO3 —— _____NO2↑+ _____O2↑+ _____H2O
4
4
1
2
3
1
1
2
3
6
2
1
3
_____NO2 + _____H2O —— _____HNO3 + _____NO
_____S + _____NaOH —— _____Na2S + _____Na2SO3 + _____H2O
【总结】对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
——
——
——
归中反应
_____NH3 + _____NO —— _____N2 + _____H2O
4
6
5
6
5
3
3
3
1
3
_____KI + _____KIO3 + _____H2SO4 —— _____K2SO4 + _____I2 + _____H2O
【总结】对于归中反应,一般从左边氧化剂、还原剂着手配平。
——
——
部分氧化还原反应
_____ Cu + _____H2SO4(浓) —— _____ CuSO4 + _____SO2↑+ _____H2O
1
2
1
4
1
2
1
2
1
1
_____Fe + _____HNO3(稀) —— _____Fe(NO3)3 + _____NO↑+ _____H2O
【总结】对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
——
——
氧化还原离子方程式
_____MnO + _____Fe2++ _____—— _____Mn2+ + _____Fe3+ + _____
_____MnO2 + ____+ _____OH- —— ____ + ____Cl- + ____H2O
6
1
3
5
1
5
1
3
1
3
8H+
4H2O
【总结】离子方程式中,若电荷不守恒,需根据溶液的酸碱性,利用H+ / OH- 配平电荷。
——
——
若变价元素在物质中有下标,配平时需要额外注意该元素的化合价变化数目。试着配平下面这个离子反应方程式
_____ + _____S2- + _____H+ —— _____Cr3+ + _____S↓+ _____H2O
1
3
14
2
3
7
不要忘记乘下标。
——
归纳总结
1. 一般从左配:对于一般氧化还原反应,一般从左边氧化剂、还原剂着手配平。
2. 自变从右配:对于自身氧化还原反应,一般从右边氧化产物、还原产物配平。
3. 归中从左配:对于归中反应,一般从左边氧化剂、还原剂着手配平。
4. 部分别忘加:对于部分氧化还原反应,一般先配平得失电子,再加上没有变价的部分。
知识点都掌握了吗?来做几道题检测下~
【例1】分析下列四个反应,回答问题:
(1)氯元素部分被氧化的是 ;
(2)氯元素只被还原的是 ;
(3)氯元素既被氧化又被还原的是 ;
(4)氯元素既未被氧化又未被还原的是 ;
(5)反应①中每生成1个Cl2,转移电子数为 ;
(6)上面4个反应中,不属于氧化还原反应的是 。
题型一:元素化合价、转移电子的分析
①③
②
③
④
2
④
【例2】有一种用实际参加化学反应的离子符号来表示化学反应的式子叫离子方程式,在离子方程式中,反应前后电荷是守恒的,如下离子方程式:
2RO4n- +5C2O42- +16H+=2R2++10CO2↑+8H2O,由此可知在RO4n- 中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
题型二:判断元素化合价(得失电子守恒)
D
【例3】配平下列化学反应。
(1)_______HCl(浓)+______MnO2 ______Cl2↑+______MnCl2+______H2O
(2)_______Cu+______HNO3(稀) = _______Cu(NO3)2+______NO↑+_____H2O
(3)______ S+______KOH = ______K2S+_______K2SO3+_______H2O
(4)_______ ClO-+______Fe(OH)3+_______ = ______Cl-+_____ +______H2O
题型二:氧化还原方程式的配平
△
【答案】4HCl(浓)+MnO2
+5H2O
Cl2↑+MnCl2+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3S+6KOH=2K2S+1K2SO3+3H2O
3ClO-+2Fe(OH)3+4OH-=3Cl-+2
△
【例7】按要求完成下列问题:
(1)NO被H2O2氧化为NO 的离子方程式为_____________________________________。
(2)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:_____________________________________。
(3)水中的溶解氧是水生生物生存不可缺少的条件。将水样与Mn(OH)2碱性悬浊液混合,反应生成MnO(OH)2,实现氧的固定。“氧的固定”中发生反应的化学方程式为______________________________。
题型三:氧化还原方程式的书写
2NO+3H2O2+2OH-=2NO
+4H2O
2HNO2+(NH2)2CO=2N2+CO2+3H2O
2Mn(OH)2+O2=2MnO(OH)2
【例7】按要求完成下列问题:
4)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_____________________________________。
(5)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
①实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为
_____________________
②联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_____________________________ 。
题型三:氧化还原方程式的书写
2As2S3+5O2+6H2O=4H3AsO4+6S
NaClO+2NH3=NaCl+N2H4+H2O
固体逐渐变黑,并有气泡产生
【例8】(2022秋·广东广州·高一西关外国语学校校考期中)某体系中发生的一个反应,反应物和生成物共六种微粒:Fe3+、Mn2+、MnO4- 、H2O、Fe2+、H+,已知MnO4- 为其中一种反应物,下列说法正确的是
A.只有MnO4- 和Fe2+是反应物 B.被还原的元素是Fe
C.发生氧化反应的物质是MnO4- D.氧化剂与还原剂的个数比为1∶5
题型四:氧化还原基础概念与方程式书写综合考查
D
【例9】储氢碳纳米管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式□C+□( )+□H2SO4=□( )+□( )+□Cr2(SO4)3+□H2O:
_________________________________________________________。
(2)上述反应中氧化剂是________ (填化学式),被氧化的元素是_________(填元素符号)。
(3) H2SO4在上述反应中表现的性质是______(填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
题型四:氧化还原基础概念与方程式书写综合考查
K2Cr2O7
C
C
【例11】稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
题型四:氧化还原基础概念与方程式书写综合考查
资料:①铈(Ce)常见的化合价为+3和+4;
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
题型四:氧化还原基础概念与方程式书写综合考查
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式__________________________________________。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____________________________。
(3)步骤Ⅲ的操作名称是__________。
(4)步骤Ⅳ中加入H2O2的目的是______________。
(5)步骤Ⅴ中发生反应的离子方程式是____________________________________________________。
【例11】
Ce4+和Ce3+
分液
作为还原剂
知识导航
