2023秋高中化学人教版2019必修1 第一章 物质及其变化 素养提升 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第一章 物质及其变化 素养提升 课时同步练(含答案) |  | |
| 格式 | DOC | ||
| 文件大小 | 220.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 20:04:18 | ||
图片预览



文档简介
第一章 物质及其变化 素养提升
1. Na2CO3是一种重要的工业原料,广泛应用于建材、轻工、化工、冶金、纺织等工业部门和人们的日常生活中,堪称“化工之母”。根据物质的交叉分类法,Na2CO3不属于( )
A. 纯净物 B. 电解质
C. 碱 D. 钠盐
2. 下列常见物质的俗名或主要成分与化学式对应正确的是( )
A. 铁锈——Fe3O4 B. 小苏打——Na2SO4
C. 消石灰——Ca(OH)2 D. 生石灰——Ca(OH)2
3. 下列过程涉及化学变化的是( )
A. 百炼成钢 B. 碘的升华
C. 氨气液化 D. 滴水成冰
4. 宋朝苏东坡的《海棠》中有句描写雾的诗句——“车风缭绕泛崇光,香雾空蒙月转廊”。下列有关雾的说法正确的是( )
A. 雾是溶液,能永久在空气中稳定存在 B. 雾是胶体,一段时间内能稳定存在
C. 雾是乳浊液,不能稳定存在 D. 雾是悬浊液,在空气中能沉降
5. 将直径在1~100nm之间的食盐晶体超细粒子分散到酒精中,激光笔照射能看到丁达尔效应,所形成的分散系是( )
A. 溶液 B. 胶体
C. 悬浊液 D. 乳浊液
6. 下列方法最终能制得胶体的是( )
A. 把5~6滴饱和三氯化铁溶液滴入20 mL冷水中
B. 把5~6滴饱和三氯化铁溶液滴入20 mL沸水中,继续煮沸至液体呈红褐色
C. 把5~6滴饱和三氯化铁溶液滴入20 mL NaOH溶液中
D. 把5~6滴饱和三氯化铁溶液滴入20 mL酒精中
7. 在含有大量H+、Ba2+、Cl-的溶液中,还可能大量共存的离子是( )
A. Ag+ B. Ca2+
C. CO D. SO
8. 铝热反应可用于焊接钢轨,反应为2Al+Fe2O32Fe+Al2O3,下列关于该反应的说法正确的是( )
A. Al是还原剂 B. Fe2O3发生氧化反应
C. Fe是氧化产物 D. 当生成1个Fe时,转移6个电子
请阅读下列材料,回答9~10题。
氯气是一种有毒气体,颜色为黄绿色,具有强烈刺激性气味,能使人出现打喷嚏、咳嗽、流泪不止、窒息等症状。它主要通过呼吸道侵入人体并溶解在黏膜所含的水分中,生成次氯酸(HClO)和盐酸,造成呼吸道黏膜损伤。氯气中毒的明显症状是发生剧烈咳嗽。工业上常用管道输送氯气,管道工人经常用浓氨水检查输送氯气的管道是否漏气,反应的原理为3Cl2+2NH3===N2+6HCl、NH3+HCl===NH4Cl,总反应为3Cl2+8NH3===N2+6NH4Cl。若看到有白烟产生,说明输送氯气的管道发生泄漏。
9. 3Cl2+2NH3===N2+6HCl的反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
10. 有关3Cl2+8NH3===N2+6NH4Cl,下列说法错误的是( )
A. Cl2得电子 B. Cl2是氧化剂
C. NH3被还原 D. N2是氧化产物
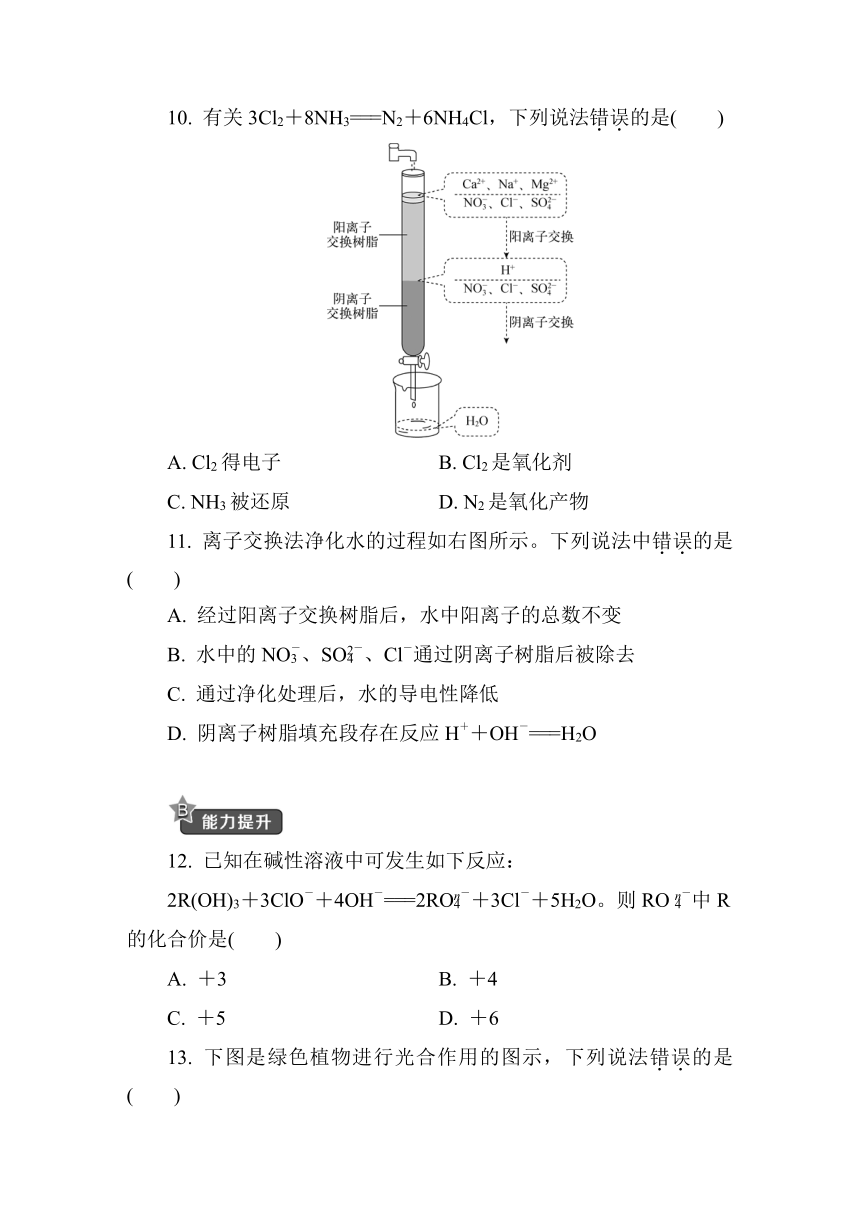
11. 离子交换法净化水的过程如右图所示。下列说法中错误的是( )
A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的NO、SO、Cl-通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH-===H2O
12. 已知在碱性溶液中可发生如下反应:
2R(OH)3+3ClO-+4OH-===2RO+3Cl-+5H2O。则RO中R的化合价是( )
A. +3 B. +4
C. +5 D. +6
13. 下图是绿色植物进行光合作用的图示,下列说法错误的是( )
A. 物质X是氧气
B. 绿色植物的光合作用属于氧化还原反应
C. C6H12O6不属于电解质
D. C6H12O6与X反应生成二氧化碳和水,属于置换反应
14. 书写离子方程式。
(1)NaHCO3溶液与H2SO4溶液混合: 。
(2)向澄清石灰水中通入少量二氧化碳: ________________________________。
(3)氢氧化亚铁和浓盐酸反应: __________________________________。
(4)醋酸溶液和碳酸镁悬浊液混合生成气体并得到澄清溶液:
______________________________________。
15. 下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40 mg/kg
储藏方法 密封、避光、防潮
食用方法 烹调时待食品熟后加入碘盐
请根据此表,结合中学学过的化学知识,回答下列问题。
(1) 根据物质分类中的树状分类法的有关知识,在① HIO3、② NaIO3、③ KOH、④ I2O5、⑤ NaCl五种________(填“混合物”“化合物”“盐”或“氧化物”)中,与碘酸钾(KIO3)属于同类物质的是________(填序号)。
(2) 推测碘酸钾(KIO3)的物理性质: 碘酸钾________ (填“能”或“不能”) 溶于水。推测其化学性质: 碘酸钾在受热时________。
16. (1)人们常用图示法表示不同反应类型之间的关系,如化合反应和氧化还原反应的关系可用图1表示。图2为离子反应、氧化还原反应和置换反应三者之间的关系,则表示置换反应的是________(填字母),请写出符合图2阴影部分的一个离子方程式:________________________________________________________________________。
(2)现有失去标签的四瓶无色溶液A、B、C、D,只知它们是K2CO3、K2SO4、NaHSO4和Ba(NO3)2,为鉴别它们,进行如下实验:
①A+D→溶液+气体 ②B+C→溶液+沉淀
③B+D→溶液+沉淀 ④A+B→溶液+沉淀
⑤将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。
根据以上实验事实,请完成如下问题:
写出各物质化学式:A________,B________,C________,D________。
写出实验③中反应的离子方程式:____________________________________。
17. 氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应为2Cu+===Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原的观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)CuH溶解在稀盐酸中生成的气体是________(填化学式)。
(3)氯气具有很强的氧化性,能将多数物质氧化到较高价态,试写出CuH在氯气中燃烧的化学方程式:______________________________。
答案与解析
第一章 素养提升
1.C [解析] Na2CO3是纯净物、电解质、钠盐,但不是碱,故选C。
2.C [解析] 铁锈的主要成分是Fe2O3,故A项错误;小苏打是NaHCO3的俗名,故B项错误;消石灰是Ca(OH)2的俗名,故C项正确;生石灰是CaO的俗名,故D项错误。
3.A [解析] A项,百炼成钢,铁中的C转化为CO2,有新物质生成,涉及化学变化;B项,碘的升华过程没有新物质生成,属于物理变化;C项,氨气液化,没有新物质生成,属于物理变化;D项,滴水成冰,没有新物质生成,属于物理变化。
4.B [解析] 雾是胶体,它是较稳定的分散系,但不能在空气中永久存在。
5.B [解析] 分散质粒子直径在1~100nm之间的分散系为胶体。
6.B [解析] 把5~6滴饱和三氯化铁溶液滴入20 mL冷水中,反应缓慢,不能得到胶体,A项错误;B项正确;把5~6滴饱和三氯化铁溶液滴入20 mL NaOH溶液中会生成Fe(OH)3沉淀,C项错误;把5~6滴饱和三氯化铁溶液滴入20 mL酒精中不能得到胶体,D项错误。
7.B [解析] Ag+与Cl-反应生成氯化银沉淀,在溶液中不能大量共存,故A项错误;Ca2+不与H+、Ba2+、Cl-反应,在溶液中能够大量共存,故B项正确;CO与H+、Ba2+发生反应,在溶液中不能大量共存,故C项错误;SO与Ba2+发生反应,在溶液中不能大量共存,故D项错误。
8.A [解析] Al失去电子被氧化,发生氧化反应,是还原剂,故A项正确;Fe2O3得电子,被还原,发生还原反应,故B项错误;Fe元素的化合价降低,被还原,Fe是还原产物,故C项错误;当生成1个Fe时,转移3个电子,故D项错误。
9.C 10.C
11.A [解析] 结合图示可知,经阳离子交换树脂后,水中的Ca2+、Na+、Mg2+被除去,水中阳离子为H+,且H+数目与原来的阳离子数目之和相比增多,A项错误;由图示可知水中的NO、SO、Cl-经阴离子交换树脂后被除去,B项正确;经过离子交换法处理后,水中阴离子和阳离子的浓度明显减小,水溶液的导电性降低,C项正确;进入阴离子交换树脂的H+转化为H2O,即在阴离子树脂填充段存在H+与OH-的反应,D项正确。
12.D [解析] 根据离子方程式两端电荷守恒可知3+4=2n+3,解得n=2,O元素显-2价,所以R的化合价是+6。
13.D [解析] 二氧化碳和水在叶绿素和光的作用下发生光合作用,生成葡萄糖和氧气,所以物质X为氧气,A项正确;二氧化碳和水在叶绿素和光的作用下发生光合作用,生成葡萄糖和氧气,有元素化合价的变化,所以绿色植物的光合作用属于氧化还原反应,B项正确;C6H12O6在水溶液里和熔融状态下均不能导电,不属于电解质,C项正确;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,而C6H12O6与O2反应生成CO2和H2O,生成物是两种化合物,所以C6H12O6与O2的反应不属于置换反应,D项错误。
14.(1)H++HCO===H2O+CO2↑ (2)Ca2++2OH-+CO2===CaCO3↓+H2O (3)Fe(OH)2+2H+===Fe2++2H2O (4)2CH3COOH+MgCO3===2CH3COO-+Mg2++CO2↑+H2O
15.(1) 化合物 ②⑤ (2) 能 易分解 [解析] (1) 五种物质均属于化合物。碘酸钾属于盐,其中属于盐的有②和⑤。 (2) 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品熟后加入碘盐”可知碘酸钾受热易分解。
16.(1)B Fe+Cu2+===Fe2++Cu(答案合理均可) (2)K2CO3 Ba(NO3)2 K2SO4 NaHSO4 SO+Ba2+===BaSO4↓ [解析] (1)所有的置换反应全是氧化还原反应,是被包含和包含的关系,故A是氧化还原反应,B是置换反应;符合图2阴影部分的离子方程式可以是Fe+Cu2+===Fe2++Cu等。 (2)B与A、C、D混合都有沉淀析出,则B为Ba(NO3)2。将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气味,则只有碳酸钡沉淀符合该要求,故A为K2CO3。结合①可知,D为NaHSO4,所以C为K2SO4。
17.(1)还原剂 (2)H2 (3)2CuH+3Cl22CuCl2+2HCl [解析] (1)由CuSO4+“另一物质”→CuH知,反应中铜元素价态降低,故“另一物质”是还原剂。 (2)CuH溶于稀盐酸时,氢元素会发生价态归中的氧化还原反应,生成氢气。 (3)CuH中铜、氢元素均处于低价态,与强氧化剂氯气反应时,均可被氧化而生成CuCl2、HCl,然后根据得失电子守恒和原子守恒配平化学方程式。
1. Na2CO3是一种重要的工业原料,广泛应用于建材、轻工、化工、冶金、纺织等工业部门和人们的日常生活中,堪称“化工之母”。根据物质的交叉分类法,Na2CO3不属于( )
A. 纯净物 B. 电解质
C. 碱 D. 钠盐
2. 下列常见物质的俗名或主要成分与化学式对应正确的是( )
A. 铁锈——Fe3O4 B. 小苏打——Na2SO4
C. 消石灰——Ca(OH)2 D. 生石灰——Ca(OH)2
3. 下列过程涉及化学变化的是( )
A. 百炼成钢 B. 碘的升华
C. 氨气液化 D. 滴水成冰
4. 宋朝苏东坡的《海棠》中有句描写雾的诗句——“车风缭绕泛崇光,香雾空蒙月转廊”。下列有关雾的说法正确的是( )
A. 雾是溶液,能永久在空气中稳定存在 B. 雾是胶体,一段时间内能稳定存在
C. 雾是乳浊液,不能稳定存在 D. 雾是悬浊液,在空气中能沉降
5. 将直径在1~100nm之间的食盐晶体超细粒子分散到酒精中,激光笔照射能看到丁达尔效应,所形成的分散系是( )
A. 溶液 B. 胶体
C. 悬浊液 D. 乳浊液
6. 下列方法最终能制得胶体的是( )
A. 把5~6滴饱和三氯化铁溶液滴入20 mL冷水中
B. 把5~6滴饱和三氯化铁溶液滴入20 mL沸水中,继续煮沸至液体呈红褐色
C. 把5~6滴饱和三氯化铁溶液滴入20 mL NaOH溶液中
D. 把5~6滴饱和三氯化铁溶液滴入20 mL酒精中
7. 在含有大量H+、Ba2+、Cl-的溶液中,还可能大量共存的离子是( )
A. Ag+ B. Ca2+
C. CO D. SO
8. 铝热反应可用于焊接钢轨,反应为2Al+Fe2O32Fe+Al2O3,下列关于该反应的说法正确的是( )
A. Al是还原剂 B. Fe2O3发生氧化反应
C. Fe是氧化产物 D. 当生成1个Fe时,转移6个电子
请阅读下列材料,回答9~10题。
氯气是一种有毒气体,颜色为黄绿色,具有强烈刺激性气味,能使人出现打喷嚏、咳嗽、流泪不止、窒息等症状。它主要通过呼吸道侵入人体并溶解在黏膜所含的水分中,生成次氯酸(HClO)和盐酸,造成呼吸道黏膜损伤。氯气中毒的明显症状是发生剧烈咳嗽。工业上常用管道输送氯气,管道工人经常用浓氨水检查输送氯气的管道是否漏气,反应的原理为3Cl2+2NH3===N2+6HCl、NH3+HCl===NH4Cl,总反应为3Cl2+8NH3===N2+6NH4Cl。若看到有白烟产生,说明输送氯气的管道发生泄漏。
9. 3Cl2+2NH3===N2+6HCl的反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
10. 有关3Cl2+8NH3===N2+6NH4Cl,下列说法错误的是( )
A. Cl2得电子 B. Cl2是氧化剂
C. NH3被还原 D. N2是氧化产物
11. 离子交换法净化水的过程如右图所示。下列说法中错误的是( )
A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的NO、SO、Cl-通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH-===H2O
12. 已知在碱性溶液中可发生如下反应:
2R(OH)3+3ClO-+4OH-===2RO+3Cl-+5H2O。则RO中R的化合价是( )
A. +3 B. +4
C. +5 D. +6
13. 下图是绿色植物进行光合作用的图示,下列说法错误的是( )
A. 物质X是氧气
B. 绿色植物的光合作用属于氧化还原反应
C. C6H12O6不属于电解质
D. C6H12O6与X反应生成二氧化碳和水,属于置换反应
14. 书写离子方程式。
(1)NaHCO3溶液与H2SO4溶液混合: 。
(2)向澄清石灰水中通入少量二氧化碳: ________________________________。
(3)氢氧化亚铁和浓盐酸反应: __________________________________。
(4)醋酸溶液和碳酸镁悬浊液混合生成气体并得到澄清溶液:
______________________________________。
15. 下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40 mg/kg
储藏方法 密封、避光、防潮
食用方法 烹调时待食品熟后加入碘盐
请根据此表,结合中学学过的化学知识,回答下列问题。
(1) 根据物质分类中的树状分类法的有关知识,在① HIO3、② NaIO3、③ KOH、④ I2O5、⑤ NaCl五种________(填“混合物”“化合物”“盐”或“氧化物”)中,与碘酸钾(KIO3)属于同类物质的是________(填序号)。
(2) 推测碘酸钾(KIO3)的物理性质: 碘酸钾________ (填“能”或“不能”) 溶于水。推测其化学性质: 碘酸钾在受热时________。
16. (1)人们常用图示法表示不同反应类型之间的关系,如化合反应和氧化还原反应的关系可用图1表示。图2为离子反应、氧化还原反应和置换反应三者之间的关系,则表示置换反应的是________(填字母),请写出符合图2阴影部分的一个离子方程式:________________________________________________________________________。
(2)现有失去标签的四瓶无色溶液A、B、C、D,只知它们是K2CO3、K2SO4、NaHSO4和Ba(NO3)2,为鉴别它们,进行如下实验:
①A+D→溶液+气体 ②B+C→溶液+沉淀
③B+D→溶液+沉淀 ④A+B→溶液+沉淀
⑤将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。
根据以上实验事实,请完成如下问题:
写出各物质化学式:A________,B________,C________,D________。
写出实验③中反应的离子方程式:____________________________________。
17. 氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应为2Cu+===Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原的观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)CuH溶解在稀盐酸中生成的气体是________(填化学式)。
(3)氯气具有很强的氧化性,能将多数物质氧化到较高价态,试写出CuH在氯气中燃烧的化学方程式:______________________________。
答案与解析
第一章 素养提升
1.C [解析] Na2CO3是纯净物、电解质、钠盐,但不是碱,故选C。
2.C [解析] 铁锈的主要成分是Fe2O3,故A项错误;小苏打是NaHCO3的俗名,故B项错误;消石灰是Ca(OH)2的俗名,故C项正确;生石灰是CaO的俗名,故D项错误。
3.A [解析] A项,百炼成钢,铁中的C转化为CO2,有新物质生成,涉及化学变化;B项,碘的升华过程没有新物质生成,属于物理变化;C项,氨气液化,没有新物质生成,属于物理变化;D项,滴水成冰,没有新物质生成,属于物理变化。
4.B [解析] 雾是胶体,它是较稳定的分散系,但不能在空气中永久存在。
5.B [解析] 分散质粒子直径在1~100nm之间的分散系为胶体。
6.B [解析] 把5~6滴饱和三氯化铁溶液滴入20 mL冷水中,反应缓慢,不能得到胶体,A项错误;B项正确;把5~6滴饱和三氯化铁溶液滴入20 mL NaOH溶液中会生成Fe(OH)3沉淀,C项错误;把5~6滴饱和三氯化铁溶液滴入20 mL酒精中不能得到胶体,D项错误。
7.B [解析] Ag+与Cl-反应生成氯化银沉淀,在溶液中不能大量共存,故A项错误;Ca2+不与H+、Ba2+、Cl-反应,在溶液中能够大量共存,故B项正确;CO与H+、Ba2+发生反应,在溶液中不能大量共存,故C项错误;SO与Ba2+发生反应,在溶液中不能大量共存,故D项错误。
8.A [解析] Al失去电子被氧化,发生氧化反应,是还原剂,故A项正确;Fe2O3得电子,被还原,发生还原反应,故B项错误;Fe元素的化合价降低,被还原,Fe是还原产物,故C项错误;当生成1个Fe时,转移3个电子,故D项错误。
9.C 10.C
11.A [解析] 结合图示可知,经阳离子交换树脂后,水中的Ca2+、Na+、Mg2+被除去,水中阳离子为H+,且H+数目与原来的阳离子数目之和相比增多,A项错误;由图示可知水中的NO、SO、Cl-经阴离子交换树脂后被除去,B项正确;经过离子交换法处理后,水中阴离子和阳离子的浓度明显减小,水溶液的导电性降低,C项正确;进入阴离子交换树脂的H+转化为H2O,即在阴离子树脂填充段存在H+与OH-的反应,D项正确。
12.D [解析] 根据离子方程式两端电荷守恒可知3+4=2n+3,解得n=2,O元素显-2价,所以R的化合价是+6。
13.D [解析] 二氧化碳和水在叶绿素和光的作用下发生光合作用,生成葡萄糖和氧气,所以物质X为氧气,A项正确;二氧化碳和水在叶绿素和光的作用下发生光合作用,生成葡萄糖和氧气,有元素化合价的变化,所以绿色植物的光合作用属于氧化还原反应,B项正确;C6H12O6在水溶液里和熔融状态下均不能导电,不属于电解质,C项正确;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,而C6H12O6与O2反应生成CO2和H2O,生成物是两种化合物,所以C6H12O6与O2的反应不属于置换反应,D项错误。
14.(1)H++HCO===H2O+CO2↑ (2)Ca2++2OH-+CO2===CaCO3↓+H2O (3)Fe(OH)2+2H+===Fe2++2H2O (4)2CH3COOH+MgCO3===2CH3COO-+Mg2++CO2↑+H2O
15.(1) 化合物 ②⑤ (2) 能 易分解 [解析] (1) 五种物质均属于化合物。碘酸钾属于盐,其中属于盐的有②和⑤。 (2) 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品熟后加入碘盐”可知碘酸钾受热易分解。
16.(1)B Fe+Cu2+===Fe2++Cu(答案合理均可) (2)K2CO3 Ba(NO3)2 K2SO4 NaHSO4 SO+Ba2+===BaSO4↓ [解析] (1)所有的置换反应全是氧化还原反应,是被包含和包含的关系,故A是氧化还原反应,B是置换反应;符合图2阴影部分的离子方程式可以是Fe+Cu2+===Fe2++Cu等。 (2)B与A、C、D混合都有沉淀析出,则B为Ba(NO3)2。将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气味,则只有碳酸钡沉淀符合该要求,故A为K2CO3。结合①可知,D为NaHSO4,所以C为K2SO4。
17.(1)还原剂 (2)H2 (3)2CuH+3Cl22CuCl2+2HCl [解析] (1)由CuSO4+“另一物质”→CuH知,反应中铜元素价态降低,故“另一物质”是还原剂。 (2)CuH溶于稀盐酸时,氢元素会发生价态归中的氧化还原反应,生成氢气。 (3)CuH中铜、氢元素均处于低价态,与强氧化剂氯气反应时,均可被氧化而生成CuCl2、HCl,然后根据得失电子守恒和原子守恒配平化学方程式。
