2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 第3节 第2课时 气体摩尔体积 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 第3节 第2课时 气体摩尔体积 课时同步练(含答案) |

|
|
| 格式 | DOC | ||
| 文件大小 | 130.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 21:19:13 | ||
图片预览



文档简介
第2课时 气体摩尔体积
1. 标准状况下,1mol O2的体积约为( )
A. 5.6L B. 11.2L
C. 22.4L D. 33.6L
2. 决定一定物质的量的气体体积大小的主要因素是( )
A. 气体分子的大小
B. 气体分子的质量
C. 气体分子间距离的大小
D. 气体分子的组成
3. 在相同的温度和压强下,下列气体密度最小的是( )
A. CO2 B. H2
C. O2 D. Cl2
4. 下列各组物质中,分子数一定相等的是( )
A. 28g CO和16g O2
B. 22.4L H2和22.4L N2
C. 常温下1 L HCl和1 L水
D. 标准状况下22.4L O2和常温下44g CO2
5. 下列叙述中正确的是( )
A. 标准状况下,1mol任何物质的体积都约为22.4L
B. 1mol任何气体所含分子数都相等,体积也都约为22.4L
C. 常温、常压下,锌与稀盐酸反应生成1mol H2时,消耗H+的数目为1.204×1024
D. 在同温、同压下,相同体积的任何气体单质所含原子数目相同
6. 在标准状况下,下列物质的体积最大的是( )
A. 2g H2 B. 22g CO2
C. 23g Na D. 16g O2
7. 下图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为( )
A. 22.0L/mol B. 22.4L/mol
C. 22.8L/mol D. 23.2L/mol
8. 下列判断正确的是( )
A. 46g NO2含有的氧原子数为2×6.02×1023
B. 常温、常压下,22.4L N2含有的分子数为6.02×1023
C. 17g NH3含有的原子总数为6.02×1023
D. 标准状况下,22.4L H2O含有的分子数目为6.02×1023
9. 常温、常压下,若用等质量的H2、He、O2、空气四种气体分别吹出四个气球,其中气体为H2的是( )
10. 下图两瓶体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是( )
A. 原子数相等 B. 密度相等
C. 质量相等 D. 摩尔质量相等
11. 下列各组物质中,分子数相同的是( )
A. 5L Cl2与5L HCl
B. 18g H2O与标准状况下44.8L CO2
C. 在25 ℃和1.01×105 Pa时,等体积的空气与H2
D. 0.1mol O2与标准状况下2.24L水
12. 标准状况下,5.6L O2的物质的量是________mol,其质量是________g。
13. 2.2g CO2的物质的量是________mol,在标准状况下的体积是________L,含有的分子个数是________,含有的原子个数是________。
14. 标准状况下,2g H2与16g O2的混合气体,其体积是________,密度是________。
15. 100mL气体A2与50mL气体B2恰好完全反应生成100mL气体C(体积均在相同条件下测定),则C的化学式为__________,推断的理由是________________________。
16. (1) 同温、同压下,等体积的氨气(NH3)和硫化氢(H2S)气体的质量比为__________。
(2) 等质量的氨气和硫化氢气体的体积比为________,其中含有的氢原子数目比为________。
(3) 若二者氢原子数相等,则同温、同压下它们的体积比为________。
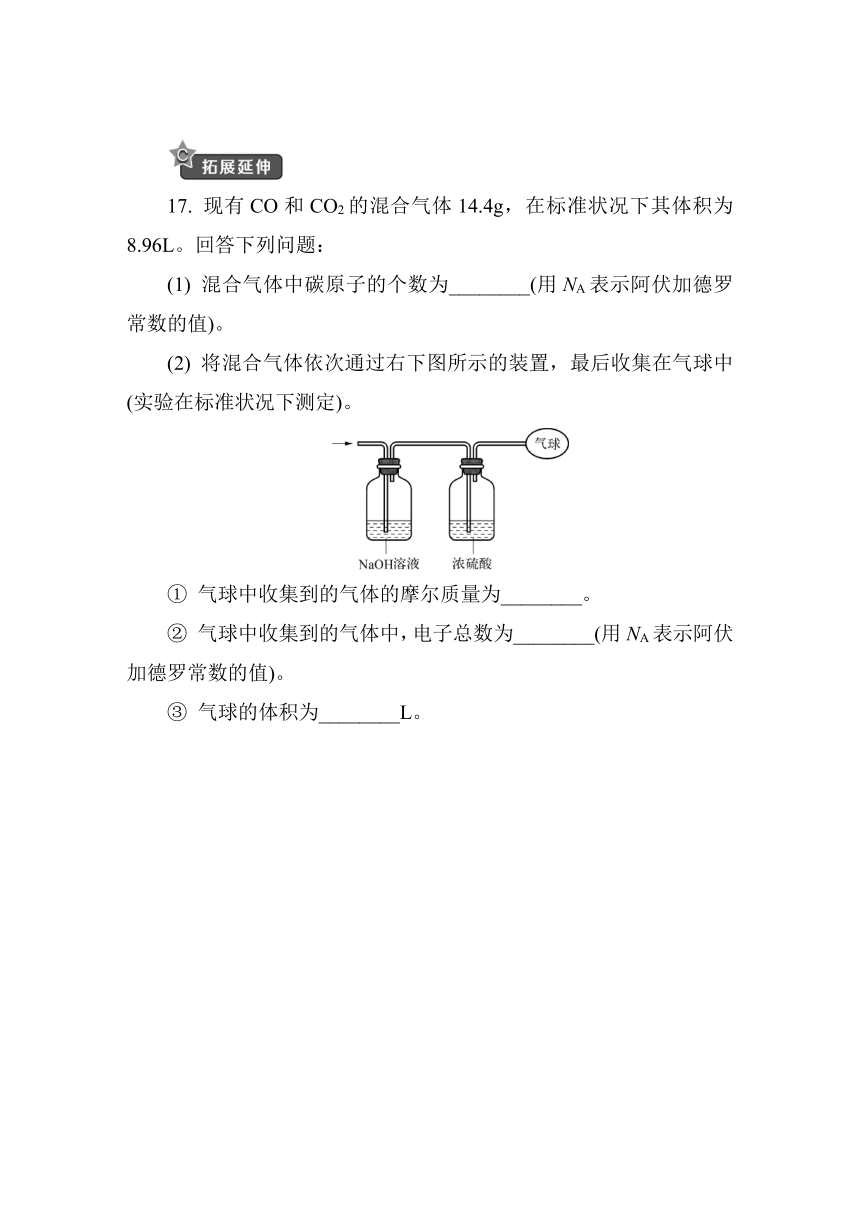
17. 现有CO和CO2的混合气体14.4g,在标准状况下其体积为8.96L。回答下列问题:
(1) 混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(2) 将混合气体依次通过右下图所示的装置,最后收集在气球中(实验在标准状况下测定)。
① 气球中收集到的气体的摩尔质量为________。
② 气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③ 气球的体积为________L。
答案与解析
第2课时 气体摩尔体积
1. C
2. C [解析] 由于气体分子间的距离是分子直径的10倍,所以对分子个数一定的气体来说,其体积主要由分子间距离决定。
3. B [解析] H2的摩尔质量最小。
4. D [解析] 气体物质的物质的量相同,则所含分子数相同。28g CO含CO分子1mol,16g O2含O2分子0.5mol,A项错误。相同温度、相同压强下,相同体积的气体含有相同的分子数,B项没有指明两种气体的体积是否在相同温度和相同压强下测定的,所以它们虽然体积相同,也不能确定它们所含的分子数相同,B项错误。常温下,HCl和水的状态不同,含有的分子数不相同,C项错误。标准状况下,22.4L O2含O2分子1mol,44g CO2在任何状况下均含CO2分子1mol,D项正确。
5. C [解析] 根据标准状况下气体摩尔体积的定义知,在使用时应注意: (1) 条件——标准状况;(2) 物质的聚集状态——气体,即指气体的体积,而不是固体或液体的体积。所以A、B两项均错。C项正确,物质的粒子数不受外界条件影响而变化,根据H原子守恒,1mol H2中含有2mol H原子,需要2mol HCl来提供,消耗H+的数目为1.204×1024。D项错误,气体单质分子,可以是单原子分子如He等稀有气体,也可以是双原子分子如H2等,还可以是多原子分子如臭氧(O3)等,在相同温度和压强下,相同体积的任何气体含有的分子数相同,但所含的原子数不一定相同。
6. A [解析] 2g H2和23g Na的物质的量都为1mol,其余都小于1mol。而在标准状况下,Na为固体。
7. C [解析] 27.2g H2S的物质的量为=0.8mol,则0.8mol×Vm=18.24L,解得Vm=22.8L/mol。
8. A [解析] 46g NO2即1mol NO2,含2mol O原子,故A项正确;气体处于非标准状况下,22.4L气体的分子数不为1mol,故B项错误;17g NH3的物质的量为1mol,含有的原子总数为4mol,C项错误;标准状况下,水为液体,D项错误。
9. D [解析] 等质量的H2、He、O2、空气四种气体,摩尔质量越小,气体的物质的量越大。在常温、常压下,物质的量越大的气体体积越大。H2的摩尔质量最小,所以它的物质的量最大,因此气球体积最大。
10. A [解析] 由同温、同压可得Vm相同,再由公式n=可得两瓶内气体分子的物质的量相等,又都是双原子分子,所以原子的物质的量相等,由个数之比等于物质的量之比可得两瓶内分子所含原子数相等,A项正确;两瓶内气体分子的物质的量相等,由m=nM,M不一定相等,故m不一定相等,同时由ρ=可得ρ不一定相等,B、C、D项错误。
11. C [解析] A项,缺少温度和压强的条件,虽然体积相同,但是分子数不一定相同,错误;B项,18g H2O为1 mol,标准状况下44.8L CO2的物质的量为2mol,两者所含分子数不同;C项,同温、同压下,等体积的气体含有相同的分子数;D项,标准状况下,水是液体,密度约为1g/cm3,2.24L水的质量约为2240g,远大于0.1mol,错误。
12. 0.25 8 [解析] n(O2)==0.25mol, m(O2)=0.25mol×32g/mol=8g。
13. 0.05 1.12 3.01×1022 9.03×1022 [解析] n(CO2)==0.05mol, V(CO2)=0.05mol×22.4L/mol=1.12L, N(CO2)=0.05mol×6.02×1023 mol-1=3.01×1022,0.05mol CO2中含原子个数=3×3.01×1022=9.03×1022。
14. 33.6L 0.536g/L [解析] n(混合气体)=+=1.5mol, V=1.5mol×22.4L/mol=33.6L, ρ=≈0.536g/L。
15. A2B 阿伏加德罗定律和质量守恒定律 [解析] 根据阿伏加德罗定律推知,在相同条件下,参加反应的气体和生成的气体体积比等于其分子数之比,V(A2)∶V(B2)∶V(C)=100∶50∶100=2∶1∶2,可以写出化学方程式2A2+B2===2C,再根据质量守恒定律可知,C分子的化学式为A2B。
16. (1) 1∶2 (2) 2∶1 3∶1 (3) 2∶3 [解析] (1) 同温、同压下,等体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等,故质量比为17∶34=1∶2。(2) 等质量的NH3和H2S气体的物质的量之比为∶=2∶1,氢原子数目之比为(2×3)∶(1×2)=3∶1。(3) 二者氢原子数相等时,物质的量之比为∶=2∶3,故同温、同压下体积之比为2∶3。
17. (1) 0.4NA (2) ① 28g/mol ② 2.8NA ③ 4.48 [解析] (1) 混合气体的物质的量==0.4mol,则碳原子为0.4mol,即0.4NA。 (2) ① 将混合气体依次通过NaOH溶液(吸收CO2)和浓硫酸,则最后收集到的气体是CO。② 设原混合气体中CO的物质的量为n1,CO2的物质的量为n2。则解得n1=0.2mol, n2=0.2mol。因此气球中收集到0.2mol CO,含有2.8mol电子。③ 0.2mol CO在标准状况下的体积为4.48L。
1. 标准状况下,1mol O2的体积约为( )
A. 5.6L B. 11.2L
C. 22.4L D. 33.6L
2. 决定一定物质的量的气体体积大小的主要因素是( )
A. 气体分子的大小
B. 气体分子的质量
C. 气体分子间距离的大小
D. 气体分子的组成
3. 在相同的温度和压强下,下列气体密度最小的是( )
A. CO2 B. H2
C. O2 D. Cl2
4. 下列各组物质中,分子数一定相等的是( )
A. 28g CO和16g O2
B. 22.4L H2和22.4L N2
C. 常温下1 L HCl和1 L水
D. 标准状况下22.4L O2和常温下44g CO2
5. 下列叙述中正确的是( )
A. 标准状况下,1mol任何物质的体积都约为22.4L
B. 1mol任何气体所含分子数都相等,体积也都约为22.4L
C. 常温、常压下,锌与稀盐酸反应生成1mol H2时,消耗H+的数目为1.204×1024
D. 在同温、同压下,相同体积的任何气体单质所含原子数目相同
6. 在标准状况下,下列物质的体积最大的是( )
A. 2g H2 B. 22g CO2
C. 23g Na D. 16g O2
7. 下图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为( )
A. 22.0L/mol B. 22.4L/mol
C. 22.8L/mol D. 23.2L/mol
8. 下列判断正确的是( )
A. 46g NO2含有的氧原子数为2×6.02×1023
B. 常温、常压下,22.4L N2含有的分子数为6.02×1023
C. 17g NH3含有的原子总数为6.02×1023
D. 标准状况下,22.4L H2O含有的分子数目为6.02×1023
9. 常温、常压下,若用等质量的H2、He、O2、空气四种气体分别吹出四个气球,其中气体为H2的是( )
10. 下图两瓶体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是( )
A. 原子数相等 B. 密度相等
C. 质量相等 D. 摩尔质量相等
11. 下列各组物质中,分子数相同的是( )
A. 5L Cl2与5L HCl
B. 18g H2O与标准状况下44.8L CO2
C. 在25 ℃和1.01×105 Pa时,等体积的空气与H2
D. 0.1mol O2与标准状况下2.24L水
12. 标准状况下,5.6L O2的物质的量是________mol,其质量是________g。
13. 2.2g CO2的物质的量是________mol,在标准状况下的体积是________L,含有的分子个数是________,含有的原子个数是________。
14. 标准状况下,2g H2与16g O2的混合气体,其体积是________,密度是________。
15. 100mL气体A2与50mL气体B2恰好完全反应生成100mL气体C(体积均在相同条件下测定),则C的化学式为__________,推断的理由是________________________。
16. (1) 同温、同压下,等体积的氨气(NH3)和硫化氢(H2S)气体的质量比为__________。
(2) 等质量的氨气和硫化氢气体的体积比为________,其中含有的氢原子数目比为________。
(3) 若二者氢原子数相等,则同温、同压下它们的体积比为________。
17. 现有CO和CO2的混合气体14.4g,在标准状况下其体积为8.96L。回答下列问题:
(1) 混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(2) 将混合气体依次通过右下图所示的装置,最后收集在气球中(实验在标准状况下测定)。
① 气球中收集到的气体的摩尔质量为________。
② 气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③ 气球的体积为________L。
答案与解析
第2课时 气体摩尔体积
1. C
2. C [解析] 由于气体分子间的距离是分子直径的10倍,所以对分子个数一定的气体来说,其体积主要由分子间距离决定。
3. B [解析] H2的摩尔质量最小。
4. D [解析] 气体物质的物质的量相同,则所含分子数相同。28g CO含CO分子1mol,16g O2含O2分子0.5mol,A项错误。相同温度、相同压强下,相同体积的气体含有相同的分子数,B项没有指明两种气体的体积是否在相同温度和相同压强下测定的,所以它们虽然体积相同,也不能确定它们所含的分子数相同,B项错误。常温下,HCl和水的状态不同,含有的分子数不相同,C项错误。标准状况下,22.4L O2含O2分子1mol,44g CO2在任何状况下均含CO2分子1mol,D项正确。
5. C [解析] 根据标准状况下气体摩尔体积的定义知,在使用时应注意: (1) 条件——标准状况;(2) 物质的聚集状态——气体,即指气体的体积,而不是固体或液体的体积。所以A、B两项均错。C项正确,物质的粒子数不受外界条件影响而变化,根据H原子守恒,1mol H2中含有2mol H原子,需要2mol HCl来提供,消耗H+的数目为1.204×1024。D项错误,气体单质分子,可以是单原子分子如He等稀有气体,也可以是双原子分子如H2等,还可以是多原子分子如臭氧(O3)等,在相同温度和压强下,相同体积的任何气体含有的分子数相同,但所含的原子数不一定相同。
6. A [解析] 2g H2和23g Na的物质的量都为1mol,其余都小于1mol。而在标准状况下,Na为固体。
7. C [解析] 27.2g H2S的物质的量为=0.8mol,则0.8mol×Vm=18.24L,解得Vm=22.8L/mol。
8. A [解析] 46g NO2即1mol NO2,含2mol O原子,故A项正确;气体处于非标准状况下,22.4L气体的分子数不为1mol,故B项错误;17g NH3的物质的量为1mol,含有的原子总数为4mol,C项错误;标准状况下,水为液体,D项错误。
9. D [解析] 等质量的H2、He、O2、空气四种气体,摩尔质量越小,气体的物质的量越大。在常温、常压下,物质的量越大的气体体积越大。H2的摩尔质量最小,所以它的物质的量最大,因此气球体积最大。
10. A [解析] 由同温、同压可得Vm相同,再由公式n=可得两瓶内气体分子的物质的量相等,又都是双原子分子,所以原子的物质的量相等,由个数之比等于物质的量之比可得两瓶内分子所含原子数相等,A项正确;两瓶内气体分子的物质的量相等,由m=nM,M不一定相等,故m不一定相等,同时由ρ=可得ρ不一定相等,B、C、D项错误。
11. C [解析] A项,缺少温度和压强的条件,虽然体积相同,但是分子数不一定相同,错误;B项,18g H2O为1 mol,标准状况下44.8L CO2的物质的量为2mol,两者所含分子数不同;C项,同温、同压下,等体积的气体含有相同的分子数;D项,标准状况下,水是液体,密度约为1g/cm3,2.24L水的质量约为2240g,远大于0.1mol,错误。
12. 0.25 8 [解析] n(O2)==0.25mol, m(O2)=0.25mol×32g/mol=8g。
13. 0.05 1.12 3.01×1022 9.03×1022 [解析] n(CO2)==0.05mol, V(CO2)=0.05mol×22.4L/mol=1.12L, N(CO2)=0.05mol×6.02×1023 mol-1=3.01×1022,0.05mol CO2中含原子个数=3×3.01×1022=9.03×1022。
14. 33.6L 0.536g/L [解析] n(混合气体)=+=1.5mol, V=1.5mol×22.4L/mol=33.6L, ρ=≈0.536g/L。
15. A2B 阿伏加德罗定律和质量守恒定律 [解析] 根据阿伏加德罗定律推知,在相同条件下,参加反应的气体和生成的气体体积比等于其分子数之比,V(A2)∶V(B2)∶V(C)=100∶50∶100=2∶1∶2,可以写出化学方程式2A2+B2===2C,再根据质量守恒定律可知,C分子的化学式为A2B。
16. (1) 1∶2 (2) 2∶1 3∶1 (3) 2∶3 [解析] (1) 同温、同压下,等体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等,故质量比为17∶34=1∶2。(2) 等质量的NH3和H2S气体的物质的量之比为∶=2∶1,氢原子数目之比为(2×3)∶(1×2)=3∶1。(3) 二者氢原子数相等时,物质的量之比为∶=2∶3,故同温、同压下体积之比为2∶3。
17. (1) 0.4NA (2) ① 28g/mol ② 2.8NA ③ 4.48 [解析] (1) 混合气体的物质的量==0.4mol,则碳原子为0.4mol,即0.4NA。 (2) ① 将混合气体依次通过NaOH溶液(吸收CO2)和浓硫酸,则最后收集到的气体是CO。② 设原混合气体中CO的物质的量为n1,CO2的物质的量为n2。则解得n1=0.2mol, n2=0.2mol。因此气球中收集到0.2mol CO,含有2.8mol电子。③ 0.2mol CO在标准状况下的体积为4.48L。
