2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 第3节 第4课时 一定物质的量浓度溶液的配制 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 第3节 第4课时 一定物质的量浓度溶液的配制 课时同步练(含答案) |

|
|
| 格式 | DOC | ||
| 文件大小 | 311.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 00:00:00 | ||
图片预览


文档简介
第4课时 一定物质的量浓度溶液的配制
1. 在容量瓶的使用方法中,下列操作正确的是( )
A. 使用容量瓶前一定要检查它是否漏水
B. 容量瓶用蒸馏水洗净后,配制溶液前需要干燥
C. 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处,用滴管加蒸馏水到刻度线
D. 配制好的溶液可长期存放在容量瓶中
2. 要用1.06g Na2CO3配制成0.2mol/L的Na2CO3溶液,必须选用的仪器是( )
A. 20mL量筒 B. 20mL容量瓶
C. 50mL量筒 D. 50mL容量瓶
3. 实验中需2mol/L Na2CO3溶液950mL,配制时选用的容量瓶的规格和需称取Na2CO3的质量分别为( )
A. 1000mL, 212g B. 950mL, 201.4g
C. 500mL, 296g D. 任意规格,572g
4. 将30mL 0.5mol/L NaOH溶液加水稀释到500mL,稀释后的溶液中NaOH的物质的量浓度为( )
A. 0.3mol/L B. 0.05mol/L
C. 0.03mol/L D. 0.02mol/L
5. 实验室配制500mL 0.2mol/L Na2SO4溶液,实验操作步骤有:
A. 用天平称取14.2g硫酸钠固体,放在烧杯中,用适量蒸馏水使它完全溶解并冷却至室温。
B. 把制得的溶液小心转移至容量瓶中。
C. 继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至凹液面与刻度线相切。
D. 用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E. 将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1) 操作步骤的正确顺序为____________(填字母)。
(2) 本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、玻璃棒,还缺少的仪器是________、________________、________________。
(3) 下列情况会使所配溶液浓度偏高的是________(填字母)。
a. 某同学观察液面的情况如右图所示 b. 没有进行上述操作步骤D
c. 加蒸馏水时,不慎超过了刻度线 d. 砝码上沾有杂质
e. 容量瓶使用前内壁沾有水珠
6. 某10% NaOH溶液,加热蒸发掉100g水后得到80mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A. 6.25mol/L B. 12.5mol/L
C. 7mol/L D. 7.5mol/L
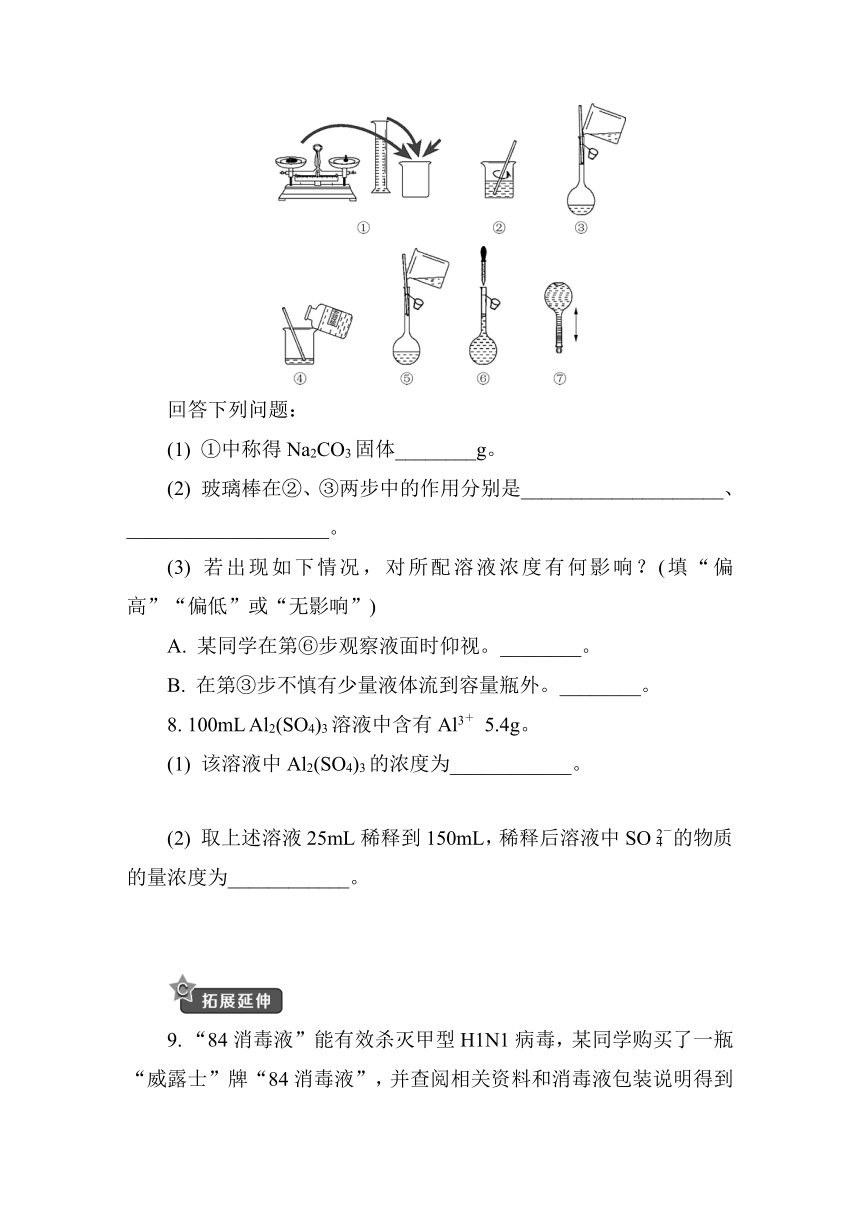
7. 下面为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。
回答下列问题:
(1) ①中称得Na2CO3固体________g。
(2) 玻璃棒在②、③两步中的作用分别是____________________、____________________。
(3) 若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A. 某同学在第⑥步观察液面时仰视。________。
B. 在第③步不慎有少量液体流到容量瓶外。________。
8. 100mL Al2(SO4)3溶液中含有Al3+ 5.4g。
(1) 该溶液中Al2(SO4)3的浓度为____________。
(2) 取上述溶液25mL稀释到150mL,稀释后溶液中SO的物质的量浓度为____________。
9. “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”: 含25% NaClO、1 000 mL、密度为1.192 g/cm3,稀释至100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题。
(1) 该“84消毒液”的物质的量浓度为________mol/L。
(2) 该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol/L。
(3) 一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知: CO2+NaClO+H2O===NaHCO3+HClO)
(4) 该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________(填字母)。
A. 如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B. 利用购买的商品NaClO来配制可能导致结果偏低
C. 需要称量NaClO固体的质量为143 g
D. 定容摇匀后发现液面低于刻度线,要继续加水至与刻度线平齐
答案与解析
第4课时 一定物质的量浓度溶液的配制
1. A
2. D [解析] 配制一定体积、一定物质的量浓度的溶液时,必须选用对应体积的容量瓶。n(Na2CO3)==0.01mol, V===0.05L=50mL。
3. A [解析] 容量瓶的规格有10mL、 50mL、 100mL、 250mL、 500mL、 1000mL等,而无950mL容量瓶,必须按1000mL溶液去配制,并计算出配制1000mL溶液所需的溶质的质量。
4. C [解析] 根据稀释前后溶质的物质的量不变进行计算,c1V1=c2V2, 0.5mol/L×30mL=c2×500mL, c2=0.03mol/L。
5. (1) ABDCE (2) 量筒 胶头滴管 500mL容量瓶 (3) ad [解析] (3) 根据c==进行判断。a. 俯视使V减小,故使c偏高;b. 未进行洗涤,使n减小,故使c偏低;c. V增大,故使c偏低;d. m增大,故使c偏高;e. 无影响。
6. A [解析] 根据蒸发过程中溶质的质量不变可以计算溶质的物质的量。设蒸发后的溶液质量为x,依题意得(x+100g)×10%=x×20%,解得x=100g。所以80mL溶液中含有的溶质质量为100g×20%=20g,因此溶质的物质的量为=0.5mol。所以该溶液的物质的量浓度为=6.25mol/L。
7. (1) 5.3 (2) 搅拌,加速溶解 引流 (3) 偏低 偏低 [解析] (1) 配制250 mL 0.2 mol/L Na2CO3溶液,需要Na2CO3的质量为0.25 L×0.2 mol/L×106 g/mol=5.3 g。 (2) 在溶解固体时,使用玻璃棒搅拌,可以加速溶解;转移溶液时玻璃棒起引流作用。 (3) 某同学在第⑥步观察液面时仰视,导致溶液的体积偏大,所得溶液浓度偏低;在步骤③中不慎有少量液体流到容量瓶外,导致溶质的物质的量偏小,浓度偏低。
8. (1) 1.0mol/L (2) 0.5mol/L [解析] (1) n(Al3+)==0.2mol, Al2(SO4)3===2Al3++3SO, n[Al2(SO4)3]=n(Al3+)=×0.2mol=0.1mol, c[Al2(SO4)3]===1.0mol/L。(2) 原溶液中c1(SO)=3c[Al2(SO4)3]=1.0 mol/L×3=3 mol/L,取出25mL溶液稀释到150mL后,根据稀释公式c1V1=c2V2, 3mol/L×25mL=c2(SO)×150mL, c2(SO)=0.5mol/L。
9. (1) 4 (2) 0.04 (3) 89.6 (4) B [解析] (1) 根据c=,则c(NaClO)= mol/L=4 mol/L。 (2) 根据稀释前后溶质的物质的量不变,则100 mL×4.0 mol/L=10 000 mL×c(NaClO),解得c(NaClO)=0.04 mol/L,c(Na+)=c(NaClO)=0.04 mol/L。 (3) 一瓶“84消毒液”含有n(NaClO)=1 L×4 mol/L=4 mol,根据反应CO2+NaClO+H2O===NaHCO3+HClO,可知需要CO2的物质的量n(CO2)=4 mol,则标准状况下V(CO2)=4 mol×22.4 L/mol=89.6 L。 (4) 需用托盘天平称量NaClO固体,用烧杯溶解NaClO固体,用玻璃棒进行搅拌和引流,用容量瓶和胶头滴管定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,A项错误;由于NaClO易吸收空气中的H2O、CO2而变质,所以购买的商品NaClO可能部分变质,导致配制的溶液中溶质的物质的量减小,结果偏低,B项正确;应选取500 mL的容量瓶进行配制,所以需称量NaClO的质量为0.5 L×4 mol/L×74.5 g/mol=149 g,C项错误;D项的操作会使所配溶液浓度偏低,错误。
1. 在容量瓶的使用方法中,下列操作正确的是( )
A. 使用容量瓶前一定要检查它是否漏水
B. 容量瓶用蒸馏水洗净后,配制溶液前需要干燥
C. 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处,用滴管加蒸馏水到刻度线
D. 配制好的溶液可长期存放在容量瓶中
2. 要用1.06g Na2CO3配制成0.2mol/L的Na2CO3溶液,必须选用的仪器是( )
A. 20mL量筒 B. 20mL容量瓶
C. 50mL量筒 D. 50mL容量瓶
3. 实验中需2mol/L Na2CO3溶液950mL,配制时选用的容量瓶的规格和需称取Na2CO3的质量分别为( )
A. 1000mL, 212g B. 950mL, 201.4g
C. 500mL, 296g D. 任意规格,572g
4. 将30mL 0.5mol/L NaOH溶液加水稀释到500mL,稀释后的溶液中NaOH的物质的量浓度为( )
A. 0.3mol/L B. 0.05mol/L
C. 0.03mol/L D. 0.02mol/L
5. 实验室配制500mL 0.2mol/L Na2SO4溶液,实验操作步骤有:
A. 用天平称取14.2g硫酸钠固体,放在烧杯中,用适量蒸馏水使它完全溶解并冷却至室温。
B. 把制得的溶液小心转移至容量瓶中。
C. 继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至凹液面与刻度线相切。
D. 用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E. 将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1) 操作步骤的正确顺序为____________(填字母)。
(2) 本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、玻璃棒,还缺少的仪器是________、________________、________________。
(3) 下列情况会使所配溶液浓度偏高的是________(填字母)。
a. 某同学观察液面的情况如右图所示 b. 没有进行上述操作步骤D
c. 加蒸馏水时,不慎超过了刻度线 d. 砝码上沾有杂质
e. 容量瓶使用前内壁沾有水珠
6. 某10% NaOH溶液,加热蒸发掉100g水后得到80mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A. 6.25mol/L B. 12.5mol/L
C. 7mol/L D. 7.5mol/L
7. 下面为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。
回答下列问题:
(1) ①中称得Na2CO3固体________g。
(2) 玻璃棒在②、③两步中的作用分别是____________________、____________________。
(3) 若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A. 某同学在第⑥步观察液面时仰视。________。
B. 在第③步不慎有少量液体流到容量瓶外。________。
8. 100mL Al2(SO4)3溶液中含有Al3+ 5.4g。
(1) 该溶液中Al2(SO4)3的浓度为____________。
(2) 取上述溶液25mL稀释到150mL,稀释后溶液中SO的物质的量浓度为____________。
9. “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”: 含25% NaClO、1 000 mL、密度为1.192 g/cm3,稀释至100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题。
(1) 该“84消毒液”的物质的量浓度为________mol/L。
(2) 该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol/L。
(3) 一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知: CO2+NaClO+H2O===NaHCO3+HClO)
(4) 该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________(填字母)。
A. 如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B. 利用购买的商品NaClO来配制可能导致结果偏低
C. 需要称量NaClO固体的质量为143 g
D. 定容摇匀后发现液面低于刻度线,要继续加水至与刻度线平齐
答案与解析
第4课时 一定物质的量浓度溶液的配制
1. A
2. D [解析] 配制一定体积、一定物质的量浓度的溶液时,必须选用对应体积的容量瓶。n(Na2CO3)==0.01mol, V===0.05L=50mL。
3. A [解析] 容量瓶的规格有10mL、 50mL、 100mL、 250mL、 500mL、 1000mL等,而无950mL容量瓶,必须按1000mL溶液去配制,并计算出配制1000mL溶液所需的溶质的质量。
4. C [解析] 根据稀释前后溶质的物质的量不变进行计算,c1V1=c2V2, 0.5mol/L×30mL=c2×500mL, c2=0.03mol/L。
5. (1) ABDCE (2) 量筒 胶头滴管 500mL容量瓶 (3) ad [解析] (3) 根据c==进行判断。a. 俯视使V减小,故使c偏高;b. 未进行洗涤,使n减小,故使c偏低;c. V增大,故使c偏低;d. m增大,故使c偏高;e. 无影响。
6. A [解析] 根据蒸发过程中溶质的质量不变可以计算溶质的物质的量。设蒸发后的溶液质量为x,依题意得(x+100g)×10%=x×20%,解得x=100g。所以80mL溶液中含有的溶质质量为100g×20%=20g,因此溶质的物质的量为=0.5mol。所以该溶液的物质的量浓度为=6.25mol/L。
7. (1) 5.3 (2) 搅拌,加速溶解 引流 (3) 偏低 偏低 [解析] (1) 配制250 mL 0.2 mol/L Na2CO3溶液,需要Na2CO3的质量为0.25 L×0.2 mol/L×106 g/mol=5.3 g。 (2) 在溶解固体时,使用玻璃棒搅拌,可以加速溶解;转移溶液时玻璃棒起引流作用。 (3) 某同学在第⑥步观察液面时仰视,导致溶液的体积偏大,所得溶液浓度偏低;在步骤③中不慎有少量液体流到容量瓶外,导致溶质的物质的量偏小,浓度偏低。
8. (1) 1.0mol/L (2) 0.5mol/L [解析] (1) n(Al3+)==0.2mol, Al2(SO4)3===2Al3++3SO, n[Al2(SO4)3]=n(Al3+)=×0.2mol=0.1mol, c[Al2(SO4)3]===1.0mol/L。(2) 原溶液中c1(SO)=3c[Al2(SO4)3]=1.0 mol/L×3=3 mol/L,取出25mL溶液稀释到150mL后,根据稀释公式c1V1=c2V2, 3mol/L×25mL=c2(SO)×150mL, c2(SO)=0.5mol/L。
9. (1) 4 (2) 0.04 (3) 89.6 (4) B [解析] (1) 根据c=,则c(NaClO)= mol/L=4 mol/L。 (2) 根据稀释前后溶质的物质的量不变,则100 mL×4.0 mol/L=10 000 mL×c(NaClO),解得c(NaClO)=0.04 mol/L,c(Na+)=c(NaClO)=0.04 mol/L。 (3) 一瓶“84消毒液”含有n(NaClO)=1 L×4 mol/L=4 mol,根据反应CO2+NaClO+H2O===NaHCO3+HClO,可知需要CO2的物质的量n(CO2)=4 mol,则标准状况下V(CO2)=4 mol×22.4 L/mol=89.6 L。 (4) 需用托盘天平称量NaClO固体,用烧杯溶解NaClO固体,用玻璃棒进行搅拌和引流,用容量瓶和胶头滴管定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,A项错误;由于NaClO易吸收空气中的H2O、CO2而变质,所以购买的商品NaClO可能部分变质,导致配制的溶液中溶质的物质的量减小,结果偏低,B项正确;应选取500 mL的容量瓶进行配制,所以需称量NaClO的质量为0.5 L×4 mol/L×74.5 g/mol=149 g,C项错误;D项的操作会使所配溶液浓度偏低,错误。
