2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 复习 素养提升 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 复习 素养提升 课时同步练(含答案) |  | |
| 格式 | DOC | ||
| 文件大小 | 276.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 21:35:44 | ||
图片预览



文档简介
第二章 海水中的重要元素—钠和氯复习 素养提升
1. 金属钠着火时,可用来灭火的是( )
A. 泡沫灭火器 B. 水
C. 沙子 D. 干粉灭火器
2. 下列有关焰色反应的说法中,正确的是( )
A. 焰色反应只是金属单质灼烧时出现的现象
B. 焰色反应是伴随化学变化而产生的
C. 焰色反应观察到黄色火焰并不能确定该物质一定不含钾元素
D. 洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸
3. 向含有HCO、CO、NO、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减小的是( )
A. HCO B. CO
C. NO D. Na+
4. 将20mL 0.5mol/L盐酸加水稀释到500mL,稀释后从中取10mL,则取出的盐酸中HCl的物质的量浓度为( )
A. 0.002mol/L B. 0.02mol/L
C. 0.05mol/L D. 0.04mol/L
5. 下列关于钠的化合物的叙述中,不正确的是( )
A. 热稳定性: Na2CO3>NaHCO3 B. Na2O和Na2O2中阴离子是同种微粒
C. 碳酸氢钠可用于治疗胃酸过多 D. Na2O2中氧的化合价为-1
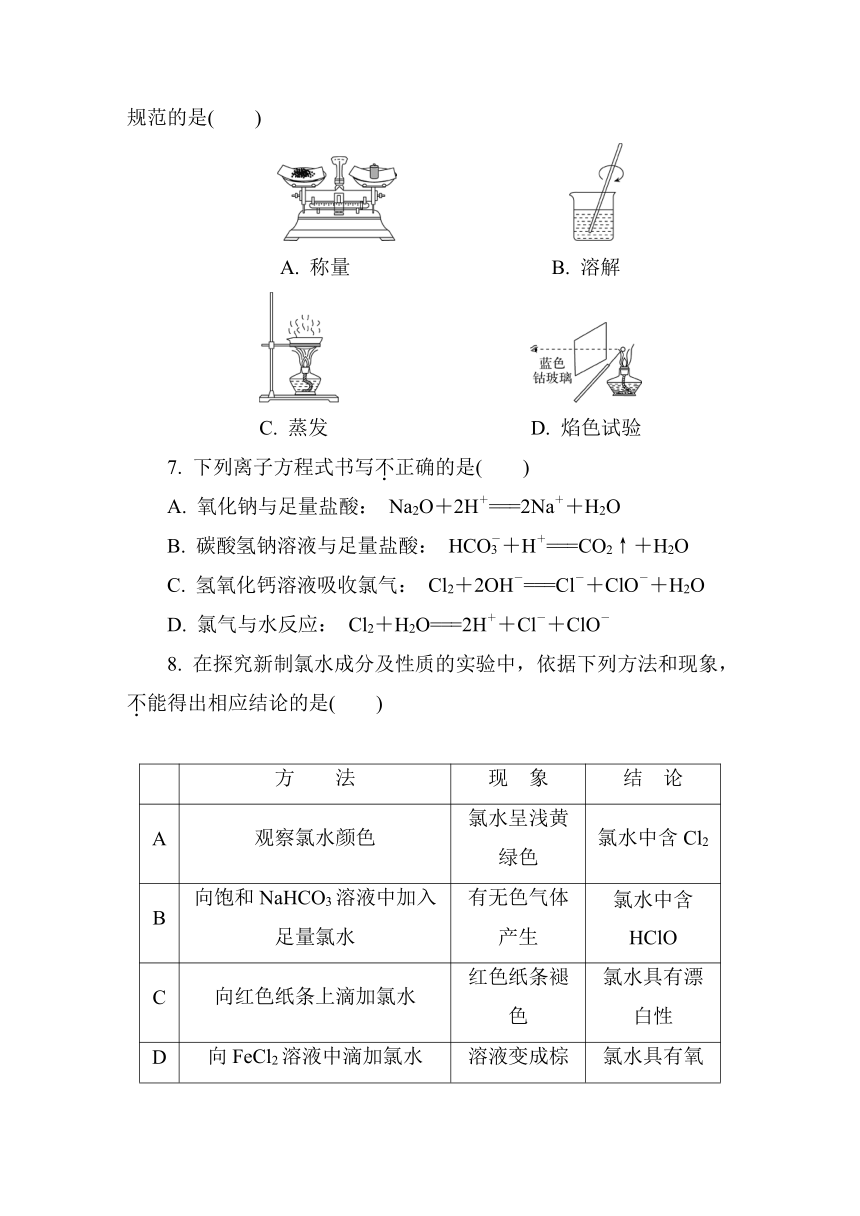
6. 粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色试验等操作。下列图示对应的操作不规范的是( )
A. 称量 B. 溶解
C. 蒸发 D. 焰色试验
7. 下列离子方程式书写不正确的是( )
A. 氧化钠与足量盐酸: Na2O+2H+===2Na++H2O
B. 碳酸氢钠溶液与足量盐酸: HCO+H+===CO2↑+H2O
C. 氢氧化钙溶液吸收氯气: Cl2+2OH-===Cl-+ClO-+H2O
D. 氯气与水反应: Cl2+H2O===2H++Cl-+ClO-
8. 在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
方 法 现 象 结 论
A 观察氯水颜色 氯水呈浅黄绿色 氯水中含Cl2
B 向饱和NaHCO3溶液中加入足量氯水 有无色气体产生 氯水中含HClO
C 向红色纸条上滴加氯水 红色纸条褪色 氯水具有漂白性
D 向FeCl2溶液中滴加氯水 溶液变成棕黄色 氯水具有氧化性
9. 碳酸氢钠受热容易分解为碳酸钠。现加热碳酸钠和碳酸氢钠的混合物5.00g,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为( )
A. 3.38g B. 4.58g
C. 4.16g D. 4.41g
10. 某同学探究金属Na与CO2的反应,实验如下:
实 验 Ⅰ 实 验 Ⅱ
操作 将点燃的金属钠伸到盛有CO2的集气瓶中 将实验Ⅰ的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液
现象 ① 火焰呈黄色② 底部有黑色固体,瓶壁上附有白色固体 ① 黑色滤渣可燃② 滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成
下列说法错误的是( )
A. 生成的黑色固体中含有C B. 白色固体是Na2O
C. 实验说明CO2具有氧化性 D. 金属钠着火时不能用CO2灭火
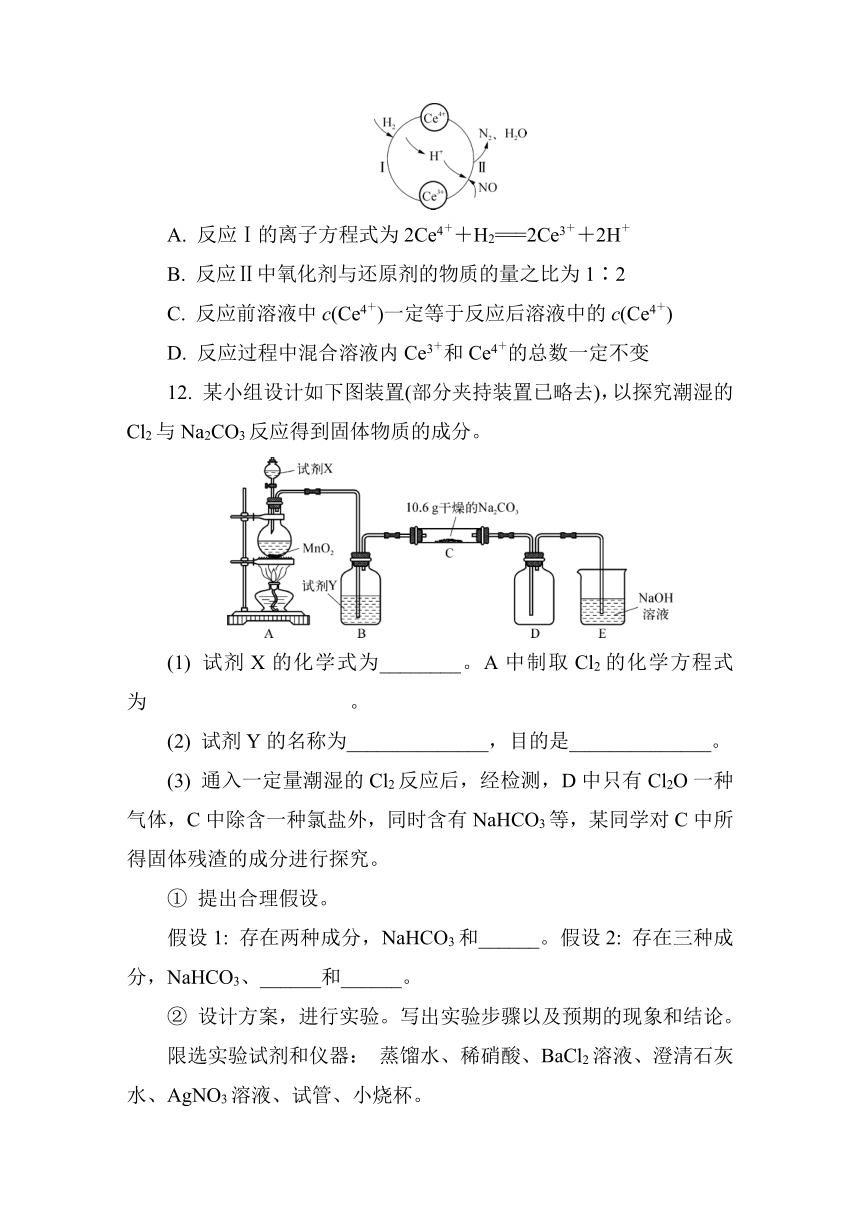
11. 常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是( )
A. 反应Ⅰ的离子方程式为2Ce4++H2===2Ce3++2H+
B. 反应Ⅱ中氧化剂与还原剂的物质的量之比为1∶2
C. 反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+)
D. 反应过程中混合溶液内Ce3+和Ce4+的总数一定不变
12. 某小组设计如下图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1) 试剂X的化学式为________。A中制取Cl2的化学方程式为 。
(2) 试剂Y的名称为______________,目的是______________。
(3) 通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
① 提出合理假设。
假设1: 存在两种成分,NaHCO3和______。假设2: 存在三种成分,NaHCO3、______和______。
② 设计方案,进行实验。写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器: 蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实 验 步 骤 预期的现象和结论
步骤1: 取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 —
步骤2: 向A试管中滴加过量的稀硝酸,再滴加________ 溶液变浑浊
步骤3: 向B试管中滴加BaCl2溶液 若无明显现象,证明____________,则假设____(填“1”或“2”)成立;若__________,证明____________,则假设____(填“1”或“2”)成立
(4) 已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为________________________________________。
13. 将含有少量HCl的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),据此回答下列问题。
(1) 写出生成漂白粉的化学方程式: ______________________________________。
(2) 此实验所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
① 温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。上图为反应过程中溶液中ClO-、ClO的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气与水的反应)。
a. 图中曲线Ⅰ表示________(填离子符号)的物质的量随反应时间变化的关系。
b. 所用石灰乳中含有Ca(OH)2的物质的量为________ mol。
② 试判断另一个副反应是_________________________________________________(写化学方程式)。
为避免此副反应发生,可以采取的改进措施是____________________________________ _________________________________。
14. 二氧化氯(分子式为ClO2,其中Cl元素的化合价为+4)是一种黄绿色的气体,具有青草和泥土的混合气味,在水处理等方面有广泛应用,是一种高效安全的消毒剂。
(1) 在ClO2的制备方法中,有下列两种:
方法Ⅰ: 2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法Ⅱ: 2NaClO3+H2O2+H2SO4===2ClO2↑+Na2SO4↑+2H2O+O2↑
方法Ⅰ反应中,产生1mol ClO2气体,电子转移________ mol;方法Ⅱ反应中,氧化产物为________(填化学式)。
(2) 将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作。
步骤1: 取待测ClO2溶液20.00 mL于锥形瓶中。
步骤2: 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-。
步骤3: 逐滴加入0.100 0 mol/L Na2S2O3溶液,发生的反应为I2+2S2O===S4O+2I-;当“步骤2”反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为29.50 mL。
写出步骤2反应的离子方程式: ______________________________________________ __________________________。
计算此ClO2溶液的物质的量浓度: ________mol/L(答案写精确数值或保留小数点后两位)。
答案与解析
第二章复习 素养提升
1. C [解析] 钠燃烧生成过氧化钠,过氧化钠与二氧化碳、水等反应生成氧气而加剧钠的燃烧,因此不能用泡沫灭火器、水、干粉灭火器灭火,只能用沙子,故C项正确。
2. C [解析] 焰色反应是元素的性质,故A项错误;焰色反应为物理变化,故B项错误;钾元素的焰色反应为紫色,易被黄光遮住,某物质灼烧时,焰色反应为黄色,一定含有钠元素,可能含有K元素,故C项正确;做焰色反应实验用的铂丝,每试验一种样品后都必须用稀盐酸洗涤,是因为盐酸可以溶解氧化物等杂质且易挥发,不会残留痕迹,故D项错误。
3. A [解析] 由于2Na2O2+2H2O===4NaOH+O2↑,HCO可与OH-发生反应,HCO+OH-===CO+H2O,因此HCO的浓度减小。
4. B [解析] 20mL 0.5mol/L的盐酸加水稀释到500mL,设稀释后溶液浓度为c,则依据溶液稀释规律,0.020L×0.5mol/L=0.5L×c,解得c=0.02mol/L。溶液浓度与所取体积无关,所以稀释后从中取10mL,取出的盐酸中HCl的物质的量浓度为0.02mol/L。
5. B [解析] Na2O2中阴离子是O,Na2O中阴离子是O2-,故B项错误。
6. C [解析] 由草木灰提取钾盐并检验钾元素的存在,则应进行称量(A)、溶解(B)、过滤除杂,然后蒸发结晶(C)得到碳酸钾,最后利用焰色反应(D)检验钾元素,而选项C中蒸发结晶时要用玻璃棒不断搅拌,防止液体飞溅,故C操作错误。
7. D [解析] D项中HClO是弱酸,不能改写成ClO-和H+。
8. B [解析] 氯气为黄绿色气体,氯水呈浅黄绿色,是因为氯水中含有氯气,A项正确;向饱和NaHCO3溶液中加入足量氯水,有无色气体产生是因为发生反应NaHCO3+HCl===NaCl+H2O+CO2↑,说明氯水中含有HCl,B项错误;红色纸条褪色,说明氯水具有漂白性,C项正确;向FeCl2溶液中滴加氯水,溶液变成棕黄色,是因为发生反应2FeCl2+Cl2===2FeCl3,说明氯水具有氧化性,D项正确。
9. C [解析] 利用差量法进行计算。1mol NaHCO3分解质量减少31g,所以可以求出NaHCO3的物质的量为0.01mol。
10. B [解析] 由实验Ⅱ的现象,推测钠在CO2中燃烧的生成物中有碳、Na2CO3,故A项正确、B项错误;钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应中钠为还原剂,二氧化碳为氧化剂,实验说明CO2具有氧化性,故C项正确;由实验Ⅰ可知钠能够在二氧化碳中燃烧,则金属Na着火不能用CO2灭火,应用沙土覆盖灭火,故D项正确。
11. C [解析] 本题通过氮氧化物的处理考查氧化还原反应的概念和相关计算等。根据图示可知反应Ⅰ的离子方程式为2Ce4++H2===2Ce3++2H+,A项正确;反应Ⅱ的反应物为Ce3+、H+、NO,生成物为Ce4+、N2、H2O,根据得失电子守恒、电荷守恒及质量守恒,可得反应的离子方程式为4Ce3++4H++2NO===4Ce4++N2+2H2O,NO是氧化剂,Ce3+是还原剂,故氧化剂与还原剂的物质的量之比为2∶4=1∶2,B项正确;通入的NO和H2的比例未知,且反应后有气体、水生成,故反应前后溶液中Ce4+的浓度不一定相等,C项错误;根据Ce原子守恒可知,反应过程中混合溶液内Ce3+和Ce4+的总数不变,D项正确。
12. (1) HCl MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2) 饱和食盐水 除去HCl气体 (3) ① 假设1: NaCl 假设2: NaCl Na2CO3 ② AgNO3溶液 固体中不含碳酸钠 1 溶液变浑浊 固体中含碳酸钠 2 (4) Cl2O+2NaOH===2NaClO+H2O
[解析] (2) 欲除去Cl2中的HCl气体,试剂Y要既能除去HCl,又不能吸收Cl2,这里可选用饱和食盐水。 (3) ① Cl2与Na2CO3反应生成Cl2O的过程中,氯元素由0价升高到+1价,根据氧化还原反应中元素化合价有升必有降的规律可知,生成的氯盐为NaCl。潮湿的Cl2与Na2CO3在固体表面发生反应,Na2CO3可能反应不完全,据此推测固体残渣中有NaHCO3和NaCl,可能有未反应的Na2CO3。② 步骤2检验NaCl,步骤3利用BaCl2溶液检验是否存在Na2CO3。 (4) Cl2O与水反应生成HClO,化学方程式为Cl2O+H2O===2HClO。HClO与NaOH溶液发生中和反应生成NaClO和H2O。
13. (1) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O (2) ① 将U形管置于冷水浴中 a. ClO- b. 0.25 ② 2HCl+Ca(OH)2===CaCl2+2H2O 将含有少量HCl的氯气通过盛有饱和食盐水的洗气瓶 [解析] (2) 温度低时生成Ca(ClO)2,温度高时生成Ca(ClO3)2,刚开始反应时温度低,所以曲线Ⅰ表示ClO-的物质的量随反应时间变化的关系。根据氧化还原反应中得失电子数相等计算氯离子的物质的量,n(Cl-)×1=0.10 mol×1+0.05 mol×5,n(Cl-)=0.35 mol。含Cl元素的总物质的量=0.35 mol+0.1 mol+0.05 mol=0.5 mol。CaCl2、Ca(ClO)2、Ca(ClO3)2中Ca2+与Cl-的个数比为1∶2,所以n(Ca2+)=0.25 mol。
14. (1) 1 O2 (2) 2ClO2+8H++10I-===2Cl-+4H2O+5I2 2.95×10-2 mol/L [解析] (1) 方法Ⅰ中ClO2是还原产物,氯元素的化合价由+5降低为+4,转移电子的物质的量等于ClO2的物质的量,所以产生1 mol ClO2气体,电子转移1 mol。方法Ⅱ中H2O2中氧元素从-1价升高为0价的氧气,发生氧化反应,氧化产物为O2。 (2) 用I-将溶液中的ClO2还原为Cl-以测定水样中ClO2的浓度,则I-被氧化,氯从+4价降为-1价,碘离子从-1价被氧化为0价,故该反应的离子方程式为2ClO2+8H++10I-===2Cl-+4H2O+5I2。 n(I2)=n(Na2S2O3)=×0.100 0 mol/L×29.50×10-3 L=1.475×10-3 mol, n(ClO2)=n(I2)=×1.475×10-3mol=5.9×10-4mol, c(ClO2)=5.9×10-4mol÷(20.00×10-3L)=2.95×10-2 mol/L。
1. 金属钠着火时,可用来灭火的是( )
A. 泡沫灭火器 B. 水
C. 沙子 D. 干粉灭火器
2. 下列有关焰色反应的说法中,正确的是( )
A. 焰色反应只是金属单质灼烧时出现的现象
B. 焰色反应是伴随化学变化而产生的
C. 焰色反应观察到黄色火焰并不能确定该物质一定不含钾元素
D. 洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸
3. 向含有HCO、CO、NO、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减小的是( )
A. HCO B. CO
C. NO D. Na+
4. 将20mL 0.5mol/L盐酸加水稀释到500mL,稀释后从中取10mL,则取出的盐酸中HCl的物质的量浓度为( )
A. 0.002mol/L B. 0.02mol/L
C. 0.05mol/L D. 0.04mol/L
5. 下列关于钠的化合物的叙述中,不正确的是( )
A. 热稳定性: Na2CO3>NaHCO3 B. Na2O和Na2O2中阴离子是同种微粒
C. 碳酸氢钠可用于治疗胃酸过多 D. Na2O2中氧的化合价为-1
6. 粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色试验等操作。下列图示对应的操作不规范的是( )
A. 称量 B. 溶解
C. 蒸发 D. 焰色试验
7. 下列离子方程式书写不正确的是( )
A. 氧化钠与足量盐酸: Na2O+2H+===2Na++H2O
B. 碳酸氢钠溶液与足量盐酸: HCO+H+===CO2↑+H2O
C. 氢氧化钙溶液吸收氯气: Cl2+2OH-===Cl-+ClO-+H2O
D. 氯气与水反应: Cl2+H2O===2H++Cl-+ClO-
8. 在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
方 法 现 象 结 论
A 观察氯水颜色 氯水呈浅黄绿色 氯水中含Cl2
B 向饱和NaHCO3溶液中加入足量氯水 有无色气体产生 氯水中含HClO
C 向红色纸条上滴加氯水 红色纸条褪色 氯水具有漂白性
D 向FeCl2溶液中滴加氯水 溶液变成棕黄色 氯水具有氧化性
9. 碳酸氢钠受热容易分解为碳酸钠。现加热碳酸钠和碳酸氢钠的混合物5.00g,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为( )
A. 3.38g B. 4.58g
C. 4.16g D. 4.41g
10. 某同学探究金属Na与CO2的反应,实验如下:
实 验 Ⅰ 实 验 Ⅱ
操作 将点燃的金属钠伸到盛有CO2的集气瓶中 将实验Ⅰ的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液
现象 ① 火焰呈黄色② 底部有黑色固体,瓶壁上附有白色固体 ① 黑色滤渣可燃② 滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成
下列说法错误的是( )
A. 生成的黑色固体中含有C B. 白色固体是Na2O
C. 实验说明CO2具有氧化性 D. 金属钠着火时不能用CO2灭火
11. 常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是( )
A. 反应Ⅰ的离子方程式为2Ce4++H2===2Ce3++2H+
B. 反应Ⅱ中氧化剂与还原剂的物质的量之比为1∶2
C. 反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+)
D. 反应过程中混合溶液内Ce3+和Ce4+的总数一定不变
12. 某小组设计如下图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1) 试剂X的化学式为________。A中制取Cl2的化学方程式为 。
(2) 试剂Y的名称为______________,目的是______________。
(3) 通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
① 提出合理假设。
假设1: 存在两种成分,NaHCO3和______。假设2: 存在三种成分,NaHCO3、______和______。
② 设计方案,进行实验。写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器: 蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实 验 步 骤 预期的现象和结论
步骤1: 取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 —
步骤2: 向A试管中滴加过量的稀硝酸,再滴加________ 溶液变浑浊
步骤3: 向B试管中滴加BaCl2溶液 若无明显现象,证明____________,则假设____(填“1”或“2”)成立;若__________,证明____________,则假设____(填“1”或“2”)成立
(4) 已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为________________________________________。
13. 将含有少量HCl的氯气通入盛有潮湿消石灰的U形管中,可制得少量漂白粉(该反应为放热反应),据此回答下列问题。
(1) 写出生成漂白粉的化学方程式: ______________________________________。
(2) 此实验所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应。
① 温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。上图为反应过程中溶液中ClO-、ClO的物质的量(m)与反应时间(t)的关系曲线(不考虑氯气与水的反应)。
a. 图中曲线Ⅰ表示________(填离子符号)的物质的量随反应时间变化的关系。
b. 所用石灰乳中含有Ca(OH)2的物质的量为________ mol。
② 试判断另一个副反应是_________________________________________________(写化学方程式)。
为避免此副反应发生,可以采取的改进措施是____________________________________ _________________________________。
14. 二氧化氯(分子式为ClO2,其中Cl元素的化合价为+4)是一种黄绿色的气体,具有青草和泥土的混合气味,在水处理等方面有广泛应用,是一种高效安全的消毒剂。
(1) 在ClO2的制备方法中,有下列两种:
方法Ⅰ: 2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法Ⅱ: 2NaClO3+H2O2+H2SO4===2ClO2↑+Na2SO4↑+2H2O+O2↑
方法Ⅰ反应中,产生1mol ClO2气体,电子转移________ mol;方法Ⅱ反应中,氧化产物为________(填化学式)。
(2) 将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作。
步骤1: 取待测ClO2溶液20.00 mL于锥形瓶中。
步骤2: 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-。
步骤3: 逐滴加入0.100 0 mol/L Na2S2O3溶液,发生的反应为I2+2S2O===S4O+2I-;当“步骤2”反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为29.50 mL。
写出步骤2反应的离子方程式: ______________________________________________ __________________________。
计算此ClO2溶液的物质的量浓度: ________mol/L(答案写精确数值或保留小数点后两位)。
答案与解析
第二章复习 素养提升
1. C [解析] 钠燃烧生成过氧化钠,过氧化钠与二氧化碳、水等反应生成氧气而加剧钠的燃烧,因此不能用泡沫灭火器、水、干粉灭火器灭火,只能用沙子,故C项正确。
2. C [解析] 焰色反应是元素的性质,故A项错误;焰色反应为物理变化,故B项错误;钾元素的焰色反应为紫色,易被黄光遮住,某物质灼烧时,焰色反应为黄色,一定含有钠元素,可能含有K元素,故C项正确;做焰色反应实验用的铂丝,每试验一种样品后都必须用稀盐酸洗涤,是因为盐酸可以溶解氧化物等杂质且易挥发,不会残留痕迹,故D项错误。
3. A [解析] 由于2Na2O2+2H2O===4NaOH+O2↑,HCO可与OH-发生反应,HCO+OH-===CO+H2O,因此HCO的浓度减小。
4. B [解析] 20mL 0.5mol/L的盐酸加水稀释到500mL,设稀释后溶液浓度为c,则依据溶液稀释规律,0.020L×0.5mol/L=0.5L×c,解得c=0.02mol/L。溶液浓度与所取体积无关,所以稀释后从中取10mL,取出的盐酸中HCl的物质的量浓度为0.02mol/L。
5. B [解析] Na2O2中阴离子是O,Na2O中阴离子是O2-,故B项错误。
6. C [解析] 由草木灰提取钾盐并检验钾元素的存在,则应进行称量(A)、溶解(B)、过滤除杂,然后蒸发结晶(C)得到碳酸钾,最后利用焰色反应(D)检验钾元素,而选项C中蒸发结晶时要用玻璃棒不断搅拌,防止液体飞溅,故C操作错误。
7. D [解析] D项中HClO是弱酸,不能改写成ClO-和H+。
8. B [解析] 氯气为黄绿色气体,氯水呈浅黄绿色,是因为氯水中含有氯气,A项正确;向饱和NaHCO3溶液中加入足量氯水,有无色气体产生是因为发生反应NaHCO3+HCl===NaCl+H2O+CO2↑,说明氯水中含有HCl,B项错误;红色纸条褪色,说明氯水具有漂白性,C项正确;向FeCl2溶液中滴加氯水,溶液变成棕黄色,是因为发生反应2FeCl2+Cl2===2FeCl3,说明氯水具有氧化性,D项正确。
9. C [解析] 利用差量法进行计算。1mol NaHCO3分解质量减少31g,所以可以求出NaHCO3的物质的量为0.01mol。
10. B [解析] 由实验Ⅱ的现象,推测钠在CO2中燃烧的生成物中有碳、Na2CO3,故A项正确、B项错误;钠在二氧化碳气体中燃烧生成碳酸钠和碳单质,反应中钠为还原剂,二氧化碳为氧化剂,实验说明CO2具有氧化性,故C项正确;由实验Ⅰ可知钠能够在二氧化碳中燃烧,则金属Na着火不能用CO2灭火,应用沙土覆盖灭火,故D项正确。
11. C [解析] 本题通过氮氧化物的处理考查氧化还原反应的概念和相关计算等。根据图示可知反应Ⅰ的离子方程式为2Ce4++H2===2Ce3++2H+,A项正确;反应Ⅱ的反应物为Ce3+、H+、NO,生成物为Ce4+、N2、H2O,根据得失电子守恒、电荷守恒及质量守恒,可得反应的离子方程式为4Ce3++4H++2NO===4Ce4++N2+2H2O,NO是氧化剂,Ce3+是还原剂,故氧化剂与还原剂的物质的量之比为2∶4=1∶2,B项正确;通入的NO和H2的比例未知,且反应后有气体、水生成,故反应前后溶液中Ce4+的浓度不一定相等,C项错误;根据Ce原子守恒可知,反应过程中混合溶液内Ce3+和Ce4+的总数不变,D项正确。
12. (1) HCl MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2) 饱和食盐水 除去HCl气体 (3) ① 假设1: NaCl 假设2: NaCl Na2CO3 ② AgNO3溶液 固体中不含碳酸钠 1 溶液变浑浊 固体中含碳酸钠 2 (4) Cl2O+2NaOH===2NaClO+H2O
[解析] (2) 欲除去Cl2中的HCl气体,试剂Y要既能除去HCl,又不能吸收Cl2,这里可选用饱和食盐水。 (3) ① Cl2与Na2CO3反应生成Cl2O的过程中,氯元素由0价升高到+1价,根据氧化还原反应中元素化合价有升必有降的规律可知,生成的氯盐为NaCl。潮湿的Cl2与Na2CO3在固体表面发生反应,Na2CO3可能反应不完全,据此推测固体残渣中有NaHCO3和NaCl,可能有未反应的Na2CO3。② 步骤2检验NaCl,步骤3利用BaCl2溶液检验是否存在Na2CO3。 (4) Cl2O与水反应生成HClO,化学方程式为Cl2O+H2O===2HClO。HClO与NaOH溶液发生中和反应生成NaClO和H2O。
13. (1) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O (2) ① 将U形管置于冷水浴中 a. ClO- b. 0.25 ② 2HCl+Ca(OH)2===CaCl2+2H2O 将含有少量HCl的氯气通过盛有饱和食盐水的洗气瓶 [解析] (2) 温度低时生成Ca(ClO)2,温度高时生成Ca(ClO3)2,刚开始反应时温度低,所以曲线Ⅰ表示ClO-的物质的量随反应时间变化的关系。根据氧化还原反应中得失电子数相等计算氯离子的物质的量,n(Cl-)×1=0.10 mol×1+0.05 mol×5,n(Cl-)=0.35 mol。含Cl元素的总物质的量=0.35 mol+0.1 mol+0.05 mol=0.5 mol。CaCl2、Ca(ClO)2、Ca(ClO3)2中Ca2+与Cl-的个数比为1∶2,所以n(Ca2+)=0.25 mol。
14. (1) 1 O2 (2) 2ClO2+8H++10I-===2Cl-+4H2O+5I2 2.95×10-2 mol/L [解析] (1) 方法Ⅰ中ClO2是还原产物,氯元素的化合价由+5降低为+4,转移电子的物质的量等于ClO2的物质的量,所以产生1 mol ClO2气体,电子转移1 mol。方法Ⅱ中H2O2中氧元素从-1价升高为0价的氧气,发生氧化反应,氧化产物为O2。 (2) 用I-将溶液中的ClO2还原为Cl-以测定水样中ClO2的浓度,则I-被氧化,氯从+4价降为-1价,碘离子从-1价被氧化为0价,故该反应的离子方程式为2ClO2+8H++10I-===2Cl-+4H2O+5I2。 n(I2)=n(Na2S2O3)=×0.100 0 mol/L×29.50×10-3 L=1.475×10-3 mol, n(ClO2)=n(I2)=×1.475×10-3mol=5.9×10-4mol, c(ClO2)=5.9×10-4mol÷(20.00×10-3L)=2.95×10-2 mol/L。
