化学人教版(2019)必修第一册2.2.1氯气的性质(共20张ppt,含视频)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.1氯气的性质(共20张ppt,含视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 219.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 06:25:02 | ||
图片预览






文档简介
(共20张PPT)
第二节
氯及其化合物
第二章
第1课时 氯气的性质
氯在自然界除了以NaCl、MgCl2 、CaCl2 等存在于海水中,还存在于盐湖、盐矿中。
课堂导入
氯气的物理性质
新华网报道:2005年3月29日,京沪高速公路淮安段一辆满载液氯的液罐车和对面来车相撞,大量液氯外泄。据目击者描述:“一股黄绿色的气体就像探照灯光一样,‘唰’ 地射向高空,足有5米高,并有刺鼻的味道,眼睛也熏得有些睁不开。”
事发后消防队员不断地用水枪喷射,但时值西南风,氯气迅速向西南方扩散,造成350人中毒进医院救治,另有28人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。
氯气的物理性质
1.颜色:黄绿色
2.状态:气体(常温常压)
3.气味:有强烈刺激性气味
4.密度:大于空气
5.毒性:有毒
6.溶解性:能溶于水(1:2),形成氯水
7.易液化:氯气 液氯
-34.6℃
打开药品瓶塞,瓶口在前下方离鼻孔约0.5米,用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔。
氯气的化学性质
得e-
Cl
Cl-
具有强氧化性
原子结构
物质分类
活泼的非金属单质,可以与金属单质、非金属单质反应
氯气的化学性质
1.与金属单质反应
氯气的化学性质
1. 2Na+Cl2 2NaCl
1.与金属单质反应
2. Cu+Cl2 CuCl2
3. 2Fe+3Cl2 2FeCl3
产生大量白烟
产生大量棕黄色的烟
产生大量棕黄色的烟
1.氯气与变价金属反应,生成 高价金属氯化物
2.通常情况下,干燥的氯气不能与铁反应,可以用钢瓶储运液氯
氯气的化学性质
1.与非金属单质反应
氯气的化学性质
1.与非金属单质反应
H2+Cl2 2HCl
点燃
现象:纯净的氢气在氯气中安静的燃烧,发出苍白色的火焰,瓶口有大量白雾
H2+Cl2 2HCl
光照
现象:光照时剧烈反应,发生爆炸,瓶口产生白雾。
通过以上的燃烧实验,你对燃烧的条件及其本质有什么新的认识
思考与交流
1.燃烧不一定要有氧气参加
2.燃烧的本质是氧化还原反应
3.所有发光发热的剧烈氧化还原反应都称为燃烧
氯气与水的反应
打开自来水的水龙头,有时候我们会闻到一股刺鼻的气味
游泳池的水有时候也会有刺鼻的气味
氯气与水的反应
氯气溶于水的过程是单纯的物理变化还是发生了化学反应?
假设一:氯气与水不反应,则氯水中成分:
Cl2、H2O
假设二:氯气与水反应,则氯水中成分:
氯水中含有Cl2
H2O + Cl2 HCl +
H+
紫色石蕊试液、Zn、Na2CO3等
Cl-
稀硝酸酸化的AgNO3溶液
氯气与水的反应
探究一:氯水中有Cl-
现象:有白色沉淀生成
结论:氯水中有Cl-
氯气与水的反应
探究一:氯水中有H+
现象:溶液先变红后褪色(被漂白)
结论:氯水中有H+,氯水中有一种成分具有漂白性
氯气与水的反应
是Cl2使溶液褪色还是Cl2与H2O反应生成了具有漂白性的物质?
氯气与水的反应
H2O + CI2
HCI
+ HCIO
次氯酸
1.HCIO是一元弱酸: H2CO3 > HCIO
2.HCIO具有强氧化性:杀菌、消毒、漂白
3.HCIO不稳定,见光易分解:
2HCIO 2HCI + O2
光照
结论:干燥的CI2没有漂白性,起漂白作用的是HCIO
氯水需现用现配,保存在棕色细口瓶中
氯水的成分
分子 离子
液氯
新制氯水
久置氯水
(3分4离)
对比液氯、新制氯水、久置氯水的成分。
(极少量)
(极少量)
久置氯水相当于稀盐酸
CI2
H2O、CI2、HCIO
H+、CI-、CIO-、OH-
H2O
H+、CI-、OH-
随堂练习
1.下列实验现象的描述正确的是( )。
A.钠在空气中燃烧,发出黄色火焰,生成白色固体
B.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾
C.将氯水滴加到有色布条上,褪色,说明氯水中含有Cl2
D.铁丝在氯气中燃烧,产生红棕色烟,产物溶于水,溶液呈浅绿色
B
随堂练习
2.下列关于氯及其化合物的说法正确的是( )。
A.氯气和液氯是两种不同的物质
B. 通入到含有酚酞的NaOH溶液中红色褪去,因为氯气有漂白性
C. 在化学反应中既能作氧化剂,又能作还原剂
D.新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液呈 红色
C
感 谢 观 看
第二节
氯及其化合物
第二章
第1课时 氯气的性质
氯在自然界除了以NaCl、MgCl2 、CaCl2 等存在于海水中,还存在于盐湖、盐矿中。
课堂导入
氯气的物理性质
新华网报道:2005年3月29日,京沪高速公路淮安段一辆满载液氯的液罐车和对面来车相撞,大量液氯外泄。据目击者描述:“一股黄绿色的气体就像探照灯光一样,‘唰’ 地射向高空,足有5米高,并有刺鼻的味道,眼睛也熏得有些睁不开。”
事发后消防队员不断地用水枪喷射,但时值西南风,氯气迅速向西南方扩散,造成350人中毒进医院救治,另有28人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。
氯气的物理性质
1.颜色:黄绿色
2.状态:气体(常温常压)
3.气味:有强烈刺激性气味
4.密度:大于空气
5.毒性:有毒
6.溶解性:能溶于水(1:2),形成氯水
7.易液化:氯气 液氯
-34.6℃
打开药品瓶塞,瓶口在前下方离鼻孔约0.5米,用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔。
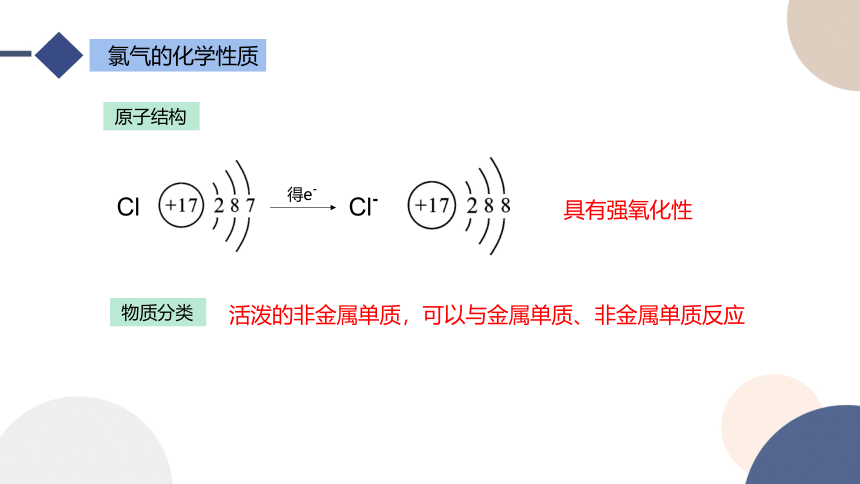
氯气的化学性质
得e-
Cl
Cl-
具有强氧化性
原子结构
物质分类
活泼的非金属单质,可以与金属单质、非金属单质反应
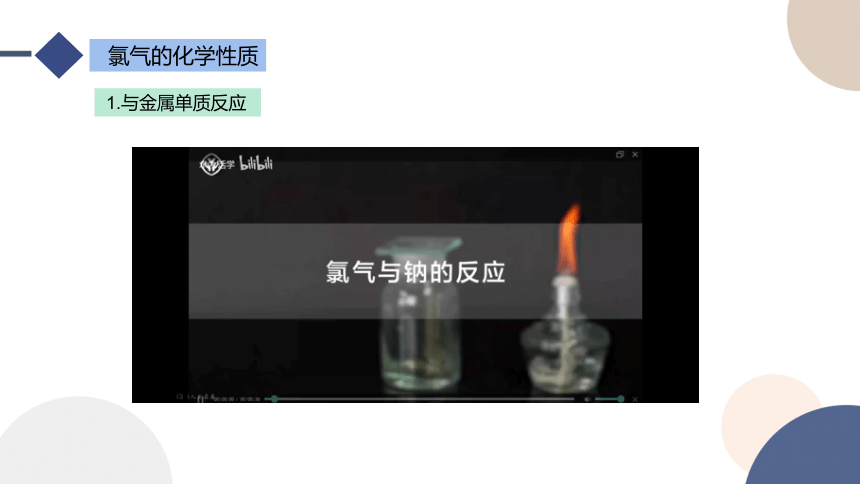
氯气的化学性质
1.与金属单质反应
氯气的化学性质
1. 2Na+Cl2 2NaCl
1.与金属单质反应
2. Cu+Cl2 CuCl2
3. 2Fe+3Cl2 2FeCl3
产生大量白烟
产生大量棕黄色的烟
产生大量棕黄色的烟
1.氯气与变价金属反应,生成 高价金属氯化物
2.通常情况下,干燥的氯气不能与铁反应,可以用钢瓶储运液氯
氯气的化学性质
1.与非金属单质反应
氯气的化学性质
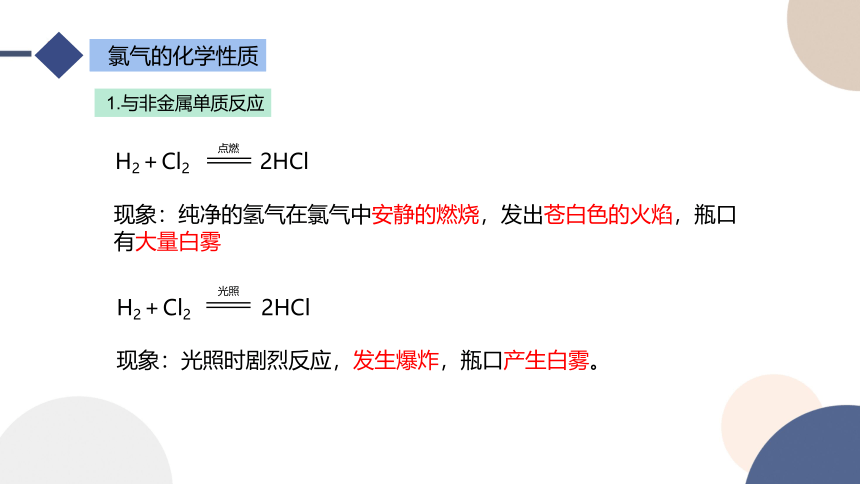
1.与非金属单质反应
H2+Cl2 2HCl
点燃
现象:纯净的氢气在氯气中安静的燃烧,发出苍白色的火焰,瓶口有大量白雾
H2+Cl2 2HCl
光照
现象:光照时剧烈反应,发生爆炸,瓶口产生白雾。
通过以上的燃烧实验,你对燃烧的条件及其本质有什么新的认识
思考与交流
1.燃烧不一定要有氧气参加
2.燃烧的本质是氧化还原反应
3.所有发光发热的剧烈氧化还原反应都称为燃烧
氯气与水的反应
打开自来水的水龙头,有时候我们会闻到一股刺鼻的气味
游泳池的水有时候也会有刺鼻的气味
氯气与水的反应
氯气溶于水的过程是单纯的物理变化还是发生了化学反应?
假设一:氯气与水不反应,则氯水中成分:
Cl2、H2O
假设二:氯气与水反应,则氯水中成分:
氯水中含有Cl2
H2O + Cl2 HCl +
H+
紫色石蕊试液、Zn、Na2CO3等
Cl-
稀硝酸酸化的AgNO3溶液
氯气与水的反应
探究一:氯水中有Cl-
现象:有白色沉淀生成
结论:氯水中有Cl-
氯气与水的反应
探究一:氯水中有H+
现象:溶液先变红后褪色(被漂白)
结论:氯水中有H+,氯水中有一种成分具有漂白性
氯气与水的反应
是Cl2使溶液褪色还是Cl2与H2O反应生成了具有漂白性的物质?
氯气与水的反应
H2O + CI2
HCI
+ HCIO
次氯酸
1.HCIO是一元弱酸: H2CO3 > HCIO
2.HCIO具有强氧化性:杀菌、消毒、漂白
3.HCIO不稳定,见光易分解:
2HCIO 2HCI + O2
光照
结论:干燥的CI2没有漂白性,起漂白作用的是HCIO
氯水需现用现配,保存在棕色细口瓶中
氯水的成分
分子 离子
液氯
新制氯水
久置氯水
(3分4离)
对比液氯、新制氯水、久置氯水的成分。
(极少量)
(极少量)
久置氯水相当于稀盐酸
CI2
H2O、CI2、HCIO
H+、CI-、CIO-、OH-
H2O
H+、CI-、OH-
随堂练习
1.下列实验现象的描述正确的是( )。
A.钠在空气中燃烧,发出黄色火焰,生成白色固体
B.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾
C.将氯水滴加到有色布条上,褪色,说明氯水中含有Cl2
D.铁丝在氯气中燃烧,产生红棕色烟,产物溶于水,溶液呈浅绿色
B
随堂练习
2.下列关于氯及其化合物的说法正确的是( )。
A.氯气和液氯是两种不同的物质
B. 通入到含有酚酞的NaOH溶液中红色褪去,因为氯气有漂白性
C. 在化学反应中既能作氧化剂,又能作还原剂
D.新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液呈 红色
C
感 谢 观 看
