2023秋高中化学人教版2019必修1 第三章 铁 金属材料 第1节 第3课时 铁盐和亚铁盐 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第三章 铁 金属材料 第1节 第3课时 铁盐和亚铁盐 课时同步练(含答案) |  | |
| 格式 | DOC | ||
| 文件大小 | 164.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 21:52:49 | ||
图片预览


文档简介
第3课时 铁盐和亚铁盐
1. 高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。其中铁元素的化合价为( )
A. 0 B. +2
C. +6 D. +8
2. 将铁屑溶于过量盐酸后,再加下列物质,会有三价铁生成的是( )
A. 稀硫酸 B. 氯水
C. 氯化锌 D. 氯化铜
3. 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )
A. FeO B. Fe2O3
C. Fe3O4 D. Fe2(SO4)3
4. 人体正常的血红蛋白中应含有Fe2+,若误食亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒,服用维生素C可以解除亚硝酸盐中毒,下列叙述正确的是( )
A. 亚硝酸盐是还原剂 B. 维生素C是氧化剂
C. 维生素C将Fe3+转化成Fe2+ D. 亚硝酸盐被氧化
5. 下列实验方案能达到目的的是( )
A. 用排水集气法收集HCl气体
B. 用燃烧的木条检验N2和CO2
C. 用KSCN溶液检验溶液中的Fe3+
D. 用丁达尔效应鉴别Na2CO3溶液和NaHCO3溶液
6. 只用一种试剂就可将AgNO3、KSCN、H2SO4、NaOH四种无色溶液区分开,这种试剂是( )
A. BaCl2溶液 B. FeCl2溶液
C. FeCl3溶液 D. Fe(NO3)3溶液
7. 铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量的双氧水,再加入过量的氨水,有红褐色的沉淀生成。过滤、加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别是( )
A. Fe(OH)3;Fe2O3 B. Fe(OH)2;FeO
C. Fe(OH)2;Fe(OH)3、Fe3O4 D. Fe2O3;Fe(OH)3
8. 下列有关物质用途的说法中,错误的是( )
A. 氢氧化铁胶体可以净水 B. Fe3O4用作红色油漆和涂料
C. NaHCO3用于烘焙糕点 D. Na2O2用作供氧剂
9. 只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的离子方程式。
物质(括号内为杂质) 加入试剂和操作 离子方程式
(1) FeCl2溶液(FeCl3)
(2) Fe2O3[Fe(OH)3]
(3) FeSO4溶液(CuSO4)
(4) FeCl3溶液(FeCl2)
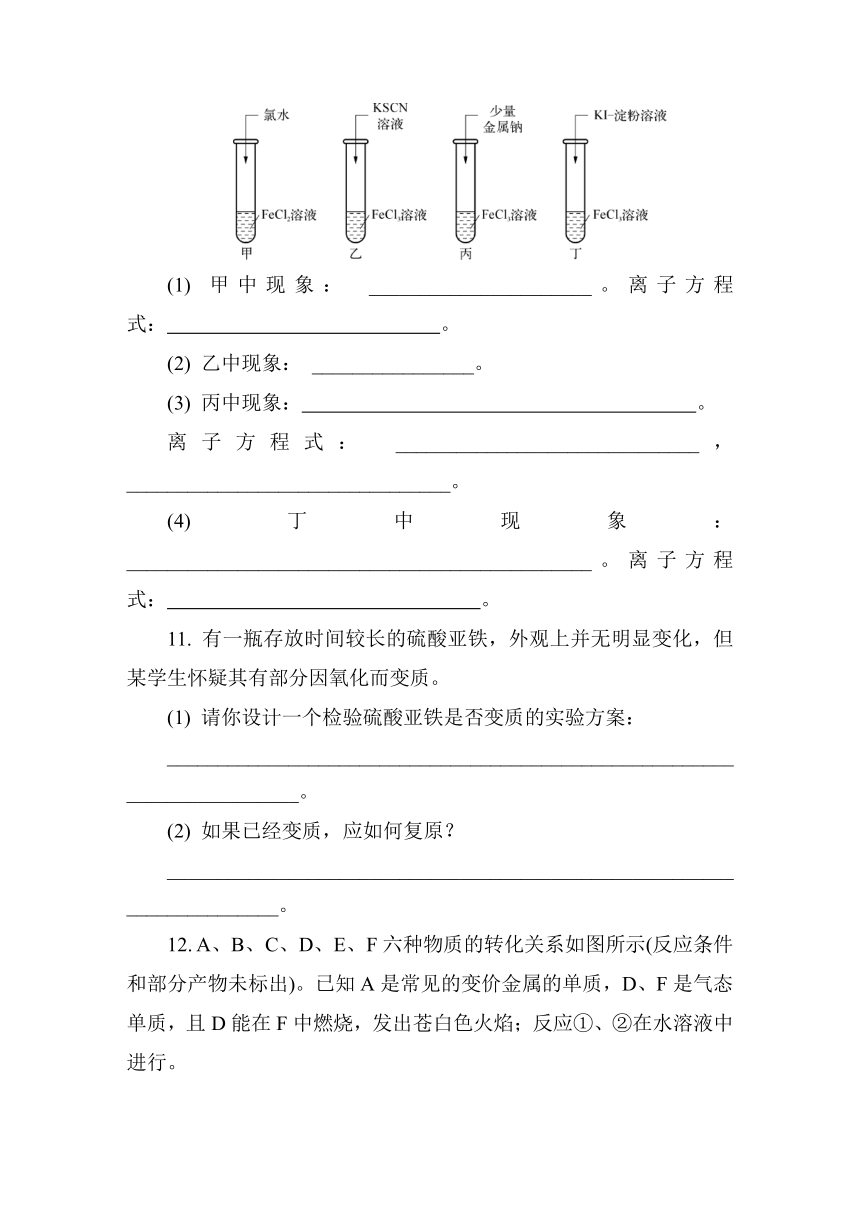
10. 对铁的氯化物溶液进行下图所示的实验。
(1) 甲中现象: ______________________。离子方程式: 。
(2) 乙中现象: ________________。
(3) 丙中现象: 。
离子方程式: ______________________________,________________________________。
(4) 丁中现象: ______________________________________________。离子方程式: 。
11. 有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质。
(1) 请你设计一个检验硫酸亚铁是否变质的实验方案:
_________________________________________________________________________。
(2) 如果已经变质,应如何复原?
_______________________________________________________________________。
12. A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。已知A是常见的变价金属的单质,D、F是气态单质,且D能在F中燃烧,发出苍白色火焰;反应①、②在水溶液中进行。
(1) 写出A、B的化学式: A________,B________。
(2) 写出反应②的离子方程式: ___________________________________________。
写出反应④的化学方程式: _____________________________________________。
13. 从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
答案与解析
第3课时 铁盐和亚铁盐
1. C
2. B [解析] Fe溶于盐酸后发生反应,Fe+2H+===Fe2++H2↑,而Fe2+遇强氧化剂才会生成三价铁。
3. A [解析] Fe3O4与HCl反应,既有FeCl3生成,又有FeCl2生成。
4. C [解析] 解除亚硝酸盐中毒就是把Fe3+再转化成Fe2+。
5. C
6. C [解析] 现象分别为: 白色沉淀、血红色溶液、无明显变化、红褐色沉淀。
7. A [解析] 铁屑与稀硫酸反应生成Fe2+,加双氧水后氧化为Fe3+,加氨水后生成Fe(OH)3,加热灼烧后分解为Fe2O3。
8. B [解析] 氢氧化铁胶体可以聚沉水中悬浮物,可用于净水,故A项正确;Fe2O3呈红棕色,可用作红色油漆和涂料,Fe3O4具有磁性,故B项错误;NaHCO3水溶液显碱性,发面用的发酵粉中含有酸性物质,发面时加入的NaHCO3能够与酸反应产生二氧化碳气体,使糕点蓬松,口感好,C项正确;过氧化钠与水、二氧化碳反应都生成氧气,故可用作供氧剂,D项正确。
9. (1) 加足量铁粉,过滤 2Fe3++Fe===3Fe2+ (2) 加热 2Fe(OH)3Fe2O3+3H2O (3) 加足量铁粉,过滤 Cu2++Fe===Fe2++Cu (4) 通入氯气 2Fe2++Cl2===2Fe3++2Cl-
10. (1) 浅绿色溶液转变成棕黄色 2Fe2++Cl2===2Fe3++2Cl- (2) 溶液变为血红色 (3) 有无色无味气体产生,有红褐色沉淀生成 2Na+2H2O===2Na++2OH-+H2↑ Fe3++3OH-===Fe(OH)3↓ (4) 溶液变蓝色 2Fe3++2I-===2Fe2++I2
11. (1) 取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品变质,若溶液不呈血红色,则未变质 (2) 在溶液中加入少量还原铁粉 [解析] (1) 由题意可知,硫酸亚铁变质即为亚铁离子被空气中的氧气氧化为三价铁离子,故只需检验三价铁离子的存在即可检验其是否变质。(2) 因为三价铁离子与铁发生反应生成亚铁离子,故可向溶液中加入还原铁粉来除去杂质。
12. (1) Fe HCl (2) 2Fe2++Cl2===2Fe3++2Cl- H2+Cl22HCl
13. C [解析] 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜,工业废水中加入的试剂a是铁,操作Ⅰ为过滤,得到的滤渣Y为Fe、Cu,滤液X为FeCl2溶液;滤渣Y中加入的试剂b为盐酸,溶解过量的铁生成FeCl2溶液,铜不溶,操作Ⅱ过滤得到铜和滤液Z(含FeCl2);滤液Z和X合并通入氯气,FeCl2被氧化为FeCl3,蒸发结晶、过滤、洗涤、干燥,得到氯化铁晶体。A项,b为盐酸,若为硫酸会引入硫酸根杂质离子,故A错误;B项,由上述分析可知,操作Ⅰ、Ⅱ是过滤,操作Ⅲ是蒸发结晶、过滤,所用仪器不同,故B错误;C项,滤液X、滤液Z中均含有FeCl2,c为氯气,反应为2Fe2++Cl2===2Cl-+2Fe3+,故C正确;D项,KSCN溶液可检验溶液中是否含有Fe3+,故D错误。
1. 高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。其中铁元素的化合价为( )
A. 0 B. +2
C. +6 D. +8
2. 将铁屑溶于过量盐酸后,再加下列物质,会有三价铁生成的是( )
A. 稀硫酸 B. 氯水
C. 氯化锌 D. 氯化铜
3. 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )
A. FeO B. Fe2O3
C. Fe3O4 D. Fe2(SO4)3
4. 人体正常的血红蛋白中应含有Fe2+,若误食亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒,服用维生素C可以解除亚硝酸盐中毒,下列叙述正确的是( )
A. 亚硝酸盐是还原剂 B. 维生素C是氧化剂
C. 维生素C将Fe3+转化成Fe2+ D. 亚硝酸盐被氧化
5. 下列实验方案能达到目的的是( )
A. 用排水集气法收集HCl气体
B. 用燃烧的木条检验N2和CO2
C. 用KSCN溶液检验溶液中的Fe3+
D. 用丁达尔效应鉴别Na2CO3溶液和NaHCO3溶液
6. 只用一种试剂就可将AgNO3、KSCN、H2SO4、NaOH四种无色溶液区分开,这种试剂是( )
A. BaCl2溶液 B. FeCl2溶液
C. FeCl3溶液 D. Fe(NO3)3溶液
7. 铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量的双氧水,再加入过量的氨水,有红褐色的沉淀生成。过滤、加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别是( )
A. Fe(OH)3;Fe2O3 B. Fe(OH)2;FeO
C. Fe(OH)2;Fe(OH)3、Fe3O4 D. Fe2O3;Fe(OH)3
8. 下列有关物质用途的说法中,错误的是( )
A. 氢氧化铁胶体可以净水 B. Fe3O4用作红色油漆和涂料
C. NaHCO3用于烘焙糕点 D. Na2O2用作供氧剂
9. 只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),写出试剂或操作的名称、方法及有关的离子方程式。
物质(括号内为杂质) 加入试剂和操作 离子方程式
(1) FeCl2溶液(FeCl3)
(2) Fe2O3[Fe(OH)3]
(3) FeSO4溶液(CuSO4)
(4) FeCl3溶液(FeCl2)
10. 对铁的氯化物溶液进行下图所示的实验。
(1) 甲中现象: ______________________。离子方程式: 。
(2) 乙中现象: ________________。
(3) 丙中现象: 。
离子方程式: ______________________________,________________________________。
(4) 丁中现象: ______________________________________________。离子方程式: 。
11. 有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质。
(1) 请你设计一个检验硫酸亚铁是否变质的实验方案:
_________________________________________________________________________。
(2) 如果已经变质,应如何复原?
_______________________________________________________________________。
12. A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。已知A是常见的变价金属的单质,D、F是气态单质,且D能在F中燃烧,发出苍白色火焰;反应①、②在水溶液中进行。
(1) 写出A、B的化学式: A________,B________。
(2) 写出反应②的离子方程式: ___________________________________________。
写出反应④的化学方程式: _____________________________________________。
13. 从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
答案与解析
第3课时 铁盐和亚铁盐
1. C
2. B [解析] Fe溶于盐酸后发生反应,Fe+2H+===Fe2++H2↑,而Fe2+遇强氧化剂才会生成三价铁。
3. A [解析] Fe3O4与HCl反应,既有FeCl3生成,又有FeCl2生成。
4. C [解析] 解除亚硝酸盐中毒就是把Fe3+再转化成Fe2+。
5. C
6. C [解析] 现象分别为: 白色沉淀、血红色溶液、无明显变化、红褐色沉淀。
7. A [解析] 铁屑与稀硫酸反应生成Fe2+,加双氧水后氧化为Fe3+,加氨水后生成Fe(OH)3,加热灼烧后分解为Fe2O3。
8. B [解析] 氢氧化铁胶体可以聚沉水中悬浮物,可用于净水,故A项正确;Fe2O3呈红棕色,可用作红色油漆和涂料,Fe3O4具有磁性,故B项错误;NaHCO3水溶液显碱性,发面用的发酵粉中含有酸性物质,发面时加入的NaHCO3能够与酸反应产生二氧化碳气体,使糕点蓬松,口感好,C项正确;过氧化钠与水、二氧化碳反应都生成氧气,故可用作供氧剂,D项正确。
9. (1) 加足量铁粉,过滤 2Fe3++Fe===3Fe2+ (2) 加热 2Fe(OH)3Fe2O3+3H2O (3) 加足量铁粉,过滤 Cu2++Fe===Fe2++Cu (4) 通入氯气 2Fe2++Cl2===2Fe3++2Cl-
10. (1) 浅绿色溶液转变成棕黄色 2Fe2++Cl2===2Fe3++2Cl- (2) 溶液变为血红色 (3) 有无色无味气体产生,有红褐色沉淀生成 2Na+2H2O===2Na++2OH-+H2↑ Fe3++3OH-===Fe(OH)3↓ (4) 溶液变蓝色 2Fe3++2I-===2Fe2++I2
11. (1) 取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品变质,若溶液不呈血红色,则未变质 (2) 在溶液中加入少量还原铁粉 [解析] (1) 由题意可知,硫酸亚铁变质即为亚铁离子被空气中的氧气氧化为三价铁离子,故只需检验三价铁离子的存在即可检验其是否变质。(2) 因为三价铁离子与铁发生反应生成亚铁离子,故可向溶液中加入还原铁粉来除去杂质。
12. (1) Fe HCl (2) 2Fe2++Cl2===2Fe3++2Cl- H2+Cl22HCl
13. C [解析] 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜,工业废水中加入的试剂a是铁,操作Ⅰ为过滤,得到的滤渣Y为Fe、Cu,滤液X为FeCl2溶液;滤渣Y中加入的试剂b为盐酸,溶解过量的铁生成FeCl2溶液,铜不溶,操作Ⅱ过滤得到铜和滤液Z(含FeCl2);滤液Z和X合并通入氯气,FeCl2被氧化为FeCl3,蒸发结晶、过滤、洗涤、干燥,得到氯化铁晶体。A项,b为盐酸,若为硫酸会引入硫酸根杂质离子,故A错误;B项,由上述分析可知,操作Ⅰ、Ⅱ是过滤,操作Ⅲ是蒸发结晶、过滤,所用仪器不同,故B错误;C项,滤液X、滤液Z中均含有FeCl2,c为氯气,反应为2Fe2++Cl2===2Cl-+2Fe3+,故C正确;D项,KSCN溶液可检验溶液中是否含有Fe3+,故D错误。
