2023秋高中化学人教版2019必修1 第四章 物质结构 元素周期律 第2节 第2课时 第三周期元素递变性实验探究 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第四章 物质结构 元素周期律 第2节 第2课时 第三周期元素递变性实验探究 课时同步练(含答案) |

|
|
| 格式 | DOC | ||
| 文件大小 | 109.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 22:42:33 | ||
图片预览


文档简介
第2课时 第三周期元素递变性实验探究
1. Mg和Si都属于元素周期表第三周期元素,它们原子结构中相同的是( )
A. 质子数 B. 电子层数
C. 核外电子数 D. 最外层电子数
2. 下列递变规律错误的是( )
A. HClO4、H2SO4、H3PO4的酸性依次增强
B. 钠、镁、铝的还原性依次减弱
C. HCl、H2S、PH3的稳定性依次减弱
D. P、S、Cl三种元素的最高正化合价依次升高
3. 第三周期的X、Y、Z三种元素,已知它们的气态氢化物分别是HX、H2Y、ZH3,则下列判断错误的是( )
A. 稳定性: HX>H2Y>ZH3 B. 还原性: HX>H2Y>ZH3
C. 酸性: H3ZO4<H2YO4<HXO4 D. 非金属性: X>Y>Z
4. 下列排列顺序错误的是( )
A. 原子半径: 钠>硫>氯
B. 最高价氧化物对应水化物的酸性: HClO4>H2SO4>H3PO4
C. 最高正化合价: 氯>硫>磷
D. 稳定性: 碘化氢>溴化氢>氯化氢
5. 下列递变规律正确的是( )
A. O、S、Na、K的原子半径依次增大
B. KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性依次增强
C. Na、Mg、Al、Si的还原性依次增强
D. HF、HCl、H2S、PH3的稳定性依次增强
6. 下列叙述中,能肯定A金属比B金属活泼性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子的电子层数比B原子的电子层数多
C. 1mol A从酸中置换出的H2比1mol B从酸中置换出的H2多
D. 常温时,A能从水中置换出H2,而B不能
7. 已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A. 气态氢化物的稳定性: HX>H2Y>ZH3
B. 非金属活泼性: Y<X<Z
C. 原子半径: X>Y>Z
D. 原子最外层电子数: X<Y<Z
8. 下列说法中正确的是( )
A. C、N、O、F的原子半径依次增大
B. PH3、H2S、HCl的稳定性依次增强
C. HClO比H2SO4酸性强
D. 甲、乙两种非金属元素与金属钠反应时,甲得电子的数目多,所以甲活泼
9. 在第三周期元素中,除稀有气体元素外:
(1) 原子半径最小的元素是______(填元素符号)。(2) 金属性最强的元素是________(填元素符号)。
(3) 最高价氧化物对应水化物的酸性最强的是________(用化学式回答,下同)。
(4) 最不稳定的气态氢化物是________。(5) 氧化物中具有两性的是________。
(6) 最高价氧化物对应水化物的碱性最强的是________。
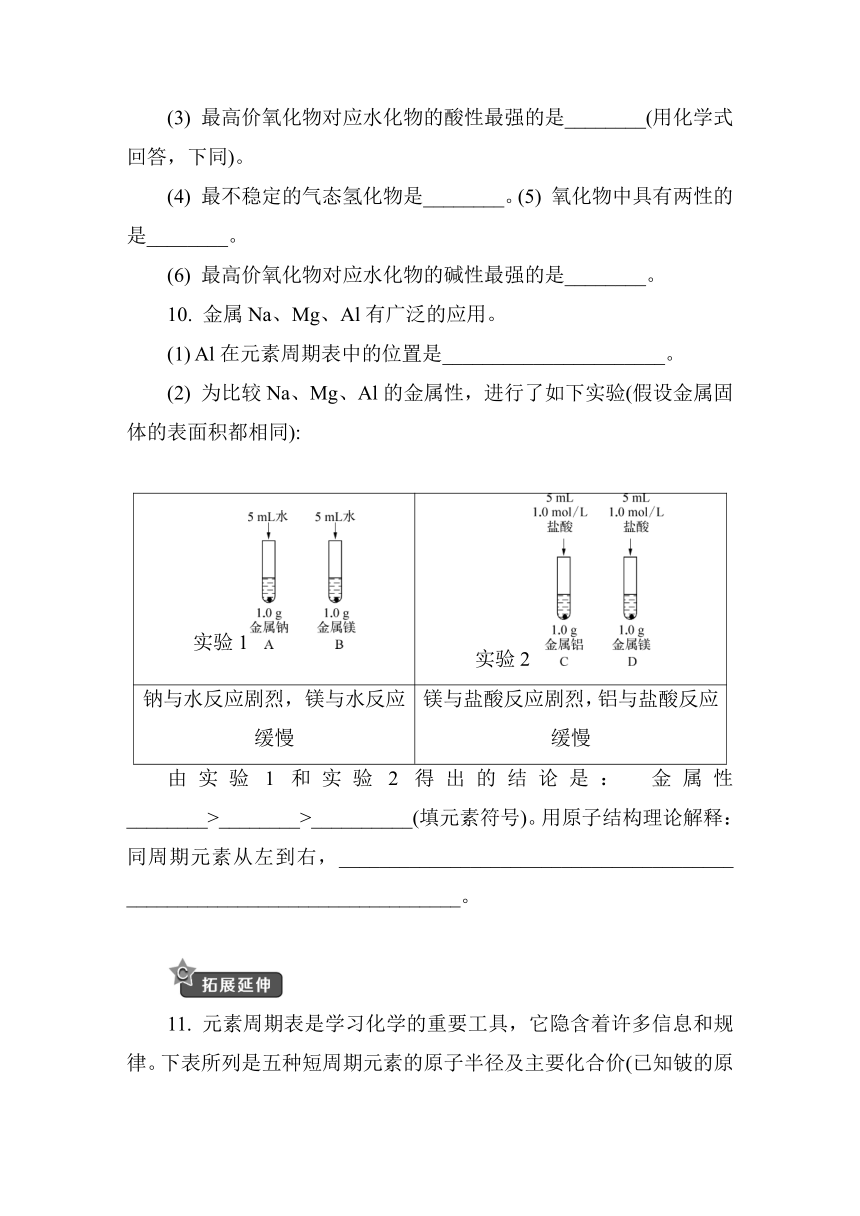
10. 金属Na、Mg、Al有广泛的应用。
(1) Al在元素周期表中的位置是______________________。
(2) 为比较Na、Mg、Al的金属性,进行了如下实验(假设金属固体的表面积都相同):
实验1 实验2
钠与水反应剧烈,镁与水反应缓慢 镁与盐酸反应剧烈,铝与盐酸反应缓慢
由实验1和实验2得出的结论是: 金属性________>________>__________(填元素符号)。用原子结构理论解释: 同周期元素从左到右,_______________________________________ _________________________________。
11. 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm):
元素代号 A B C D E
原子半径/nm 0.16 0.143 0.102 0.099 0.074
主要化合价 +2 +3 +6、-2 +7、-1 -2
(1) 用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
(2) B元素处于周期表中第______周期第______族。
(3) B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为________________________________________。
(4) 上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式)。
(5) C、E形成的化合物为________(填化学式)。
答案与解析
第2课时 第三周期元素递变性实验探究
1. B
2. A [解析] 第三周期由左到右,随着原子序数递增,金属性减弱、非金属性增强。
3. B [解析] 第三周期的三种元素的氢化物HX、H2Y、ZH3,可以认为是氯、硫、磷三种元素,非金属性依次递减。
4. D [解析] 第三周期元素随着原子序数递增,金属性减弱、非金属性增强;卤族元素由上而下非金属性减弱,其简单气态氢化物的稳定性减弱。
5. A [解析] 同周期元素由左到右,原子半径减小、金属性依次减弱、非金属性依次增强;同主族元素由上而下,原子半径增加、金属性依次增强、非金属性依次减弱。
6. D [解析] 借鉴第三周期金属钠与金属铝的金属性对比方法,可知A选项错误;金属锂的电子层数少于金属铝,但金属锂的金属性强于金属铝;1mol金属铝与酸反应生成的气体多于1mol金属镁,但金属铝的金属性弱于金属镁。
7. A [解析] 由最高价氧化物对应水化物酸性的强弱可知X、Y、Z三种元素的非金属性顺序为X>Y>Z,且原子序数为Z、Y、X依次递增。
8. B [解析] 同周期元素随着原子序数的递增,原子半径减小;B选项为磷、硫、氯三种元素非金属性强弱判断;非金属元素最高价氧化物对应水化物酸性的强弱,可以作为非金属性对比的依据;元素氧化性强弱与得电子数目多少无关,与得电子能力有关。
9. (1) Cl (2) Na (3) HClO4 (4) SiH4 (5) Al2O3 (6) NaOH
10. (1) 第三周期第ⅢA族 (2) Na Mg Al 原子半径逐渐减小,失电子能力逐渐减弱
11. (1)
(2) 三 ⅢA (3) Al(OH)3+3H+===Al3++3H2O (4) HClO4 (5) SO2、SO3(写出1个即可)
1. Mg和Si都属于元素周期表第三周期元素,它们原子结构中相同的是( )
A. 质子数 B. 电子层数
C. 核外电子数 D. 最外层电子数
2. 下列递变规律错误的是( )
A. HClO4、H2SO4、H3PO4的酸性依次增强
B. 钠、镁、铝的还原性依次减弱
C. HCl、H2S、PH3的稳定性依次减弱
D. P、S、Cl三种元素的最高正化合价依次升高
3. 第三周期的X、Y、Z三种元素,已知它们的气态氢化物分别是HX、H2Y、ZH3,则下列判断错误的是( )
A. 稳定性: HX>H2Y>ZH3 B. 还原性: HX>H2Y>ZH3
C. 酸性: H3ZO4<H2YO4<HXO4 D. 非金属性: X>Y>Z
4. 下列排列顺序错误的是( )
A. 原子半径: 钠>硫>氯
B. 最高价氧化物对应水化物的酸性: HClO4>H2SO4>H3PO4
C. 最高正化合价: 氯>硫>磷
D. 稳定性: 碘化氢>溴化氢>氯化氢
5. 下列递变规律正确的是( )
A. O、S、Na、K的原子半径依次增大
B. KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性依次增强
C. Na、Mg、Al、Si的还原性依次增强
D. HF、HCl、H2S、PH3的稳定性依次增强
6. 下列叙述中,能肯定A金属比B金属活泼性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子的电子层数比B原子的电子层数多
C. 1mol A从酸中置换出的H2比1mol B从酸中置换出的H2多
D. 常温时,A能从水中置换出H2,而B不能
7. 已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A. 气态氢化物的稳定性: HX>H2Y>ZH3
B. 非金属活泼性: Y<X<Z
C. 原子半径: X>Y>Z
D. 原子最外层电子数: X<Y<Z
8. 下列说法中正确的是( )
A. C、N、O、F的原子半径依次增大
B. PH3、H2S、HCl的稳定性依次增强
C. HClO比H2SO4酸性强
D. 甲、乙两种非金属元素与金属钠反应时,甲得电子的数目多,所以甲活泼
9. 在第三周期元素中,除稀有气体元素外:
(1) 原子半径最小的元素是______(填元素符号)。(2) 金属性最强的元素是________(填元素符号)。
(3) 最高价氧化物对应水化物的酸性最强的是________(用化学式回答,下同)。
(4) 最不稳定的气态氢化物是________。(5) 氧化物中具有两性的是________。
(6) 最高价氧化物对应水化物的碱性最强的是________。
10. 金属Na、Mg、Al有广泛的应用。
(1) Al在元素周期表中的位置是______________________。
(2) 为比较Na、Mg、Al的金属性,进行了如下实验(假设金属固体的表面积都相同):
实验1 实验2
钠与水反应剧烈,镁与水反应缓慢 镁与盐酸反应剧烈,铝与盐酸反应缓慢
由实验1和实验2得出的结论是: 金属性________>________>__________(填元素符号)。用原子结构理论解释: 同周期元素从左到右,_______________________________________ _________________________________。
11. 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm):
元素代号 A B C D E
原子半径/nm 0.16 0.143 0.102 0.099 0.074
主要化合价 +2 +3 +6、-2 +7、-1 -2
(1) 用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
(2) B元素处于周期表中第______周期第______族。
(3) B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为________________________________________。
(4) 上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式)。
(5) C、E形成的化合物为________(填化学式)。
答案与解析
第2课时 第三周期元素递变性实验探究
1. B
2. A [解析] 第三周期由左到右,随着原子序数递增,金属性减弱、非金属性增强。
3. B [解析] 第三周期的三种元素的氢化物HX、H2Y、ZH3,可以认为是氯、硫、磷三种元素,非金属性依次递减。
4. D [解析] 第三周期元素随着原子序数递增,金属性减弱、非金属性增强;卤族元素由上而下非金属性减弱,其简单气态氢化物的稳定性减弱。
5. A [解析] 同周期元素由左到右,原子半径减小、金属性依次减弱、非金属性依次增强;同主族元素由上而下,原子半径增加、金属性依次增强、非金属性依次减弱。
6. D [解析] 借鉴第三周期金属钠与金属铝的金属性对比方法,可知A选项错误;金属锂的电子层数少于金属铝,但金属锂的金属性强于金属铝;1mol金属铝与酸反应生成的气体多于1mol金属镁,但金属铝的金属性弱于金属镁。
7. A [解析] 由最高价氧化物对应水化物酸性的强弱可知X、Y、Z三种元素的非金属性顺序为X>Y>Z,且原子序数为Z、Y、X依次递增。
8. B [解析] 同周期元素随着原子序数的递增,原子半径减小;B选项为磷、硫、氯三种元素非金属性强弱判断;非金属元素最高价氧化物对应水化物酸性的强弱,可以作为非金属性对比的依据;元素氧化性强弱与得电子数目多少无关,与得电子能力有关。
9. (1) Cl (2) Na (3) HClO4 (4) SiH4 (5) Al2O3 (6) NaOH
10. (1) 第三周期第ⅢA族 (2) Na Mg Al 原子半径逐渐减小,失电子能力逐渐减弱
11. (1)
(2) 三 ⅢA (3) Al(OH)3+3H+===Al3++3H2O (4) HClO4 (5) SO2、SO3(写出1个即可)
