2023秋高中化学人教版2019必修1 第四章 物质结构 元素周期律 第2节 第3课时 元素周期表和元素周期律的应用 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第四章 物质结构 元素周期律 第2节 第3课时 元素周期表和元素周期律的应用 课时同步练(含答案) |

|
|
| 格式 | DOC | ||
| 文件大小 | 142.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 22:43:59 | ||
图片预览


文档简介
第3课时 元素周期表和元素周期律的应用
1. 元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A. 同一元素的氧化物,不可能既可以表现酸性氧化物的性质,又可以表现碱性氧化物的性质
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构
D. 同一主族元素的原子,最外层电子数相同,化学性质完全相同
2. 锗(Ge)是第四周期第ⅣA元素,处于周期表中金属区与非金属区的交界处。下列叙述正确的是( )
A. 锗是一种金属性很强的元素 B. 锗是优良的半导体材料
C. 锗化氢(GeH4)的稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
3. 判断Cl元素的非金属性比S元素的强,可依据的事实是( )
A. HCl的热稳定性比H2S的强
B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态
D. AgCl是白色固体,Ag2S是黑色固体
4. R、W、X、Y、Z为原子序数依次递增的同一短周期元素。下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)n+1也为强碱
B. 若HnXOm为强酸,则Y是活泼非金属元素
C. 若Y的最低化合价为-2,则Z的最高正化合价为+6
D. 若X的最高正化合价为+5,则五种元素都是非金属元素
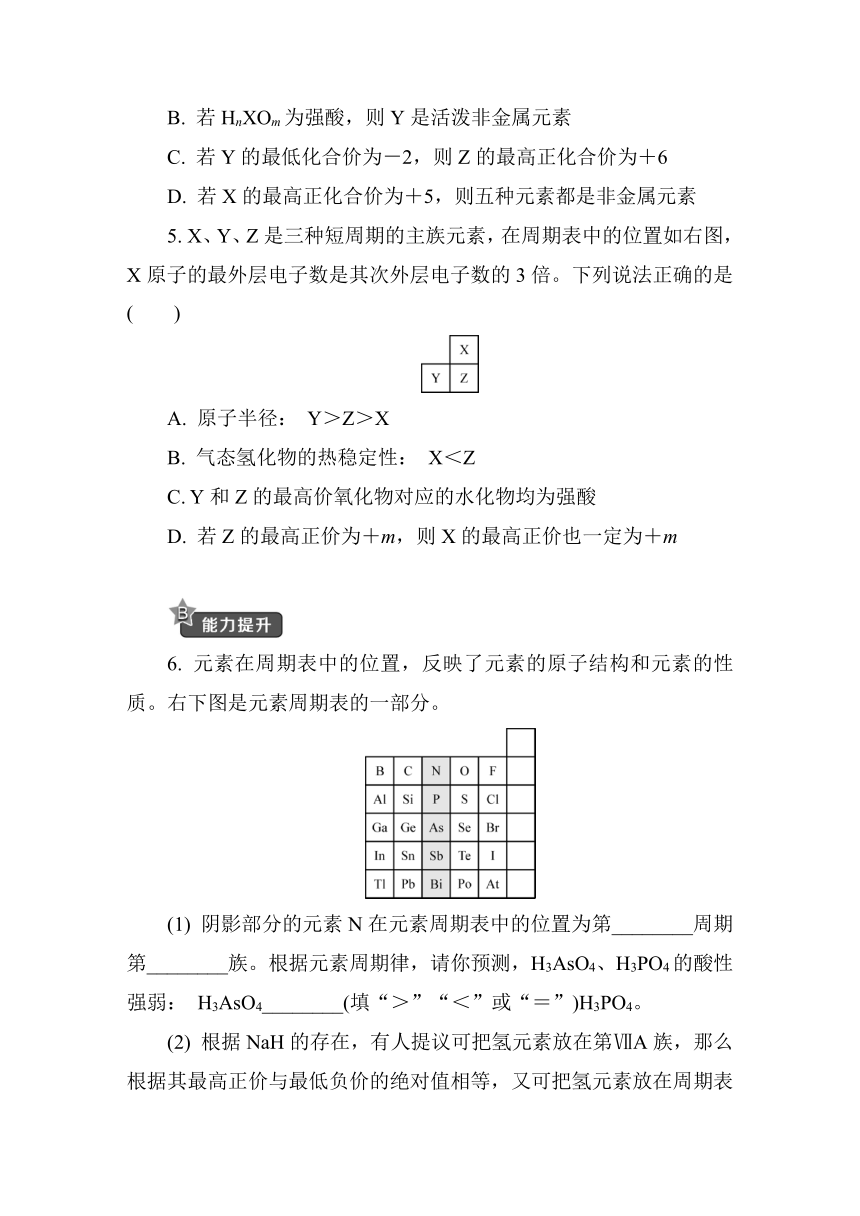
5. X、Y、Z是三种短周期的主族元素,在周期表中的位置如右图,X原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是( )
A. 原子半径: Y>Z>X
B. 气态氢化物的热稳定性: X<Z
C. Y和Z的最高价氧化物对应的水化物均为强酸
D. 若Z的最高正价为+m,则X的最高正价也一定为+m
6. 元素在周期表中的位置,反映了元素的原子结构和元素的性质。右下图是元素周期表的一部分。
(1) 阴影部分的元素N在元素周期表中的位置为第________周期第________族。根据元素周期律,请你预测,H3AsO4、H3PO4的酸性强弱: H3AsO4________(填“>”“<”或“=”)H3PO4。
(2) 根据NaH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第________族。
(3) 元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为________________________________________________________。
(4) 周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为________(填字母)。
A. 硫 B. 砷
C. 硒 D. 硅
7. 有A、B、C、D四种元素,A的最高正价与其最低负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为0;C2-与氩原子具有相同的电子层结构。
(1) 试写出上述各元素的符号: A________,B________,C________,D________。
(2) 画出下列粒子的结构示意图: A________________,C2-________________。
(3) 元素A、C、D形成简单离子的半径由大到小的顺序是________________。(写离子符号)
(4) 写出A、D的最高价氧化物对应水化物反应的化学方程式: ________________________________________________________________________。
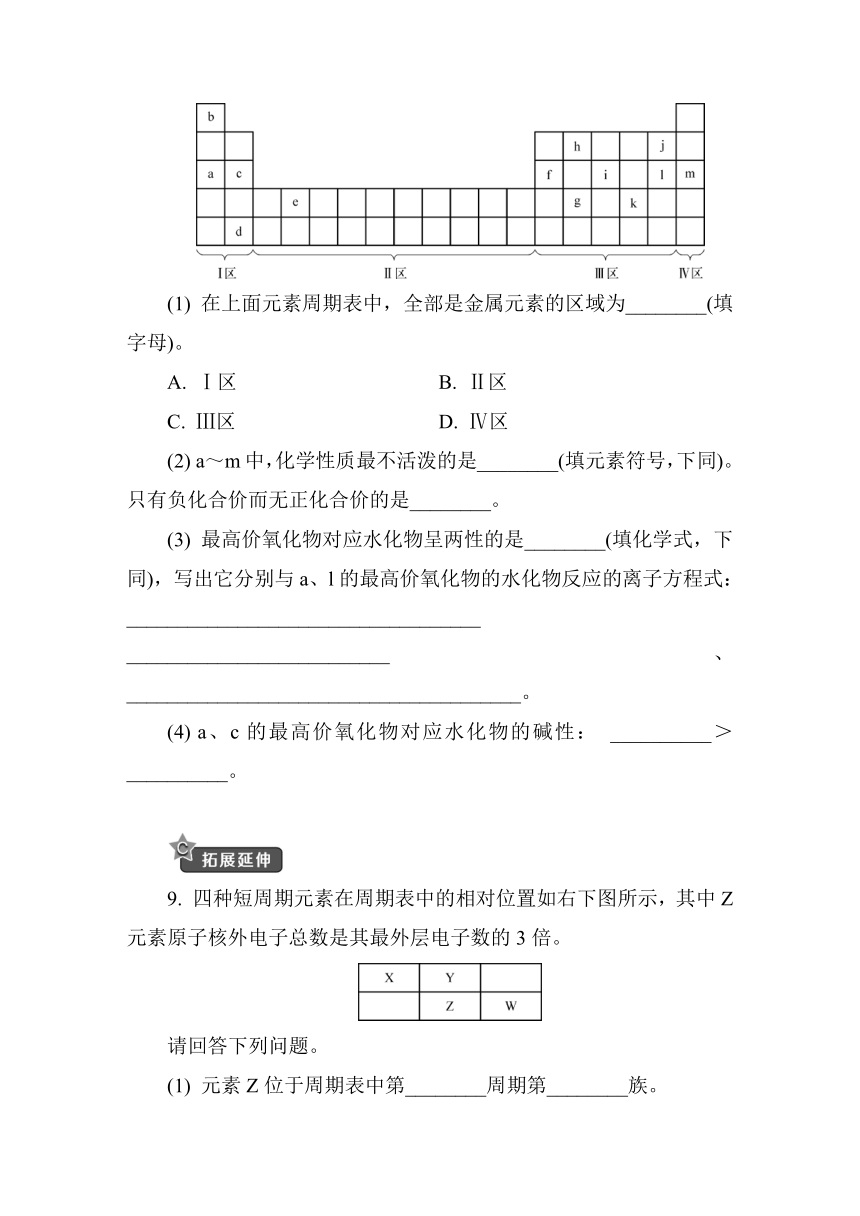
8. 根据元素周期表回答下列问题:
(1) 在上面元素周期表中,全部是金属元素的区域为________(填字母)。
A. Ⅰ区 B. Ⅱ区
C. Ⅲ区 D. Ⅳ区
(2) a~m中,化学性质最不活泼的是________(填元素符号,下同)。只有负化合价而无正化合价的是________。
(3) 最高价氧化物对应水化物呈两性的是________(填化学式,下同),写出它分别与a、l的最高价氧化物的水化物反应的离子方程式: ___________________________________ __________________________、_______________________________________。
(4) a、c的最高价氧化物对应水化物的碱性: __________>__________。
9. 四种短周期元素在周期表中的相对位置如右下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题。
(1) 元素Z位于周期表中第________周期第________族。
(2) 这些元素的氢化物中,水溶液碱性最强的是________(写化学式)。
(3) Y的最高价氧化物的化学式为________。
(4) W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为________。
答案与解析
第3课时 元素周期表和元素周期律的应用
1. B [解析] 处于元素周期表金属与非金属分界线附近的Al元素,其氧化物Al2O3是两性氧化物,A项错误;主族元素(F、O除外)的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B项正确;H+的最外层电子数是0,C项错误;同一主族元素的原子最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不完全相同,D项错误。
2. B [解析] 锗元素位于元素周期表中金属区和非金属区的交界处,故其既有金属性又有非金属性,但其金属性和非金属性均较弱,故A、C、D项错误;其单质为半导体材料。
3. A
4. B [解析] 若R为Na,W为Mg,NaOH是强碱,而Mg(OH)2不是强碱,A项错。HnXOm是强酸,说明X是活泼的非金属元素,根据在周期表中的位置,非金属性Y强于X,故Y也是活泼的非金属元素,B项正确。Y的最低化合价为-2,Z的最低化合价可能为-1,最高正化合价可能为+7,而不是+6,C项错。X的最高正化合价为+5,说明X位于第ⅤA族,R则可能位于第ⅢA族,可能为金属元素,D项错。
5. A [解析] X原子的最外层电子数是其次外层电子数的3倍,X为O,则Z为S,Y为P。原子半径P>S>O,A项正确。气态氢化物的稳定性H2O>H2S,B项错。Y的最高价氧化物对应的水化物为H3PO4,不是强酸,C项错。S元素有最高正价+6,而O元素无+6价,D项错。
6. (1) 二 ⅤA < (2) ⅣA (3) Al3++3NH3·H2O===Al(OH)3↓+3NH (4) C [解析] (2) 由NaH知,氢元素最低负价为-1,而氢元素的最高正价为+1,因此与第ⅣA族元素的化合价特点相似,可将氢元素放在第ⅣA族。 (3) 第三周期原子半径最小的金属元素是铝,Al3+可与NH3·H2O反应产生Al(OH)3沉淀,且沉淀不溶于氨水。 (4) 根据R元素的原子结构(电子层数)和RO3,依据题给元素周期表可推知R元素为硒。
7. (1) Cl C S K (2) (3) S2->Cl->K+ (4) HClO4+KOH===KClO4+H2O [解析] 因为“A的最高正价与其最低负价的绝对值之差为6”,确定A为氯(Cl);“B有两个电子层,最高正价与最低负价的代数和为0”,确定B为碳(C);C2-的结构示意图为,确定C为硫(S);再由A推出D为钾(K)。
8. (1) B (2) Ar F (3) Al(OH)3 Al(OH)3+OH-===AlO+2H2O Al(OH)3+3H+===Al3++3H2O (4) NaOH Mg(OH)2 [解析] (1) 根据元素周期表的分布规律,Ⅱ区的所有元素均为金属元素。(2) 依据原子核外电子排布规律,可以推知化学性质最不活泼的是Ar,只有负化合价而无正化合价的是F。(3) 根据铝的氢氧化物呈两性,得出氢氧化铝既可以与酸反应,也可以与强碱反应。(4) 依据元素周期律,同一周期,从左到右元素最高价氧化物的碱性逐渐减弱,由此可以得出,最高价氧化物对应水化物的碱性: NaOH>Mg(OH)2。
9. (1) 三 ⅤA (2) NH3 (3) N2O5 (4) S4N4 [解析] Z元素原子核外电子总数是其最外层电子数的3倍,根据图示,设Z的核外电子排布为2、8、a,则10+a=3a, a=5,Z为第15号元素P,则X、Y、W分别为C、N、S。 (4) W为S,Y为N,设该化合物为SxNy,根据题意有=0.7 ①, 170<(32x+14y)<190 ②。由①式解得x∶y≈1,代入②式,解得x=4,则y=4,该化合物为S4N4。
1. 元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A. 同一元素的氧化物,不可能既可以表现酸性氧化物的性质,又可以表现碱性氧化物的性质
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构
D. 同一主族元素的原子,最外层电子数相同,化学性质完全相同
2. 锗(Ge)是第四周期第ⅣA元素,处于周期表中金属区与非金属区的交界处。下列叙述正确的是( )
A. 锗是一种金属性很强的元素 B. 锗是优良的半导体材料
C. 锗化氢(GeH4)的稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
3. 判断Cl元素的非金属性比S元素的强,可依据的事实是( )
A. HCl的热稳定性比H2S的强
B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态
D. AgCl是白色固体,Ag2S是黑色固体
4. R、W、X、Y、Z为原子序数依次递增的同一短周期元素。下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)n+1也为强碱
B. 若HnXOm为强酸,则Y是活泼非金属元素
C. 若Y的最低化合价为-2,则Z的最高正化合价为+6
D. 若X的最高正化合价为+5,则五种元素都是非金属元素
5. X、Y、Z是三种短周期的主族元素,在周期表中的位置如右图,X原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是( )
A. 原子半径: Y>Z>X
B. 气态氢化物的热稳定性: X<Z
C. Y和Z的最高价氧化物对应的水化物均为强酸
D. 若Z的最高正价为+m,则X的最高正价也一定为+m
6. 元素在周期表中的位置,反映了元素的原子结构和元素的性质。右下图是元素周期表的一部分。
(1) 阴影部分的元素N在元素周期表中的位置为第________周期第________族。根据元素周期律,请你预测,H3AsO4、H3PO4的酸性强弱: H3AsO4________(填“>”“<”或“=”)H3PO4。
(2) 根据NaH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第________族。
(3) 元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为________________________________________________________。
(4) 周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为________(填字母)。
A. 硫 B. 砷
C. 硒 D. 硅
7. 有A、B、C、D四种元素,A的最高正价与其最低负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为0;C2-与氩原子具有相同的电子层结构。
(1) 试写出上述各元素的符号: A________,B________,C________,D________。
(2) 画出下列粒子的结构示意图: A________________,C2-________________。
(3) 元素A、C、D形成简单离子的半径由大到小的顺序是________________。(写离子符号)
(4) 写出A、D的最高价氧化物对应水化物反应的化学方程式: ________________________________________________________________________。
8. 根据元素周期表回答下列问题:
(1) 在上面元素周期表中,全部是金属元素的区域为________(填字母)。
A. Ⅰ区 B. Ⅱ区
C. Ⅲ区 D. Ⅳ区
(2) a~m中,化学性质最不活泼的是________(填元素符号,下同)。只有负化合价而无正化合价的是________。
(3) 最高价氧化物对应水化物呈两性的是________(填化学式,下同),写出它分别与a、l的最高价氧化物的水化物反应的离子方程式: ___________________________________ __________________________、_______________________________________。
(4) a、c的最高价氧化物对应水化物的碱性: __________>__________。
9. 四种短周期元素在周期表中的相对位置如右下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题。
(1) 元素Z位于周期表中第________周期第________族。
(2) 这些元素的氢化物中,水溶液碱性最强的是________(写化学式)。
(3) Y的最高价氧化物的化学式为________。
(4) W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为________。
答案与解析
第3课时 元素周期表和元素周期律的应用
1. B [解析] 处于元素周期表金属与非金属分界线附近的Al元素,其氧化物Al2O3是两性氧化物,A项错误;主族元素(F、O除外)的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B项正确;H+的最外层电子数是0,C项错误;同一主族元素的原子最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不完全相同,D项错误。
2. B [解析] 锗元素位于元素周期表中金属区和非金属区的交界处,故其既有金属性又有非金属性,但其金属性和非金属性均较弱,故A、C、D项错误;其单质为半导体材料。
3. A
4. B [解析] 若R为Na,W为Mg,NaOH是强碱,而Mg(OH)2不是强碱,A项错。HnXOm是强酸,说明X是活泼的非金属元素,根据在周期表中的位置,非金属性Y强于X,故Y也是活泼的非金属元素,B项正确。Y的最低化合价为-2,Z的最低化合价可能为-1,最高正化合价可能为+7,而不是+6,C项错。X的最高正化合价为+5,说明X位于第ⅤA族,R则可能位于第ⅢA族,可能为金属元素,D项错。
5. A [解析] X原子的最外层电子数是其次外层电子数的3倍,X为O,则Z为S,Y为P。原子半径P>S>O,A项正确。气态氢化物的稳定性H2O>H2S,B项错。Y的最高价氧化物对应的水化物为H3PO4,不是强酸,C项错。S元素有最高正价+6,而O元素无+6价,D项错。
6. (1) 二 ⅤA < (2) ⅣA (3) Al3++3NH3·H2O===Al(OH)3↓+3NH (4) C [解析] (2) 由NaH知,氢元素最低负价为-1,而氢元素的最高正价为+1,因此与第ⅣA族元素的化合价特点相似,可将氢元素放在第ⅣA族。 (3) 第三周期原子半径最小的金属元素是铝,Al3+可与NH3·H2O反应产生Al(OH)3沉淀,且沉淀不溶于氨水。 (4) 根据R元素的原子结构(电子层数)和RO3,依据题给元素周期表可推知R元素为硒。
7. (1) Cl C S K (2) (3) S2->Cl->K+ (4) HClO4+KOH===KClO4+H2O [解析] 因为“A的最高正价与其最低负价的绝对值之差为6”,确定A为氯(Cl);“B有两个电子层,最高正价与最低负价的代数和为0”,确定B为碳(C);C2-的结构示意图为,确定C为硫(S);再由A推出D为钾(K)。
8. (1) B (2) Ar F (3) Al(OH)3 Al(OH)3+OH-===AlO+2H2O Al(OH)3+3H+===Al3++3H2O (4) NaOH Mg(OH)2 [解析] (1) 根据元素周期表的分布规律,Ⅱ区的所有元素均为金属元素。(2) 依据原子核外电子排布规律,可以推知化学性质最不活泼的是Ar,只有负化合价而无正化合价的是F。(3) 根据铝的氢氧化物呈两性,得出氢氧化铝既可以与酸反应,也可以与强碱反应。(4) 依据元素周期律,同一周期,从左到右元素最高价氧化物的碱性逐渐减弱,由此可以得出,最高价氧化物对应水化物的碱性: NaOH>Mg(OH)2。
9. (1) 三 ⅤA (2) NH3 (3) N2O5 (4) S4N4 [解析] Z元素原子核外电子总数是其最外层电子数的3倍,根据图示,设Z的核外电子排布为2、8、a,则10+a=3a, a=5,Z为第15号元素P,则X、Y、W分别为C、N、S。 (4) W为S,Y为N,设该化合物为SxNy,根据题意有=0.7 ①, 170<(32x+14y)<190 ②。由①式解得x∶y≈1,代入②式,解得x=4,则y=4,该化合物为S4N4。
