2023秋高中化学人教版2019必修1 第四章 物质结构 元素周期律 第2节 第1课时 元素性质的周期性变化规律 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第四章 物质结构 元素周期律 第2节 第1课时 元素性质的周期性变化规律 课时同步练(含答案) |  | |
| 格式 | DOC | ||
| 文件大小 | 179.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-12 22:54:15 | ||
图片预览


文档简介
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1. 原子序数从11依次增加到17,下列所述递变关系错误的是( )
A. 电子层数逐渐增多 B. 原子半径逐渐减小
C. 最高正价数值逐渐增大 D. 从硅到氯负价从-4→-1
2. 下列有关主族元素的说法中,肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
3. 下列各组元素性质的递变情况,错误的是( )
A. H、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次升高
C. C、N、O、F原子半径依次增大
D. Li、Na、K、Rb的金属性依次增强
4. 元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素为( )
A. Al B. P
C. Ar D. K
5. 下列粒子半径大小比较,正确的是( )
A. 原子半径: F>Cl B. 原子半径: Na>Mg
C. 离子半径: S2-<Cl- D. 离子半径: K+<Ca2+
6. R元素形成的化合物RH3,其中R的化合价是其最低负化合价,则R元素最高价氧化物的化学式是( )
A. RO2 B. RO3
C. R2O5 D. R2O7
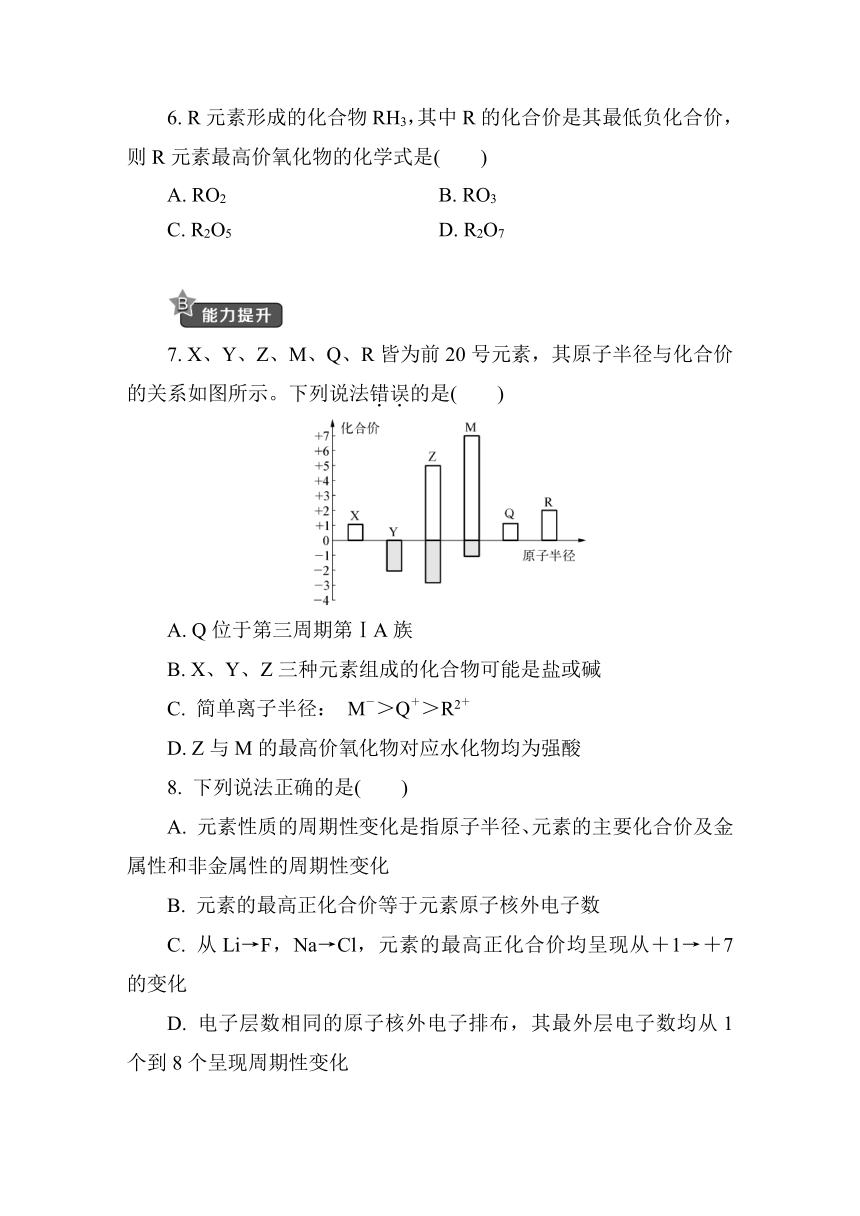
7. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A. Q位于第三周期第ⅠA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径: M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
8. 下列说法正确的是( )
A. 元素性质的周期性变化是指原子半径、元素的主要化合价及金属性和非金属性的周期性变化
B. 元素的最高正化合价等于元素原子核外电子数
C. 从Li→F,Na→Cl,元素的最高正化合价均呈现从+1→+7的变化
D. 电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周期性变化
9. 下列微粒半径大小比较正确的是( )
A. Na+<Mg2+<Al3+<O2- B. S2->Cl->Na+>Al3+
C. Na<Mg<Al<S D. Cs<Rb<K<Na
10. 把与下列元素有关性质相符的曲线标号填入相应空格中:
(1) 第ⅡA族元素的最外层电子数________。
(2) 第三周期元素的最高正化合价________。
(3) 第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________。
(4) 第二、三周期元素随原子序数递增原子半径的变化________。
11. 已知A、B、C三种元素的原子中,质子数为A<B<C,且都小于18,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个。试写出这三种元素的名称和符号:
A______________,B______________,C______________。
12. 下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A. Z、N两种元素的离子半径相比,前者较大
B. M、N两种元素的原子半径相比,后者较大
C. 由X与Y两种元素组成的化合物不一定都能与水反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
答案与解析
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1. A [解析] 原子序数11依次增加到17,均为第三周期,电子层数相同,从左到右,原子半径逐渐减小。
2. B [解析] K、L、M电子层上最多容纳的电子数分别为2、8、18。K层上可排1个电子,也可排2个电子,A项有可能;当M层上排有电子时,L层上一定排满8个电子,而M层上最多只能排18个电子,又18<8×4,B项一定是错误的;K层上最多只能排2个电子,2×4=8,即M层和L层都为8个电子的离子结构示意图为,Cl-、K+、Ca2+等均有可能,C项有可能;最外层电子数可为2或8,核电荷数与最外层电子数相等,可有两种情况,一种是均为2,但这种情况只能是原子,另一种是均为8,核电荷数为8的元素为氧,氧离子的最外层电子数也为8,D项有可能。
3. C [解析] 同周期元素(除稀有气体),从左到右核电荷数逐渐增大,原子半径逐渐减小,最高正化合价逐渐升高(O、F元素除外),非金属性逐渐增强,金属性逐渐减弱;同主族元素,从上到下电子层数逐渐增多,原子半径逐渐增大,非金属性逐渐减弱,金属性逐渐增强。
4. D [解析] 硫离子与钙离子的核外电子排布相同,元素X形成的离子与钙离子的核外电子排布相同,所以元素X形成的离子与硫离子的核外电子排布也相同。相同核外电子排布的离子: Z(核电荷数)↗,r↘。所以X的核电荷数大于硫元素。D正确。
5. B [解析] 原子半径比较: 同周期,左→右,Z(核电荷数)↗,r↘, Na>Mg,B项正确。同主族,上→下,电子层数↗,r↗,F<Cl,A项错。离子半径比较: 相同核外电子排布的离子,Z(核电荷数)↗,r↘, S2->Cl-, K+>Ca2+,C、D项均错误。
6. C [解析] 最低价为-3,最高价为+5,选C。
7. C [解析] 由X、Y、Q的化合价入手,Y的化合价只有-2价,可以推出Y为O元素,Q为Na元素,X为H元素,A项正确;结合化合价规律和原子半径规律,可以得出: Z为N元素,M为Cl元素,R为Ca元素。Ca2+比Na+多一个电子层,所以半径Ca2+比Na+大,C项错误。
8. A [解析] 考查一些规律的特殊性。如: 主族元素最高正价=主族序数=最外层电子数,此时一定要考虑到O、F元素除外。因为O元素和F元素只有负价,没有正价,B错;同理,C错。随着原子序数的递增,同周期元素原子的最外层电子排布呈现由1到8的周期性变化,这时一定要考虑到第一周期除外,因为第一周期只有氢元素和氦元素,它们的最外层电子排布是1到2,D错。
9. B [解析] 离子半径比较: 核外电子排布相同时,Z(核电荷数)↗,r↘。即离子半径Al3+<Mg2+<Na+<O2-,A项错误。因S2-、Cl-比Na+、Al3+多一个电子层,则S2-、Cl-半径比Na+、Al3+大,即离子半径S2->Cl->Na+>Al3+,B项正确。原子半径比较: 同周期,左→右,Z(核电荷数)↗,r↘,所以原子半径,Na>Mg>Al>S,C项错误。同主族,上→下,n(电子层数)↗,r↗,所以原子半径Cs>Rb>K>Na,D项错误。
10. (1) B (2) C (3) E (4) G [解析] 根据核外电子排布规律、离子半径大小比较规律、主族元素化合价规律可得。
11. 碳C 硅Si 氯Cl [解析] 本题主要考查原子的核外电子排布。由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。
12. D [解析] 根据原子半径的递变规律,X为O,Y为Na,Z为Al,M为Si,N为Cl。离子半径Cl->Al3+,A项错误;原子半径Si>Cl,B项错误;Na2O和Na2O2都能与水反应,C项错误;Al2O3是两性氧化物,既可以与NaOH溶液反应,又能与盐酸反应,D项正确。
第1课时 元素性质的周期性变化规律
1. 原子序数从11依次增加到17,下列所述递变关系错误的是( )
A. 电子层数逐渐增多 B. 原子半径逐渐减小
C. 最高正价数值逐渐增大 D. 从硅到氯负价从-4→-1
2. 下列有关主族元素的说法中,肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
3. 下列各组元素性质的递变情况,错误的是( )
A. H、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次升高
C. C、N、O、F原子半径依次增大
D. Li、Na、K、Rb的金属性依次增强
4. 元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素为( )
A. Al B. P
C. Ar D. K
5. 下列粒子半径大小比较,正确的是( )
A. 原子半径: F>Cl B. 原子半径: Na>Mg
C. 离子半径: S2-<Cl- D. 离子半径: K+<Ca2+
6. R元素形成的化合物RH3,其中R的化合价是其最低负化合价,则R元素最高价氧化物的化学式是( )
A. RO2 B. RO3
C. R2O5 D. R2O7
7. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A. Q位于第三周期第ⅠA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径: M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
8. 下列说法正确的是( )
A. 元素性质的周期性变化是指原子半径、元素的主要化合价及金属性和非金属性的周期性变化
B. 元素的最高正化合价等于元素原子核外电子数
C. 从Li→F,Na→Cl,元素的最高正化合价均呈现从+1→+7的变化
D. 电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周期性变化
9. 下列微粒半径大小比较正确的是( )
A. Na+<Mg2+<Al3+<O2- B. S2->Cl->Na+>Al3+
C. Na<Mg<Al<S D. Cs<Rb<K<Na
10. 把与下列元素有关性质相符的曲线标号填入相应空格中:
(1) 第ⅡA族元素的最外层电子数________。
(2) 第三周期元素的最高正化合价________。
(3) 第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________。
(4) 第二、三周期元素随原子序数递增原子半径的变化________。
11. 已知A、B、C三种元素的原子中,质子数为A<B<C,且都小于18,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个。试写出这三种元素的名称和符号:
A______________,B______________,C______________。
12. 下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A. Z、N两种元素的离子半径相比,前者较大
B. M、N两种元素的原子半径相比,后者较大
C. 由X与Y两种元素组成的化合物不一定都能与水反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
答案与解析
第二节 元素周期律
第1课时 元素性质的周期性变化规律
1. A [解析] 原子序数11依次增加到17,均为第三周期,电子层数相同,从左到右,原子半径逐渐减小。
2. B [解析] K、L、M电子层上最多容纳的电子数分别为2、8、18。K层上可排1个电子,也可排2个电子,A项有可能;当M层上排有电子时,L层上一定排满8个电子,而M层上最多只能排18个电子,又18<8×4,B项一定是错误的;K层上最多只能排2个电子,2×4=8,即M层和L层都为8个电子的离子结构示意图为,Cl-、K+、Ca2+等均有可能,C项有可能;最外层电子数可为2或8,核电荷数与最外层电子数相等,可有两种情况,一种是均为2,但这种情况只能是原子,另一种是均为8,核电荷数为8的元素为氧,氧离子的最外层电子数也为8,D项有可能。
3. C [解析] 同周期元素(除稀有气体),从左到右核电荷数逐渐增大,原子半径逐渐减小,最高正化合价逐渐升高(O、F元素除外),非金属性逐渐增强,金属性逐渐减弱;同主族元素,从上到下电子层数逐渐增多,原子半径逐渐增大,非金属性逐渐减弱,金属性逐渐增强。
4. D [解析] 硫离子与钙离子的核外电子排布相同,元素X形成的离子与钙离子的核外电子排布相同,所以元素X形成的离子与硫离子的核外电子排布也相同。相同核外电子排布的离子: Z(核电荷数)↗,r↘。所以X的核电荷数大于硫元素。D正确。
5. B [解析] 原子半径比较: 同周期,左→右,Z(核电荷数)↗,r↘, Na>Mg,B项正确。同主族,上→下,电子层数↗,r↗,F<Cl,A项错。离子半径比较: 相同核外电子排布的离子,Z(核电荷数)↗,r↘, S2->Cl-, K+>Ca2+,C、D项均错误。
6. C [解析] 最低价为-3,最高价为+5,选C。
7. C [解析] 由X、Y、Q的化合价入手,Y的化合价只有-2价,可以推出Y为O元素,Q为Na元素,X为H元素,A项正确;结合化合价规律和原子半径规律,可以得出: Z为N元素,M为Cl元素,R为Ca元素。Ca2+比Na+多一个电子层,所以半径Ca2+比Na+大,C项错误。
8. A [解析] 考查一些规律的特殊性。如: 主族元素最高正价=主族序数=最外层电子数,此时一定要考虑到O、F元素除外。因为O元素和F元素只有负价,没有正价,B错;同理,C错。随着原子序数的递增,同周期元素原子的最外层电子排布呈现由1到8的周期性变化,这时一定要考虑到第一周期除外,因为第一周期只有氢元素和氦元素,它们的最外层电子排布是1到2,D错。
9. B [解析] 离子半径比较: 核外电子排布相同时,Z(核电荷数)↗,r↘。即离子半径Al3+<Mg2+<Na+<O2-,A项错误。因S2-、Cl-比Na+、Al3+多一个电子层,则S2-、Cl-半径比Na+、Al3+大,即离子半径S2->Cl->Na+>Al3+,B项正确。原子半径比较: 同周期,左→右,Z(核电荷数)↗,r↘,所以原子半径,Na>Mg>Al>S,C项错误。同主族,上→下,n(电子层数)↗,r↗,所以原子半径Cs>Rb>K>Na,D项错误。
10. (1) B (2) C (3) E (4) G [解析] 根据核外电子排布规律、离子半径大小比较规律、主族元素化合价规律可得。
11. 碳C 硅Si 氯Cl [解析] 本题主要考查原子的核外电子排布。由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。
12. D [解析] 根据原子半径的递变规律,X为O,Y为Na,Z为Al,M为Si,N为Cl。离子半径Cl->Al3+,A项错误;原子半径Si>Cl,B项错误;Na2O和Na2O2都能与水反应,C项错误;Al2O3是两性氧化物,既可以与NaOH溶液反应,又能与盐酸反应,D项正确。
