2024届高考化学一轮复习专题训练课件★★第六章 化学反应的热效应 课件(共25张PPT)
文档属性
| 名称 | 2024届高考化学一轮复习专题训练课件★★第六章 化学反应的热效应 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 10:44:11 | ||
图片预览





文档简介
(共25张PPT)
2024届高考化学一轮复习专题训练课件★★
第六章 化学反应的热效应
第15练 结合反应图示考查
反应能量变化
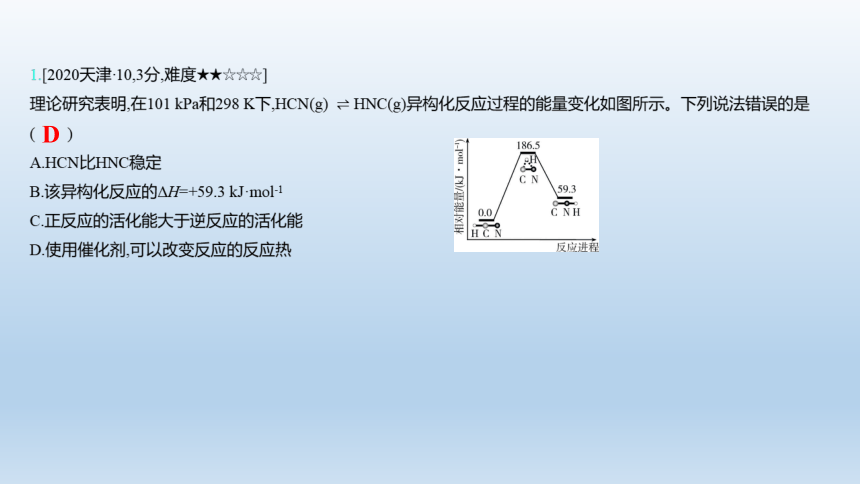
1.[2020天津·10,3分,难度★★☆☆☆]
理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是
( )
A.HCN比HNC稳定
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
D
【解析】 HNC的能量比HCN高,则稳定性较好的是HCN,A项正确;该异构化反应的ΔH=+59.3 kJ·mol-1,为吸热反应,则正反应的活化能大于逆反应的活化能,B、C项正确;使用催化剂只能改变反应的历程,但是不影响反应的反应热,D项错误。
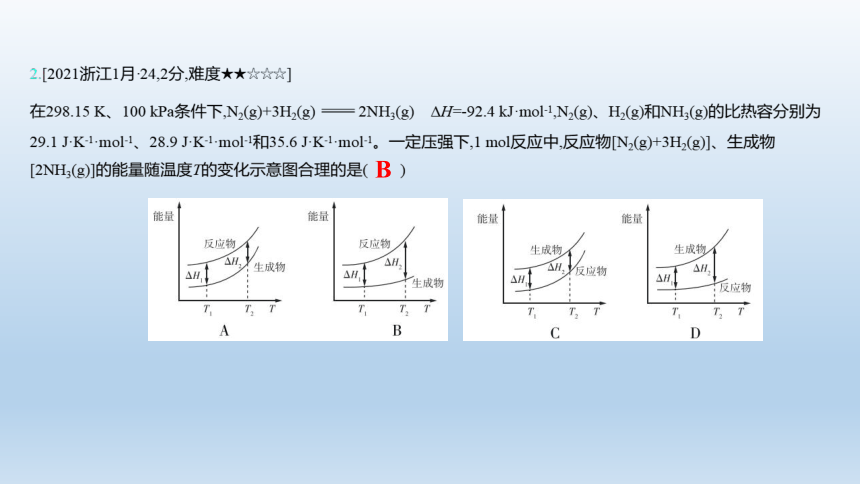
2.[2021浙江1月·24,2分,难度★★☆☆☆]
在298.15 K、100 kPa条件下,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,N2(g)、H2(g)和NH3(g)的比热容分别为29.1 J·K-1·mol-1、28.9 J·K-1·mol-1和35.6 J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g)+3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是( )
B
【解析】 该反应为放热反应,故反应物的能量较高,排除C、D项;根据题给数据,可求出反应物[N2(g)+ 3H2(g)]的比热容为115.8 J·K-1·mol-1,生成物[2NH3(g)]的比热容为71.2 J·K-1·mol-1,升高相同温度比热容大的物质吸收能量多,所以温度升高,反应物能量变化程度较大,故选B。
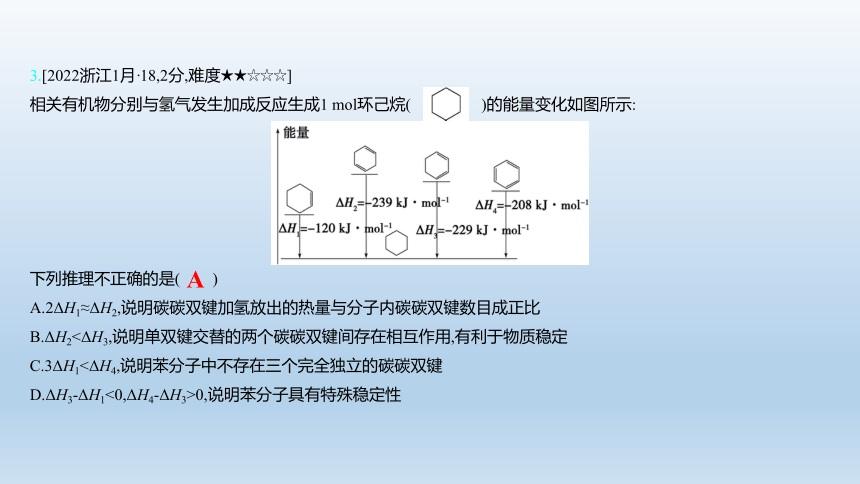
3.[2022浙江1月·18,2分,难度★★☆☆☆]
相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示:
下列推理不正确的是( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
A
【解析】 也含有两个碳碳双键,而2ΔH1<ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目不一定
成正比,A项错误; 与 加氢分别生成 时,ΔH2<ΔH3,说明 稳定性较强,对比二者结构知,单双键交替的两个碳碳双键之间存在有利于物质稳定的相互作用,B项正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C项正确;ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子较单双键交替的结构稳定,具有特殊的稳定性,D项正确。
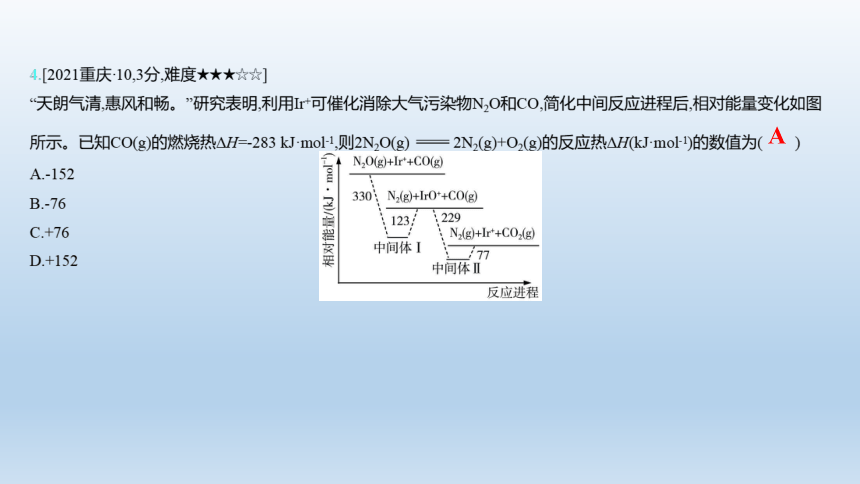
4.[2021重庆·10,3分,难度★★★☆☆]
“天朗气清,惠风和畅。”研究表明,利用Ir+可催化消除大气污染物N2O和CO,简化中间反应进程后,相对能量变化如图所示。已知CO(g)的燃烧热ΔH=-283 kJ·mol-1,则2N2O(g) 2N2(g)+O2(g)的反应热ΔH(kJ·mol-1)的数值为( )
A.-152
B.-76
C.+76
D.+152
A
【解析】 根据题目信息可知,①CO(g)+O2(g) CO2(g) ΔH=-283 kJ·mol-1,根据图象可知,②N2O(g)+CO(g) N2(g)+CO2(g) ΔH=-(330-123+229-77) kJ·mol-1=-359 kJ·mol-1,根据盖斯定律,由(②-①)×2可得2N2O(g) 2N2(g)+O2(g) ΔH=-152 kJ·mol-1,A项正确。
5.[2022湖南·12,4分,难度★★★☆☆][双选]
反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是( )
A.进程Ⅰ是放热反应
B.平衡时P的产率: Ⅱ>Ⅰ
C.生成P的速率: Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
AD
【解析】
【易错警示】 本题易漏选D项,要注意催化剂在反应前后质量和性质都不发生变化,而进程Ⅳ中Z参加反应后最终未得到Z。
新考法
6.[2023浙江1月·14,3分,难度★★☆☆☆]
创新命题形式,本题给出气态反应物和生成物的相对能量与反应历程示意图,考查考生的分析能力
标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
C
新考法
【解析】
根据历程Ⅰ,O3(g)+O(g) 2O2(g)的ΔH=(E6-E3) kJ·mol-1,根据历程Ⅱ,O3(g)+O(g) 2O2(g)的反应热ΔH=(E5-E2) kJ·mol-1,则E6-E3=E5-E2,A项正确;根据图示,Cl(g)的相对能量为(E2-E3) kJ·mol-1,由于Cl2(g)的相对能量为0,故Cl2(g) Cl(g)+Cl(g)的ΔH=2(E2-E3) kJ·mol-1,即Cl—Cl键能为2(E2-E3) kJ·mol-1,B项正确;历程Ⅱ使用了催化剂Cl,催化剂不能使平衡发生移动,则O3的平衡转化率:历程Ⅱ=历程Ⅰ,C项错误;历程Ⅰ、历程Ⅱ中速率最快的一步反应为活化能最小的反应,即ClO(g)+ O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1,D项正确。
【图象分析】
第16练 盖斯定律及
反应热的简单计算
1.[2021浙江1月·20,2分,难度★★☆☆☆]
已知共价键的键能与热化学方程式信息如下表:
则2O(g) O2(g)的ΔH为( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
D
共价键 H—H H—O
键能/(kJ·mol-1) 436 463
热化学方程式 【解析】 根据题表所给热化学方程式得,2×436 kJ·mol-1+E(O=O)-2×2×463 kJ·mol-1=-482 kJ·mol-1,故E(O=O)=+498 kJ·mol-1,故ΔH=-498 kJ·mol-1,故选D。
2.[2023湖南·16节选,2分,难度★★☆☆☆]
已知下列反应的热化学方程式:
①C6H5C2H5(g)+O2(g) 8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·mol-1
②C6H5CH=CH2(g)+10O2(g) 8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·mol-1
③H2(g)+O2(g) H2O(g) ΔH3=-241.8 kJ·mol-1
计算反应④C6H5C2H5(g) C6H5CH=CH2(g)+H2(g)的ΔH4= kJ·mol-1。
【解析】【参考答案】 118(2分)
【解题思路】 根据盖斯定律,由①-②-③,可得④C6H5C2H5(g) C6H5CH=CH2(g)+H2(g) ΔH4=-4 386.9 kJ·mol-1-(-4 263.1 kJ·mol-1)-(-241.8 kJ·mol-1)=+118 kJ·mol-1。
3.[2021河北·16节选,2分,难度★★★☆☆]
大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为 。
物质 H2(g) C(石墨,s) C6H6(l)
燃烧热ΔH/(kJ·mol-1) -285.8 -393.5 -3 267.5
【解析】【参考答案】 6C(石墨,s)+3H2(g) C6H6(l) ΔH=+49.1 kJ·mol-1(2分)
【解题思路】 根据表中燃烧热数据,可得(i)C(石墨,s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1,
(ii)H2(g)+O2(g) H2O(l) ΔH=-285.8 kJ·mol-1,(iii)C6H6(l)+O2(g) 6CO2(g)+3H2O(l) ΔH=-3 267.5 kJ·mol-1,根据盖斯定律,由反应(i)×6+反应(ii)×3-反应(iii),可得6C(石墨,s)+3H2(g) C6H6(l) ΔH=-393.5 kJ·mol-1×6-285.8 kJ·mol-1×3-(-3 267.5 kJ·mol-1)=+49.1 kJ·mol-1 。
4.[2020全国Ⅰ·28节选,2分,难度★★★☆☆]硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) ΔH=-98 kJ·mol-1。
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
【解析】【参考答案】 2V2O5(s)+2SO2(g) 2VOSO4(s)+V2O4(s)
ΔH=-351 kJ·mol-1(2分)
【解题思路】 根据题图知,V2O4(s)+SO3(g) V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1①,V2O4(s)+2SO3(g) 2VOSO4(s) ΔH1=-399 kJ·mol-1②。根据盖斯定律,由②-①×2得:2V2O5(s)+2SO2(g) 2VOSO4(s)+V2O4(s) ΔH=(-399+48) kJ·mol-1=-351 kJ·mol-1。
新考法
5.[2022重庆·13,3分,难度★★★☆☆]
创新命题形式,本题以探究硫酸铵离子键强弱的循环图示为载体,考查反应热的计算
“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ·mol-1)为( )
A.+533 B.+686
C.+838 D.+1 143
C
新考法
【解析】
根据盖斯定律,由①-②+③,可得N(aq) N(g) ΔH=+305 kJ·mol-1,同理,由④-⑤+⑥,可得N(aq) N(g) ΔH=ΔH4-533 kJ·mol-1,则ΔH4-533 kJ·mol-1=+305 kJ·mol-1,ΔH4=+838 kJ·mol-1,C项正确。
【图象分析】 根据图示,可得:①NH4Cl(s) N(g)+Cl-(g) ΔH1=+698 kJ·mol-1、②NH4Cl(s) N(aq)+Cl-(aq) ΔH2=+15 kJ·mol-1、③Cl-(g) Cl-(aq) ΔH3=-378 kJ·mol-1、④(NH4)2SO4(s) N(g)+S(g)
ΔH4、⑤(NH4)2SO4(s) N(aq)+S(aq) ΔH5=+3 kJ·mol-1、⑥S(g) S(aq)
ΔH6=-530 kJ·mol-1。
2024届高考化学一轮复习专题训练课件★★
第六章 化学反应的热效应
第15练 结合反应图示考查
反应能量变化
1.[2020天津·10,3分,难度★★☆☆☆]
理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是
( )
A.HCN比HNC稳定
B.该异构化反应的ΔH=+59.3 kJ·mol-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
D
【解析】 HNC的能量比HCN高,则稳定性较好的是HCN,A项正确;该异构化反应的ΔH=+59.3 kJ·mol-1,为吸热反应,则正反应的活化能大于逆反应的活化能,B、C项正确;使用催化剂只能改变反应的历程,但是不影响反应的反应热,D项错误。
2.[2021浙江1月·24,2分,难度★★☆☆☆]
在298.15 K、100 kPa条件下,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,N2(g)、H2(g)和NH3(g)的比热容分别为29.1 J·K-1·mol-1、28.9 J·K-1·mol-1和35.6 J·K-1·mol-1。一定压强下,1 mol反应中,反应物[N2(g)+3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是( )
B
【解析】 该反应为放热反应,故反应物的能量较高,排除C、D项;根据题给数据,可求出反应物[N2(g)+ 3H2(g)]的比热容为115.8 J·K-1·mol-1,生成物[2NH3(g)]的比热容为71.2 J·K-1·mol-1,升高相同温度比热容大的物质吸收能量多,所以温度升高,反应物能量变化程度较大,故选B。
3.[2022浙江1月·18,2分,难度★★☆☆☆]
相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示:
下列推理不正确的是( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
A
【解析】 也含有两个碳碳双键,而2ΔH1<ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目不一定
成正比,A项错误; 与 加氢分别生成 时,ΔH2<ΔH3,说明 稳定性较强,对比二者结构知,单双键交替的两个碳碳双键之间存在有利于物质稳定的相互作用,B项正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C项正确;ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子较单双键交替的结构稳定,具有特殊的稳定性,D项正确。
4.[2021重庆·10,3分,难度★★★☆☆]
“天朗气清,惠风和畅。”研究表明,利用Ir+可催化消除大气污染物N2O和CO,简化中间反应进程后,相对能量变化如图所示。已知CO(g)的燃烧热ΔH=-283 kJ·mol-1,则2N2O(g) 2N2(g)+O2(g)的反应热ΔH(kJ·mol-1)的数值为( )
A.-152
B.-76
C.+76
D.+152
A
【解析】 根据题目信息可知,①CO(g)+O2(g) CO2(g) ΔH=-283 kJ·mol-1,根据图象可知,②N2O(g)+CO(g) N2(g)+CO2(g) ΔH=-(330-123+229-77) kJ·mol-1=-359 kJ·mol-1,根据盖斯定律,由(②-①)×2可得2N2O(g) 2N2(g)+O2(g) ΔH=-152 kJ·mol-1,A项正确。
5.[2022湖南·12,4分,难度★★★☆☆][双选]
反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:
下列有关四种不同反应进程的说法正确的是( )
A.进程Ⅰ是放热反应
B.平衡时P的产率: Ⅱ>Ⅰ
C.生成P的速率: Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
AD
【解析】
【易错警示】 本题易漏选D项,要注意催化剂在反应前后质量和性质都不发生变化,而进程Ⅳ中Z参加反应后最终未得到Z。
新考法
6.[2023浙江1月·14,3分,难度★★☆☆☆]
创新命题形式,本题给出气态反应物和生成物的相对能量与反应历程示意图,考查考生的分析能力
标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
C
新考法
【解析】
根据历程Ⅰ,O3(g)+O(g) 2O2(g)的ΔH=(E6-E3) kJ·mol-1,根据历程Ⅱ,O3(g)+O(g) 2O2(g)的反应热ΔH=(E5-E2) kJ·mol-1,则E6-E3=E5-E2,A项正确;根据图示,Cl(g)的相对能量为(E2-E3) kJ·mol-1,由于Cl2(g)的相对能量为0,故Cl2(g) Cl(g)+Cl(g)的ΔH=2(E2-E3) kJ·mol-1,即Cl—Cl键能为2(E2-E3) kJ·mol-1,B项正确;历程Ⅱ使用了催化剂Cl,催化剂不能使平衡发生移动,则O3的平衡转化率:历程Ⅱ=历程Ⅰ,C项错误;历程Ⅰ、历程Ⅱ中速率最快的一步反应为活化能最小的反应,即ClO(g)+ O(g) O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1,D项正确。
【图象分析】
第16练 盖斯定律及
反应热的简单计算
1.[2021浙江1月·20,2分,难度★★☆☆☆]
已知共价键的键能与热化学方程式信息如下表:
则2O(g) O2(g)的ΔH为( )
A.428 kJ·mol-1 B.-428 kJ·mol-1
C.498 kJ·mol-1 D.-498 kJ·mol-1
D
共价键 H—H H—O
键能/(kJ·mol-1) 436 463
热化学方程式 【解析】 根据题表所给热化学方程式得,2×436 kJ·mol-1+E(O=O)-2×2×463 kJ·mol-1=-482 kJ·mol-1,故E(O=O)=+498 kJ·mol-1,故ΔH=-498 kJ·mol-1,故选D。
2.[2023湖南·16节选,2分,难度★★☆☆☆]
已知下列反应的热化学方程式:
①C6H5C2H5(g)+O2(g) 8CO2(g)+5H2O(g) ΔH1=-4 386.9 kJ·mol-1
②C6H5CH=CH2(g)+10O2(g) 8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·mol-1
③H2(g)+O2(g) H2O(g) ΔH3=-241.8 kJ·mol-1
计算反应④C6H5C2H5(g) C6H5CH=CH2(g)+H2(g)的ΔH4= kJ·mol-1。
【解析】【参考答案】 118(2分)
【解题思路】 根据盖斯定律,由①-②-③,可得④C6H5C2H5(g) C6H5CH=CH2(g)+H2(g) ΔH4=-4 386.9 kJ·mol-1-(-4 263.1 kJ·mol-1)-(-241.8 kJ·mol-1)=+118 kJ·mol-1。
3.[2021河北·16节选,2分,难度★★★☆☆]
大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为 。
物质 H2(g) C(石墨,s) C6H6(l)
燃烧热ΔH/(kJ·mol-1) -285.8 -393.5 -3 267.5
【解析】【参考答案】 6C(石墨,s)+3H2(g) C6H6(l) ΔH=+49.1 kJ·mol-1(2分)
【解题思路】 根据表中燃烧热数据,可得(i)C(石墨,s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1,
(ii)H2(g)+O2(g) H2O(l) ΔH=-285.8 kJ·mol-1,(iii)C6H6(l)+O2(g) 6CO2(g)+3H2O(l) ΔH=-3 267.5 kJ·mol-1,根据盖斯定律,由反应(i)×6+反应(ii)×3-反应(iii),可得6C(石墨,s)+3H2(g) C6H6(l) ΔH=-393.5 kJ·mol-1×6-285.8 kJ·mol-1×3-(-3 267.5 kJ·mol-1)=+49.1 kJ·mol-1 。
4.[2020全国Ⅰ·28节选,2分,难度★★★☆☆]硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) ΔH=-98 kJ·mol-1。
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
【解析】【参考答案】 2V2O5(s)+2SO2(g) 2VOSO4(s)+V2O4(s)
ΔH=-351 kJ·mol-1(2分)
【解题思路】 根据题图知,V2O4(s)+SO3(g) V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1①,V2O4(s)+2SO3(g) 2VOSO4(s) ΔH1=-399 kJ·mol-1②。根据盖斯定律,由②-①×2得:2V2O5(s)+2SO2(g) 2VOSO4(s)+V2O4(s) ΔH=(-399+48) kJ·mol-1=-351 kJ·mol-1。
新考法
5.[2022重庆·13,3分,难度★★★☆☆]
创新命题形式,本题以探究硫酸铵离子键强弱的循环图示为载体,考查反应热的计算
“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ·mol-1)为( )
A.+533 B.+686
C.+838 D.+1 143
C
新考法
【解析】
根据盖斯定律,由①-②+③,可得N(aq) N(g) ΔH=+305 kJ·mol-1,同理,由④-⑤+⑥,可得N(aq) N(g) ΔH=ΔH4-533 kJ·mol-1,则ΔH4-533 kJ·mol-1=+305 kJ·mol-1,ΔH4=+838 kJ·mol-1,C项正确。
【图象分析】 根据图示,可得:①NH4Cl(s) N(g)+Cl-(g) ΔH1=+698 kJ·mol-1、②NH4Cl(s) N(aq)+Cl-(aq) ΔH2=+15 kJ·mol-1、③Cl-(g) Cl-(aq) ΔH3=-378 kJ·mol-1、④(NH4)2SO4(s) N(g)+S(g)
ΔH4、⑤(NH4)2SO4(s) N(aq)+S(aq) ΔH5=+3 kJ·mol-1、⑥S(g) S(aq)
ΔH6=-530 kJ·mol-1。
同课章节目录
