专题13溶液——2022-2023年浙江省宁波市中考科学一模二模考试试题分类(含答案)
文档属性
| 名称 | 专题13溶液——2022-2023年浙江省宁波市中考科学一模二模考试试题分类(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 775.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-09-15 13:55:49 | ||
图片预览



文档简介
专题13溶液——2022-2023年浙江省宁波市中考科学一模二模考试试题分类
一.选择题(共19小题)
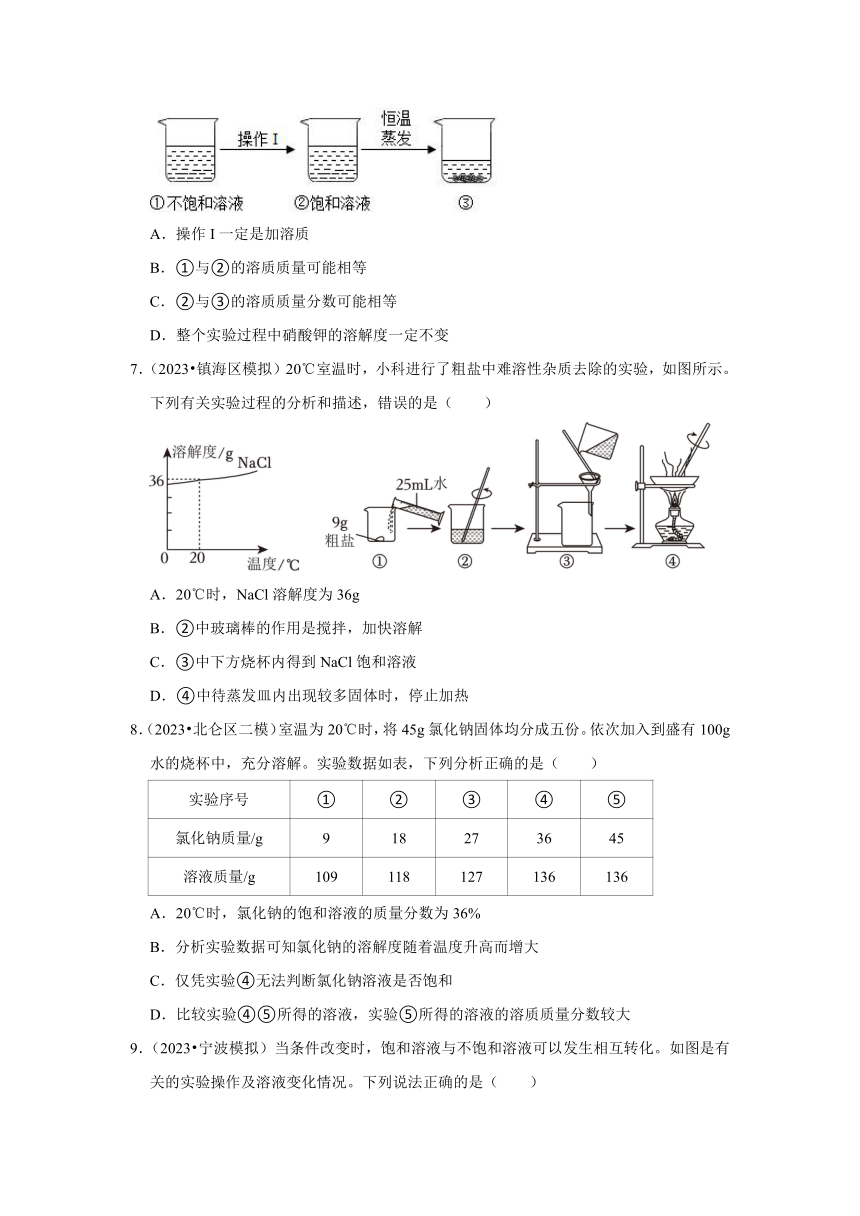
1.(2023 宁波模拟)如图所示,某固体物质的溶液在一定温度下,进行恒温蒸发实验,下列说法正确的是( )
A.甲烧杯中一定是饱和溶液
B.乙烧杯中的溶液一定是不饱和溶液
C.丙烧杯和丁烧杯中的溶液溶质质量分数相等
D.固体在丙烧杯和丁烧杯中的溶解度不同
2.(2023 江北区二模)20℃时,将等质量的a、b两种固体分别加入盛有相同质量水的烧杯中,充分搅拌后现象如图甲所示,升温到50℃时,现象如图乙所示,a、b两种固体的溶解度曲线如图丙所示。下列说法中正确的是( )
A.图甲中a、b两溶液中的溶质质量相等
B.图乙中a、b两溶液一定都是不饱和溶液
C.图丙中N表示a物质的溶解度曲线
D.30℃时a、b两溶液的溶质质量分数不相等
3.(2023 慈溪市校级模拟)20℃时,在各盛有100g水的烧杯中,分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A.乙溶液可能是饱和溶液
B.溶液中溶质质量分数:甲>丙>乙
C.20℃时,乙溶液的溶质质量最小
D.升高温度,溶液的溶质质量分数都变大
4.(2023 慈溪市模拟)20℃时,取甲、乙、丙、丁四种纯净物各40g,分别加入到四个各盛有100g水的烧杯中,充分溶解,其溶解情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/g 8.4 4 0 18.4
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20℃时四种物质溶解度的关系为:丁>甲>乙>丙
D.向四个烧杯中分别再加入100g 20℃的水后,所得溶液质量相等
5.(2023 宁海县模拟)20℃时几种物质在水中的溶解度如表所示。下列说法正确的是( )
物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克/100克水) 36.0 0.165 7.4 31.6
A.20℃时,饱和氯化钠溶液的溶质质量分数为36%
B.20℃时,100克水最多溶解7.4克氯酸钾
C.20℃时,将20克硝酸钾加入到50克水中形成的是不饱和溶液
D.20℃时,增加水的质量可以增大氢氧化钙的溶解度
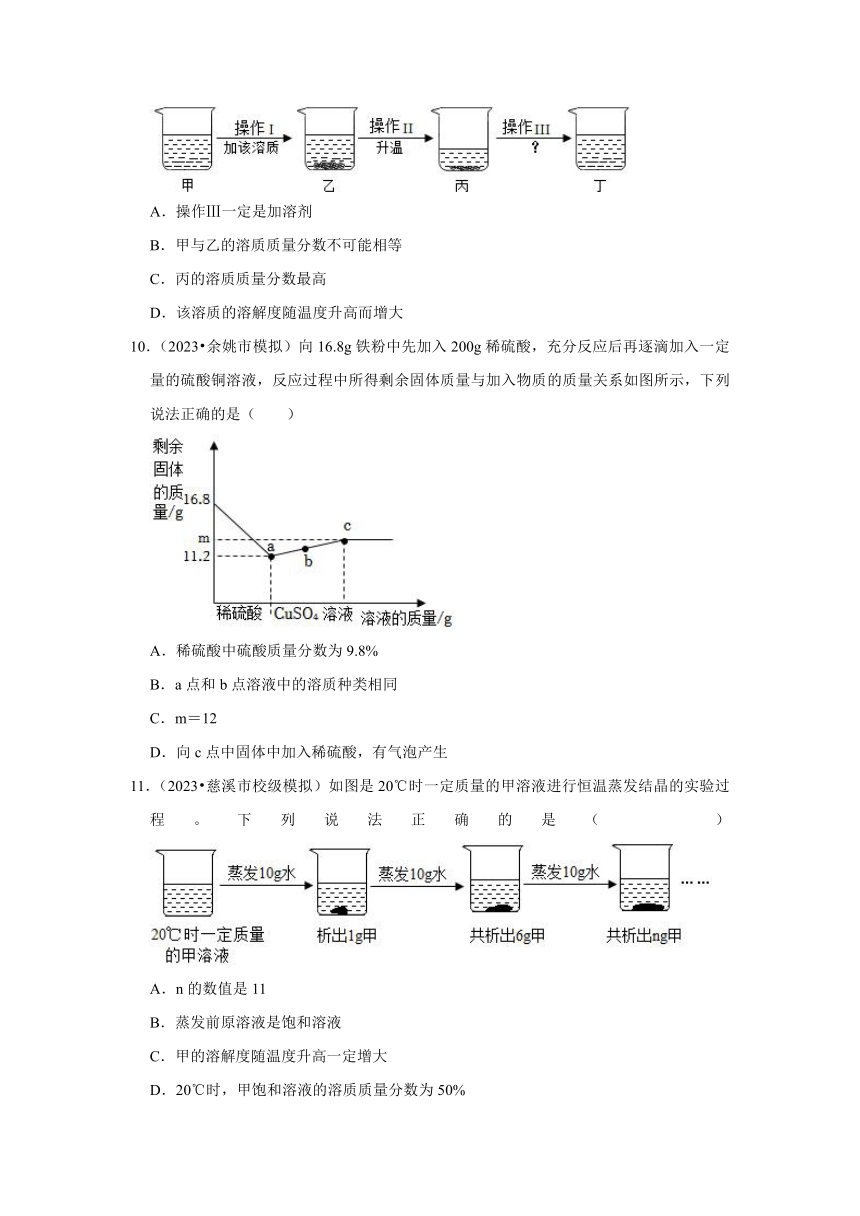
6.(2023 余姚市模拟)已知硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
A.操作I一定是加溶质
B.①与②的溶质质量可能相等
C.②与③的溶质质量分数可能相等
D.整个实验过程中硝酸钾的溶解度一定不变
7.(2023 镇海区模拟)20℃室温时,小科进行了粗盐中难溶性杂质去除的实验,如图所示。下列有关实验过程的分析和描述,错误的是( )
A.20℃时,NaCl溶解度为36g
B.②中玻璃棒的作用是搅拌,加快溶解
C.③中下方烧杯内得到NaCl饱和溶液
D.④中待蒸发皿内出现较多固体时,停止加热
8.(2023 北仑区二模)室温为20℃时,将45g氯化钠固体均分成五份。依次加入到盛有100g水的烧杯中,充分溶解。实验数据如表,下列分析正确的是( )
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
A.20℃时,氯化钠的饱和溶液的质量分数为36%
B.分析实验数据可知氯化钠的溶解度随着温度升高而增大
C.仅凭实验④无法判断氯化钠溶液是否饱和
D.比较实验④⑤所得的溶液,实验⑤所得的溶液的溶质质量分数较大
9.(2023 宁波模拟)当条件改变时,饱和溶液与不饱和溶液可以发生相互转化。如图是有关的实验操作及溶液变化情况。下列说法正确的是( )
A.操作Ⅲ一定是加溶剂
B.甲与乙的溶质质量分数不可能相等
C.丙的溶质质量分数最高
D.该溶质的溶解度随温度升高而增大
10.(2023 余姚市模拟)向16.8g铁粉中先加入200g稀硫酸,充分反应后再逐滴加入一定量的硫酸铜溶液,反应过程中所得剩余固体质量与加入物质的质量关系如图所示,下列说法正确的是( )
A.稀硫酸中硫酸质量分数为9.8%
B.a点和b点溶液中的溶质种类相同
C.m=12
D.向c点中固体中加入稀硫酸,有气泡产生
11.(2023 慈溪市校级模拟)如图是20℃时一定质量的甲溶液进行恒温蒸发结晶的实验过程。下列说法正确的是( )
A.n的数值是11
B.蒸发前原溶液是饱和溶液
C.甲的溶解度随温度升高一定增大
D.20℃时,甲饱和溶液的溶质质量分数为50%
12.(2023 宁波模拟)在化学反应中,物质“量的多少”会影响反应的过程。下列说法正确的是( )
A.图①:等质量的KClO3粉末分别与不同质量的MnO2混合,充分加热
B.图②:等质量的Mg粉、Zn粉中分别逐滴滴入相同质量分数的稀盐酸,直至过量
C.图③:一定量的Cu(NO3)2和AgNO3混合溶液中逐渐加入Fe粉,直至过量
D.图④:t℃时,向一定量的饱和石灰水中加入生石灰
13.(2023 海曙区一模)甲图是氯化钠和硝酸钾的溶解度曲线。20℃时,取两种物质各36g分别溶解在100g水中,温度从20℃升高至50℃,如图乙、丙所示。下列说法正确的是( )
A.在图甲中,P点时硝酸钾和氯化钠的溶解度不相等
B.在图乙中,A烧杯内溶解的是氯化钠
C.在图丙中,B烧杯内的溶液为饱和溶液
D.在图丙中,A烧杯内溶液的溶质质量分数为36%
14.(2023 北仑区一模)在室温下,小乐完成了如下实验,若固体A(不含结晶水)溶于水既不吸热,也不放热,且实验过程中。不考虑水的蒸发。则下列说法正确的是( )
A.在室温下,溶液①为饱和溶液
B.在t℃时,A的溶解度一定为50克
C.溶液②和溶液④的溶质质量分数相同
D.溶液③和溶液④的溶液质量相同
15.(2023 鄞州区校级一模)小宁在配制硝酸钾溶液时得到如表数据,据此分析以下说法不正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为20.9克
B.②所得溶液不一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
16.(2023 宁波一模)用MgCl2溶液喷洒路面可融雪。已知20℃时,MgCl2的溶解度为54.6克,若按表中数据配制溶液(温度均为20℃),则下列说法正确的是( )
序号 ① ② ③ ④
MgCl2的质量/克 40 50 60 70
H2O的质量/克 100 100 100 100
A.①所得溶液,其溶质和溶剂的质量比为2:7
B.②所得溶液,其溶质的质量分数为50%
C.③④所得溶液均为20℃时MgCl2的饱和溶液
D.③所得溶液的溶质质量分数小于④所得溶液
17.(2022 慈溪市模拟)下列四个图象能正确反映对应变化关系的是( )
A.电解水
B.等质量且形状、大小均相同的锌、铁两种金属分别逐滴滴入过量的同种稀硫酸
C.硝酸银、硝酸铜的混合溶液加入锌粉至过量
D.氯化镁溶液与氢氧化钙溶液混合,充分反应
18.(2022 慈溪市模拟)一木块漂浮于50℃的硝酸钾饱和溶液中,某一条件改变时,木块排开液体的体积随时间发生了如图所示的变化,下列条件可以达到目的是( )
①增加溶质
②蒸发溶剂
③增加溶剂
④升高温度
⑤降低温度
A.②④ B.①④ C.②③ D.③⑤
19.(2022 海曙区模拟)下列四个图象反映对应变化关系正确的是( )
A.一定量的镁在过量的氧气中充分燃烧
B.红磷在密闭容器中燃烧
C.等质量的碳酸钙与足量溶质质量分数相同的稀盐酸反应
D.电解水实验中,生成的氢气和氧气之间的质量关系
二.填空题(共7小题)
20.(2023 鄞州区一模)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。
(1)20℃时,ZnSO4的溶解度 (填“大于”“小于”或“等于”)35g/100g水。
(2)70℃时,N点对应的ZnSO4溶液是 (填“饱和”或“不饱和”)溶液。
21.(2022 北仑区二模)为抗击新冠肺炎,消毒机器人(如图)在定点医院正式上岗,协助甚至替代人去做危险性的工作。该机器人自主移动时,利用紫外线和雾化的过氧化氢进行多点消毒,有效预防病菌传播。
(1)机器人通过自带的摄像系统避开障碍物,调控行进路线。摄像头的镜头相当于一个凸透镜,当摄像系统接收到的障碍物图像越来越大时,则机器人与障碍物之间的距离变化是 。
(2)机器人对环境进行消毒,属于预防传染病措施中的 。
(3)该机器一次可加入4千克溶质质量分数为5%的过氧化氢溶液,则需 千克20%的过氧化氢溶液加水稀释而成。
22.(2023 北仑区模拟)如图所示,把装有适量水的烧杯放在湿玻璃上,向烧杯中两次加入硝酸铵固体充分搅拌,发现玻璃上的水结冰使烧杯和玻璃粘在一起。
(1)烧杯里的硝酸铵溶液一定是饱和溶液的是图 。
(2)该过程中玻璃上水发生物态变化的名称是 。
23.(2023 宁波模拟)小宁同学用溶质质量分数为48%的H2O2溶液80g、少量洗发水(泡发剂)以及KI溶液50g完成了“大象牙膏”实验。本实验以KI为催化剂,加速H2O2的分解,在短时间内即可冒出大量泡沫。
(1)欲配制80g48%的H2O2溶液,需要60%的H2O2溶液 g进行稀释。
(2)用化学方程式表示本实验的主要反应: 。
24.(2022 镇海区二模)如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为 。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是 。
(3)t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是 。
25.(2022 慈溪市模拟)如图是精致的叶脉书签,其制作原理是利用氢氧化钠的腐蚀性,10%的氢氧化钠溶液可腐蚀叶肉且不破坏叶脉。
(1)腐蚀掉的叶肉是 ,叶脉中的 能够向下运输有机物。
(2)如果用40%的氢氧化钠溶液来配制所需氢氧化钠溶液500g,需要加水 g。
26.(2022 海曙区模拟)甲烧杯中盛有30℃溶质质量分数为20%的饱和硫酸铜溶液100克,进行如图所示实验(不考虑水分蒸发)。
(1)乙中溶液 (填“是”“不是”或“可能是”)饱和溶液。
(2)若丙中无晶体析出,则溶液的溶质质量分数为(结果保留到0.1%) 。
三.实验探究题(共1小题)
27.(2023 镇海区模拟)如图甲是小平网购收到的活鱼,鱼在密封袋中存活时间长短与水中溶解氧的含量相关。为了探究氧气在水中溶解能力的影响因素,小平做了以下实验。
步骤1:将相同的7个密封容器标为1号、2号、3号......,在容器内分别装入等量的水后排尽容器内的空气,再充入足够的氧气。
步骤2:将7个密封容器的水温控制在0℃、5℃、10℃、15℃、20℃、25℃、30℃,然后通过调整密封圈把容器内气压调整为0.9×105帕。通过氧气含量传感器显示水中溶解氧气的质量(如图乙)。
步骤3:将气压调整到1×105帕、1.05×105帕,重复步骤2,记录数据并绘制如图丙所示曲线。
(1)步骤1中“排尽容器内的空气,再充入足够的氧气”的目的是: 。
(2)某同学认为氧气在水中的溶解能力为微溶,即使在步骤1中加入的氧气没有完全等量也不会影响实验结果,你认为该观点是否合理,并说明理由: 。
(3)在容器内气压为1.0×105帕时,把水温从20℃调整到该类鱼生存最适合温度30℃,通过调整密封圈来改变容器内的气压,使水中溶解氧的量保持不变,气压该怎么调整,请说明理由: 。
四.计算题(共1小题)
28.(2023 宁波模拟)四个相同的容器中,分别加入一定质量、均匀混合的Na2CO3和NaHCO3固体,每个容器中逐滴滴入溶质质量分数为14.6%的稀盐酸,产生气体的情况如下表所示。
组别 甲 乙 丙 丁
混合固体质量/g 6.85 13.7 27.4 ?
稀盐酸质量/g 50 50 50 100
产生气体的质量/g 3.3 6.6 4.4 0
已知:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑
请分析计算:
(1)混合固体中Na2CO3和NaHCO3的质量比。
(2)丙组反应结束后,剩余溶液中NaHCO3的溶质质量分数是多少?(假设溶液不饱和,计算结果保留一位小数)
(3)丁中加入混合固体的质量至少是多少?
五.解答题(共2小题)
29.(2023 宁波模拟)葡萄酒中充入SO2具有保鲜、杀菌、抗氧化等作用,但过多摄入SO2对人类身体有一定的毒性作用,我国规定人体每天SO2摄入量最高不超过0.7mg/kg。小宁每次见爸爸喝酒时都提前打开葡萄酒,倒入形状特殊的容器中“醒酒”,喝时倒少许葡萄酒且不停轻摇酒杯。小宁取150mL该葡萄酒(加适量稀酸),加热使SO2全部逸出并将SO2通入足量的H2O2溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液50g。求:
(1)分析可知:当压强一定时,升高温度,SO2在水中的溶解度将 。
(2)SO2通入足量H2O2溶液中发生化合反应,可用化学方程式 表示。
(3)假设小宁爸爸一次喝葡萄酒300mL,酒中的SO2全部被喝入。计算说明体重为75kg的他爸爸SO2摄入量是否超标?
(4)小宁将选择形状类似 (选填“量筒”或“烧瓶”)的容器来“醒酒”,明白了喝时倒少许葡萄酒且不停轻摇酒杯是为了 。
30.(2022 海曙区校级三模)2020年出现了罕见的新型冠状病毒疫情后,使得消毒剂的选择、利用以及相关问题的探讨与研究又成了热门话题.常见的消毒消毒剂有:84消毒液、过氧乙酸(CH3COOOH)溶液、双氧水溶液、醋酸(CH3COOH)溶液等,请回答以下几个问题:
(1)相同分子数的过氧乙酸和醋酸,所含氧原子的个数比是 ;
(2)84消毒液和洁厕灵混合使用时会发生化学反应NaClO+2HCl=NaCl+H2O+X↑,X气体有毒,因此二者不能混合使用。那么X的化学式为 ;
(3)要配制2%的双氧水溶液,已经有4%的双氧水溶液100g,所需水的质量为 。
参考答案与试题解析
一.选择题(共19小题)
1.【解答】解:A、第一次蒸发10g水,没有晶体析出,则甲烧杯中一定是不饱和溶液,故选项说法错误。
B、第一次蒸发10g水,没有晶体析出,乙烧杯中的溶液可能是不饱和溶液,也可能是恰好饱和的溶液,故选项说法错误。
C、丙烧杯和丁烧杯中的溶液均为一定温度下的饱和溶液,溶质质量分数相等,故选项说法正确。
D、由于温度相同,固体在丙烧杯和丁烧杯中的溶解度相同,故选项说法错误。
故选:C。
2.【解答】解:A、20℃时,将等质量a、b两种固体,分别加入到盛有相同质量水的烧杯中,b固体完全溶解度,a固体没有完全溶解,所以图甲a、b溶液中的溶质质量不相等,故A错误;
B、由于图甲中可以知道20℃时a的溶解度小于b的溶解度,图乙无溶质剩余,所以b一定是不饱和溶液,而在50℃时,a的溶解度大于b的溶解度,所以a一定也是不饱和溶液,故B正确;
C、信息根据图甲中可以知道20℃时a的溶解度小于b的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故M表示的是a物质的溶解度曲线,故C错误;
D、根据图丙可知两种物质的溶解度都随温度升高而增大,因此30℃时,a、b的溶解度都比20℃时大,且30℃时两物质的溶解度相等,当a中的物质完全溶解时,溶质的质量分数就会相等,故D错误。
故选:B。
3.【解答】解:A、20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物,充分溶解后,甲中不溶解的物质最多,丙其次,乙全部溶解,所得溶液甲、丙一定是饱和溶液,乙可能是恰好饱和的溶液,也可能是不饱和溶液,故选项说法正确。
B、溶剂质量相等,溶解的溶质质量由多到少的顺序是乙>丙>甲,溶液溶质的质量分数:乙>丙>甲,故选项说法错误。
C、乙中的溶质全部溶解,因此20℃时,乙溶液的溶质质量最大,故选项说法错误。
D、无法确定溶解度受温度影响的变化趋势,升高温度,溶液溶质的质量分数不一定变大,故选项说法错误。
故选:A。
4.【解答】解:A、丙物质未溶解固体的质量为0,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,故选项说法错误。
B、溶剂质量相同,而甲、乙、丙、丁四种溶液中溶质质量的大小关系为丙>乙>甲>丁,则丙溶液的溶质质量分数最大,故选项说法错误。
C、溶剂质量相同(100g),而甲、乙、丙、丁四种溶液中溶质质量的大小关系为丙>乙>甲>丁,则20℃时四种物质质溶解度的关系为:丙>乙>甲>丁,故选项说法错误。
D、根据图表中的数据知,在20℃时,甲、乙、丙、丁在100g水中溶解的质量分别是:(40g﹣8.4g=31.6g)、(40g﹣4g=36g)、40g、(40g﹣18.4g=21.6g),则四杯溶液中各加入20℃的100g水后,剩余固体均全部溶解,四种物质均为不饱和溶液,溶液质量相等,故选项说法正确。
故选:D。
5.【解答】解:A、20℃时,氯化钠的溶解度为36.0g,则20℃时,饱和氯化钠溶液的溶质质量分数为×100%<36%,故选项说法错误。
B、20℃时,氯酸钾的溶解度为7.4g,则20℃时,100克水最多溶解7.4克氯酸钾,故选项说法正确。
C、20℃时,硝酸钾的溶解度为31.6g,则20℃时,100克水最多溶解31.6g硝酸钾,则20℃时,将20克硝酸钾加入到50克水中,最多能溶解15.8g,形成的是饱和溶液,故选项说法错误。
D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶剂质量、溶质质量多少的影响,20℃时,增加水的质量不能增大氢氧化钙的溶解度,故选项说法错误。
故选:B。
6.【解答】解:A、操作I不一定是加溶质,也可能是蒸发溶剂或降低温度,故选项说法错误。
B、若采用的是降低温度至恰好饱和的方法,①与②的溶质质量可能相等,故选项说法正确。
C、②与③均为该温度下的饱和溶液,②与③的溶质质量分数一定相等,故选项说法错误。
D、操作I可能采用的降低温度的方法,则整个实验过程中硝酸钾的溶解度会发生改变,故选项说法错误。
故选:B。
7.【解答】解:A、由图可知,20℃时,NaCl溶解度为36g,故A正确;
B、②是溶解过程,溶解过程中玻璃棒的作用是搅拌,加快溶解,故B正确;
C、20℃时,NaCl溶解度为36g,则20℃时,25g水中最多溶解9g氯化钠,而粗盐中含有难溶性杂质,则9g粗盐中,氯化钠的质量小于9g,则20℃时,将9g粗盐溶于25g水中得到的是NaCl的不饱和溶液,而不是NaCl饱和溶液,故C错误;
D、④是蒸发过程,蒸发过程中待蒸发皿内出现较多固体时,停止加热,利用余热蒸干,故D正确;
故选:C。
8.【解答】解:A、室温为20℃时,将45g氯化钠固体均分成五份。依次加入到盛有100g水的烧杯中,充分溶解,最多能形成136g溶液,则该温度下100g水中最多能溶解36g氯化钠,则20℃时,氯化钠的溶解度为36g,氯化钠的饱和溶液的质量分数为×100%<36%,故选项说法错误。
B、表格数据是20℃时,100g水中最多能形成136g溶液,不能得出氯化钠的溶解度随着温度升高而增大,故选项说法错误。
C、仅凭实验④无法判断氯化钠溶液是否饱和,还需结合⑤中数据确定其不能继续溶解氯化钠,故选项说法正确。
D、④⑤均是该温度下的饱和溶液,溶液的溶质质量分数相等,故选项说法错误。
故选:C。
9.【解答】解:A、由乙到丙的操作可知,温度升高,剩余固体的质量减少;操作Ⅲ不一定是加溶剂,也可能是升高温度的方法,故选项说法错误。
B、甲加入该溶质后,有不能继续溶解的溶质存在,甲可能是饱和溶液,则甲与乙的溶质质量分数可能相等,故选项说法错误。
C、甲乙丙丁中,溶剂质量相等,丁中溶质质量最多,则丁的溶质质量分数最高,故选项说法错误。
D、由乙到丙的操作可知,温度升高,剩余固体的质量减少,该溶质的溶解度随温度升高而增大,故选项说法正确。
故选:D。
10.【解答】解:A、由题意和图示可知,向16.8g铁粉中先加入200g稀硫酸,参加反应的铁的质量为16.8g﹣11.2g=5.6g,与硫酸铜反应的铁的质量为11.2g,
设稀硫酸中溶质的质量为x。
Fe+H2SO4=FeSO4+H2↑
56 98
5.6g x
解得:x=9.8g
稀硫酸中硫酸质量分数为:=4.9%。
故A错误。
B、a点是铁与稀硫酸恰好反应,b点是铁与硫酸铜部分反应,溶液中的溶质都是硫酸亚铁和硫酸铜,溶液中的溶质种类相同,故B正确;
C、设生成铜的质量为y。
Fe+CuSO4=Cu+FeSO4
56 64
11.2g y
解得:y=12.8g
故C错误;
D、由图像可知,c点铁与硫酸铜恰好完全反应,固体中只有铜,加入稀硫酸,没有气泡产生,故D错误。
故选:B。
11.【解答】解:A、20℃时一定质量的甲溶液进行恒温蒸发10g水,析出1g甲,再蒸发10g水,析出5g甲,共6g甲;再蒸发10g水,析出5g甲,共析出11g甲;故选项正确;
B、20℃时一定质量的甲溶液进行恒温蒸发10g水,析出1g甲,再蒸发10g水,析出5g甲,说明原溶液是不饱和溶液,饱和错误;故选项错误;
C、甲的溶解度随温度升高一定增大错误,应该是可能增大;故选项错误;
D、20℃时,甲饱和溶液的溶质质量分数=,50%错误,故选项错误;
故选:A。
12.【解答】解:A、反应中催化剂不会影响产物的质量,故错误;
B、等质量的Mg粉、Zn粉中分别逐滴滴入相同质量分数的稀盐酸,初始阶段生成氢气的质量相同,斜线相同,最终生成氢气的质量为镁产生的氢气多,故错误;
C、在一定量 AgNO3 和 Cu(NO3)2 的混合溶液中加入铁粉,铁先与硝酸银反应,当硝酸银完全反应后再与硝酸铜反应,随着铁的加入,金属单质逐渐为只有银,到银和铜,最后为银、铜和铁,故正确;
D、氧化钙能与水发生反应生成氢氧化钙,氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,最终变为0,故错误;
故选:C。
13.【解答】解:A、在图甲中,P点是硝酸钾和氯化钠的溶解度曲线的交点,P点时硝酸钾和氯化钠的溶解度相等,故A错误;
B、在20℃时,氯化钠的溶解度大于硝酸钾的溶解度,在图乙中,A中溶质全部溶解了,B中溶质有剩余,A烧杯内溶解的是氯化钠,故B正确;
C、由上述分析可知,在B中溶解的是硝酸钾,在50℃硝酸钾的溶解度是85.5g,现在只溶解了36g,是不饱和溶液,故C错误;
D、在图丙中,A烧杯内溶液的溶质质量分数为≈26.5%,故D错误。
故选:B。
14.【解答】解:A.在室温下,溶液①溶质全部溶解,故不一定为饱和溶液;错误;
B.在t℃时,10g物质A全部溶解到20g水中不一定得到饱和溶液,故在t℃时,A的溶解度不一定为50克;
C.由图示可知,溶液②和溶液④都是室温时,且溶质和溶剂的质量相等,故的溶质质量分数相同;
D.由图示可知,溶液③是在t℃时,10g物质A全部溶解到20g水中;溶液④是由t℃冷却到室温时,由溶液②可知会有晶体析出的,故溶液③和溶液④的溶液质量不相同;
故选:C。
15.【解答】解:A、10℃时,在100g的水中,加入40g的硝酸钾,形成溶液的质量为120.9g,所以硝酸钾的溶解度为20.9g,故A正确;
B、②中的固体全部溶解,因此②所得溶液不一定是60℃时硝酸钾的饱和溶液,故B正确;
C、若通过加热将①中剩余硝酸钾全部溶解,溶质质量增大,则溶液的溶质质量分数增大,故C错误;
D、②所得溶液溶质质量分数为×100%≈28.6%,降温至10℃,溶质质量分数变成×100%≈17.3%,则溶液的溶质质量分数会变小,故D正确。
故选:C。
16.【解答】解:A、①所得溶液,其溶质和溶剂的质量比为40:100=2:5,故错误;
B、②所得溶液,其溶质的质量分数为≈33.3%,故错误;
C、③和④溶液中溶质只能溶解54.6g,所得溶液均为20℃时MgCl2的饱和溶液,故正确;
D、③和④溶液中溶质都溶解54.6g,且溶液质量相等,即③所得溶液的溶质质量分数等于④所得溶液,故错误。
故选:C。
17.【解答】解:A、通电分解水,生成氢气和氧气的体积(而不是质量)之比为2:1,故选项图象错误。
B、等质量且形状、大小均相同的锌、铁两种金属分别逐滴滴入过量的同种稀硫酸,若消耗硫酸相同,则生成氢气质量相同,故开始两斜线重合,后因硫酸过量,铁消耗硫酸多,生成氢气多,拐点高些,故选项图象错误。
C、锌的金属活动性比银、铜强,硝酸银、硝酸铜的混合溶液加入锌粉至过量,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完,若还有锌粉,锌才能与硝酸铜反应生成硝酸锌和铜;Zn+2AgNO3═Zn(NO3)2+2Ag,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,溶液的质量会减少,则硝酸铜的质量分数先增大,后逐渐减小,最终减小至0,故选项图象正确。
D、氯化镁溶液与氢氧化钙溶液混合生成氢氧化镁沉淀和氯化钙,氢氧化镁和氯化钙的质量增加,氯化镁和氢氧化钙的质量减少,最终氯化镁或氢氧化钙的质量减少至0;反应的化学方程式为Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,每74份质量的氢氧化钙与95份质量的氯化镁反应生成58份质量的氢氧化镁沉淀和111份质量的氯化钙,图中一种反应物减少的质量与一种生成物增加的质量相等,是不可能的,故选项图象错误。
故选:C。
18.【解答】解:观察图象可知,木块排开液体的体积增大,由F=ρgV排,则液体的密度减小。
①增加溶质,不能继续溶解,溶液的密度不变,不符合要求。
②蒸发溶剂,有硝酸钾晶体析出,溶液仍是该温度下的饱和溶液,溶液的密度不变,不符合要求。
③增加溶剂,溶液的密度变小,符合要求。
④升高温度,硝酸钾的溶解度增大,但溶液的组成没有发生改变,不符合要求。
⑤硝酸钾的溶解度随着温度的升高而增大,温度降低,有硝酸钾晶体析出,溶液的密度变小,可采用降低温度的方法。
故③⑤符合题意。
故选:D。
19.【解答】解:A、镁在氧气中燃烧生成氧化镁,一定量的镁在过量的氧气中充分燃烧后镁的质量0,氧气的质量不为0,氧化镁质量等于参加反应的氧气和镁的质量和,A图正确;
B、红磷在密闭容器中燃烧生成五氧化二磷固体,反应后固体质量不为0,B图错误;
C、粉末状碳酸钙与稀盐酸反应速率快,完全反应所用时间短,C图错误;
D、电解水实验中,生成的氢气和氧气之间的质量比为1:8,体积比为2:1,D图错误;
故选:A。
二.填空题(共7小题)
20.【解答】解:(1)饱和溶液中溶质质量分数=×100%,20℃时饱和溶液的溶质质量分数为35%,则20℃时,ZnSO4的溶解度大于35g/100g水。
(2)70℃时,N点位于对应曲线的下方,70℃时,N点对应的ZnSO4溶液是不饱和溶液。
故答案为:
(1)大于;
(2)不饱和。
21.【解答】解:(1)当摄像系统接收到的障碍物图像越来越大时,像变大,像距变大,物距变小,则机器人与障碍物之间的距离变化是变小;
(2)对环境进行消毒属于预防传染病的切断传播途径;
(3)设需20%的过氧化氢溶液的质量为m,则:m×20%=4kg×5%,解得m=1kg。
故答案为:(1)变小;
(2)切断传播途径;
(3)1。
22.【解答】解:(1)烧杯里的硝酸铵溶液一定是饱和溶液的是图丙,丙是有不能继续溶解的硝酸铵存在,一定是饱和溶液。
(2)发现玻璃上的水结冰使烧杯和玻璃粘在一起,水由液体变为固体,该过程中玻璃上水发生物态变化的名称是凝固。
故答案为:
(1)丙;
(2)凝固。
23.【解答】解:(1)设需要60%的H2O2溶液的质量为x。
80g×48%=x×60%
解得x=64g;
(2)过氧化氢分解生成水和氧气,则化学反应方程式为2H2O22H2O+O2↑。
故答案为:(1)64;(2)2H2O22H2O+O2↑。
24.【解答】解:(1)t2℃时,A物质的溶解度为40 g,即100克水中最多可溶解49克A物质,将30 gA物质放入50 g水中,最多可溶解20克A物质,所以所得溶液中溶质与溶剂的质量比为20g:50g=2:5;故答案为:2:5;
(2)A物质的溶解度随温度的升高变化比B大,故A物质中混有少量的B物质,若提纯A物质,可采用的结晶方法是降温结晶;故答案为:降温结晶;
(3)观察图1可知t1℃时,A和C的溶解度相等,再根据饱和溶液中溶质的质量分数的大小与溶解度的大小关系一致,所以此时两溶液中溶质的质量分数大小相等;t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的硝酸铵固体溶解,硝酸铵溶解吸热,会导致试管内溶液的温度下降,溶质的溶解度也随之发生变化;A物质的溶解度随温度的升高而增大,出现降温结晶现象,溶质的质量分数减小,C物质的溶解度随温度的升高而减小,使得饱和溶液变为了不饱和溶液,但溶质的质量分数保持不变,故A、C溶液的溶质质量分数的大小关系是A<C;故答案为:A<C。
25.【解答】解:(1)叶肉主要由叶肉细胞构成,主要是通过光合作用制作有机物,属于营养组织;叶脉内有导管和筛管,其中筛管向下输到有机物。
(2)设需要40%的氢氧化钠溶液的质量为x。
x×40%=500g×10%
x=125g
所以需要加水的质量为500g﹣125g=375g。
故答案为:(1)营养组织;筛管;
(2)375。
26.【解答】解:(1)由题目的信息可知,在该温度下,乙溶液又加了5g无水硫酸铜粉末全部溶解,说明了乙中溶液是不是饱和溶液。
(2)丙中溶液的溶质质量分数=≈23.8%。
故答案为:(1)不是;
(2)23.8%。
三.实验探究题(共1小题)
27.【解答】解:(1)按体积计算,空气中氧气约占21%,为了保证水中溶解的氧气达到饱和状态,需要充入足够的氧气,故步骤1中排尽容器内的空气,再充入足够的氧气的目的是提高容器中氧气含量,使氧气在水中的溶解达到饱和状态;
(2)只要其他条件相同,氧气在水中的溶解达到饱和状态就不会对实验结果产生影响,故在步骤1中加入的氧气没有完全等量也不会影响实验结果,原因是只要都达到饱和,且袋内气压相等,气体质量略有差异,不会对实验结果造成影响;
(3)氧气的溶解度随温度的升高而减小,随压强的增大而增大,故在温度升高的条件下,要保持氧气的溶解度不变,可以增大压强。故在容器内气压为1.0×105帕时,把水温从20℃调整到该类鱼生存最适合温度30℃,使水中溶解氧的量保持不变,气压如何调整及理由是由图丙可知溶解氧含量随气压升高而增大,随温度升高而减小,所以在升高温度的情况下,要保证溶解氧含量不变,需增大压强。
故答案为:(1)提高容器中氧气含量,使氧气在水中的溶解达到饱和状态;
(2)合理,只要都达到饱和,且袋内气压相等,气体质量略有差异,不会对实验结果造成影响;
(3)由图丙可知溶解氧含量随气压升高而增大,随温度升高而减小,所以在升高温度的情况下,要保证溶解氧含量不变,需增大压强。
四.计算题(共1小题)
28.【解答】解:(1)设甲组中参加反应的碳酸氢钠的质量为x。
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
x 3.3g
x=6.3g
设甲组中碳酸钠的质量为y。
Na2CO3+HCl═NaHCO3+NaCl
106 84 Δm=106﹣84=22
y 6.85g﹣6.3g=0.55g
y=2.65g
则甲组中碳酸氢钠的质量为:6.85g﹣2.65g=4.2g
混合固体中Na2CO3和NaHCO3的质量比=2.65g:4.2g=53:84
答:混合固体中Na2CO3和NaHCO3的质量比53:84。
(2)根据混合固体中Na2CO3和NaHCO3的质量比=2.65g:4.2g=53:84,丙组27.4g固体混合物中碳酸钠的质量为:27.4g×=10.6g,
则固体混合物中碳酸氢钠的质量为:27.4g﹣10.6g=16.8g。
10.6g碳酸钠完全反应生成碳酸氢钠的质量为z。
Na2CO3+HCl═NaHCO3+NaCl
106 84
10.6g z
z=8.4g
设丙组中参加反应碳酸氢钠的质量为m。
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
m 4.4g
m=8.4g
则丙组反应结束后,剩余NaHCO3的质质为:16.8g+8.4g﹣8.4g=16.8g
丙组反应结束后,剩余溶液中NaHCO3的溶质质量分数为:=23.0%
答:丙组反应结束后,剩余溶液中NaHCO3的溶质质量分数是23.0%。
(3)设丁组中碳酸钠与稀盐酸恰好完全反应时,参加反应碳酸钠的质量为n。
Na2CO3+HCl═NaHCO3+NaCl
106 36.5
n 100g×14.6%
n=42.4g
根据混合固体中Na2CO3和NaHCO3的质量比=2.65g:4.2g=53:84,丁组固体混合物的质量至少为:42.4g÷=109.6g
答:丁中加入混合固体的质量至少是109.6g。
故答案为:(1)53:84;
(2)23.0%;
(3)109.6g。
五.解答题(共2小题)
29.【解答】解:(1)由题中信息可知,加热能使SO2全部逸出,则当压强一定时,升高温度,SO2在水中的溶解度将减小。
(2)SO2通入足量H2O2溶液中发生化合反应生成硫酸,可用化学方程式:SO2+H2O2═H2SO4表示。
(3)小宁取150mL该葡萄酒(加适量稀酸),加热使SO2全部逸出并将SO2通入足量的H2O2溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液50g,50g溶质质量分数为0.098%的硫酸溶液中,硫酸的质量为:50g×0.098%=0.049g,
设150mL该葡萄酒中SO2的质量为x,
SO2+H2O2═H2SO4
64 98
x 0.049g
=
x=0.032g
所以150mL该葡萄酒中SO2的质量为0.032g,则300mL该葡萄酒中SO2的质量为:0.032g×2=0.064g=64mg,体重为75kg的他爸爸SO2摄入量为:≈0.85mg/kg>0.7mg/kg,所以他爸爸SO2摄入量超标。
(4)小宁将选择形状类似烧瓶的容器来“醒酒”,明白了喝时倒少许葡萄酒且不停轻摇酒杯是为了使溶解的SO2尽量逸出。
故答案为:
(1)减小;
(2)SO2+H2O2═H2SO4;
(3)超标。
(4)烧瓶;使溶解的SO2尽量逸出。
30.【解答】解:(1)1个分子的过氧乙酸和醋酸中所含氧原子的个数分别为3和2,相同分子数的过氧乙酸和醋酸,所含氧原子的个数比是3:2;
(2)由反应的化学方程式NaClO+2HCl═NaCl+H2O+X↑可知,反应物中钠、氯、氢、氯原子个数分别为1、3、2、1,反应后的生成物中钠、氯、氢、氯原子个数分别为1、1、2、1,依据化学反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2;
(3)设需要水的质量是x。
则4%×100g=(100g+x)×2%
解得x=100g。
故答案为:(1)3:2;(2)Cl2;(3)100g。
一.选择题(共19小题)
1.(2023 宁波模拟)如图所示,某固体物质的溶液在一定温度下,进行恒温蒸发实验,下列说法正确的是( )
A.甲烧杯中一定是饱和溶液
B.乙烧杯中的溶液一定是不饱和溶液
C.丙烧杯和丁烧杯中的溶液溶质质量分数相等
D.固体在丙烧杯和丁烧杯中的溶解度不同
2.(2023 江北区二模)20℃时,将等质量的a、b两种固体分别加入盛有相同质量水的烧杯中,充分搅拌后现象如图甲所示,升温到50℃时,现象如图乙所示,a、b两种固体的溶解度曲线如图丙所示。下列说法中正确的是( )
A.图甲中a、b两溶液中的溶质质量相等
B.图乙中a、b两溶液一定都是不饱和溶液
C.图丙中N表示a物质的溶解度曲线
D.30℃时a、b两溶液的溶质质量分数不相等
3.(2023 慈溪市校级模拟)20℃时,在各盛有100g水的烧杯中,分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A.乙溶液可能是饱和溶液
B.溶液中溶质质量分数:甲>丙>乙
C.20℃时,乙溶液的溶质质量最小
D.升高温度,溶液的溶质质量分数都变大
4.(2023 慈溪市模拟)20℃时,取甲、乙、丙、丁四种纯净物各40g,分别加入到四个各盛有100g水的烧杯中,充分溶解,其溶解情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量/g 8.4 4 0 18.4
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20℃时四种物质溶解度的关系为:丁>甲>乙>丙
D.向四个烧杯中分别再加入100g 20℃的水后,所得溶液质量相等
5.(2023 宁海县模拟)20℃时几种物质在水中的溶解度如表所示。下列说法正确的是( )
物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克/100克水) 36.0 0.165 7.4 31.6
A.20℃时,饱和氯化钠溶液的溶质质量分数为36%
B.20℃时,100克水最多溶解7.4克氯酸钾
C.20℃时,将20克硝酸钾加入到50克水中形成的是不饱和溶液
D.20℃时,增加水的质量可以增大氢氧化钙的溶解度
6.(2023 余姚市模拟)已知硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
A.操作I一定是加溶质
B.①与②的溶质质量可能相等
C.②与③的溶质质量分数可能相等
D.整个实验过程中硝酸钾的溶解度一定不变
7.(2023 镇海区模拟)20℃室温时,小科进行了粗盐中难溶性杂质去除的实验,如图所示。下列有关实验过程的分析和描述,错误的是( )
A.20℃时,NaCl溶解度为36g
B.②中玻璃棒的作用是搅拌,加快溶解
C.③中下方烧杯内得到NaCl饱和溶液
D.④中待蒸发皿内出现较多固体时,停止加热
8.(2023 北仑区二模)室温为20℃时,将45g氯化钠固体均分成五份。依次加入到盛有100g水的烧杯中,充分溶解。实验数据如表,下列分析正确的是( )
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
A.20℃时,氯化钠的饱和溶液的质量分数为36%
B.分析实验数据可知氯化钠的溶解度随着温度升高而增大
C.仅凭实验④无法判断氯化钠溶液是否饱和
D.比较实验④⑤所得的溶液,实验⑤所得的溶液的溶质质量分数较大
9.(2023 宁波模拟)当条件改变时,饱和溶液与不饱和溶液可以发生相互转化。如图是有关的实验操作及溶液变化情况。下列说法正确的是( )
A.操作Ⅲ一定是加溶剂
B.甲与乙的溶质质量分数不可能相等
C.丙的溶质质量分数最高
D.该溶质的溶解度随温度升高而增大
10.(2023 余姚市模拟)向16.8g铁粉中先加入200g稀硫酸,充分反应后再逐滴加入一定量的硫酸铜溶液,反应过程中所得剩余固体质量与加入物质的质量关系如图所示,下列说法正确的是( )
A.稀硫酸中硫酸质量分数为9.8%
B.a点和b点溶液中的溶质种类相同
C.m=12
D.向c点中固体中加入稀硫酸,有气泡产生
11.(2023 慈溪市校级模拟)如图是20℃时一定质量的甲溶液进行恒温蒸发结晶的实验过程。下列说法正确的是( )
A.n的数值是11
B.蒸发前原溶液是饱和溶液
C.甲的溶解度随温度升高一定增大
D.20℃时,甲饱和溶液的溶质质量分数为50%
12.(2023 宁波模拟)在化学反应中,物质“量的多少”会影响反应的过程。下列说法正确的是( )
A.图①:等质量的KClO3粉末分别与不同质量的MnO2混合,充分加热
B.图②:等质量的Mg粉、Zn粉中分别逐滴滴入相同质量分数的稀盐酸,直至过量
C.图③:一定量的Cu(NO3)2和AgNO3混合溶液中逐渐加入Fe粉,直至过量
D.图④:t℃时,向一定量的饱和石灰水中加入生石灰
13.(2023 海曙区一模)甲图是氯化钠和硝酸钾的溶解度曲线。20℃时,取两种物质各36g分别溶解在100g水中,温度从20℃升高至50℃,如图乙、丙所示。下列说法正确的是( )
A.在图甲中,P点时硝酸钾和氯化钠的溶解度不相等
B.在图乙中,A烧杯内溶解的是氯化钠
C.在图丙中,B烧杯内的溶液为饱和溶液
D.在图丙中,A烧杯内溶液的溶质质量分数为36%
14.(2023 北仑区一模)在室温下,小乐完成了如下实验,若固体A(不含结晶水)溶于水既不吸热,也不放热,且实验过程中。不考虑水的蒸发。则下列说法正确的是( )
A.在室温下,溶液①为饱和溶液
B.在t℃时,A的溶解度一定为50克
C.溶液②和溶液④的溶质质量分数相同
D.溶液③和溶液④的溶液质量相同
15.(2023 鄞州区校级一模)小宁在配制硝酸钾溶液时得到如表数据,据此分析以下说法不正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为20.9克
B.②所得溶液不一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
16.(2023 宁波一模)用MgCl2溶液喷洒路面可融雪。已知20℃时,MgCl2的溶解度为54.6克,若按表中数据配制溶液(温度均为20℃),则下列说法正确的是( )
序号 ① ② ③ ④
MgCl2的质量/克 40 50 60 70
H2O的质量/克 100 100 100 100
A.①所得溶液,其溶质和溶剂的质量比为2:7
B.②所得溶液,其溶质的质量分数为50%
C.③④所得溶液均为20℃时MgCl2的饱和溶液
D.③所得溶液的溶质质量分数小于④所得溶液
17.(2022 慈溪市模拟)下列四个图象能正确反映对应变化关系的是( )
A.电解水
B.等质量且形状、大小均相同的锌、铁两种金属分别逐滴滴入过量的同种稀硫酸
C.硝酸银、硝酸铜的混合溶液加入锌粉至过量
D.氯化镁溶液与氢氧化钙溶液混合,充分反应
18.(2022 慈溪市模拟)一木块漂浮于50℃的硝酸钾饱和溶液中,某一条件改变时,木块排开液体的体积随时间发生了如图所示的变化,下列条件可以达到目的是( )
①增加溶质
②蒸发溶剂
③增加溶剂
④升高温度
⑤降低温度
A.②④ B.①④ C.②③ D.③⑤
19.(2022 海曙区模拟)下列四个图象反映对应变化关系正确的是( )
A.一定量的镁在过量的氧气中充分燃烧
B.红磷在密闭容器中燃烧
C.等质量的碳酸钙与足量溶质质量分数相同的稀盐酸反应
D.电解水实验中,生成的氢气和氧气之间的质量关系
二.填空题(共7小题)
20.(2023 鄞州区一模)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。
(1)20℃时,ZnSO4的溶解度 (填“大于”“小于”或“等于”)35g/100g水。
(2)70℃时,N点对应的ZnSO4溶液是 (填“饱和”或“不饱和”)溶液。
21.(2022 北仑区二模)为抗击新冠肺炎,消毒机器人(如图)在定点医院正式上岗,协助甚至替代人去做危险性的工作。该机器人自主移动时,利用紫外线和雾化的过氧化氢进行多点消毒,有效预防病菌传播。
(1)机器人通过自带的摄像系统避开障碍物,调控行进路线。摄像头的镜头相当于一个凸透镜,当摄像系统接收到的障碍物图像越来越大时,则机器人与障碍物之间的距离变化是 。
(2)机器人对环境进行消毒,属于预防传染病措施中的 。
(3)该机器一次可加入4千克溶质质量分数为5%的过氧化氢溶液,则需 千克20%的过氧化氢溶液加水稀释而成。
22.(2023 北仑区模拟)如图所示,把装有适量水的烧杯放在湿玻璃上,向烧杯中两次加入硝酸铵固体充分搅拌,发现玻璃上的水结冰使烧杯和玻璃粘在一起。
(1)烧杯里的硝酸铵溶液一定是饱和溶液的是图 。
(2)该过程中玻璃上水发生物态变化的名称是 。
23.(2023 宁波模拟)小宁同学用溶质质量分数为48%的H2O2溶液80g、少量洗发水(泡发剂)以及KI溶液50g完成了“大象牙膏”实验。本实验以KI为催化剂,加速H2O2的分解,在短时间内即可冒出大量泡沫。
(1)欲配制80g48%的H2O2溶液,需要60%的H2O2溶液 g进行稀释。
(2)用化学方程式表示本实验的主要反应: 。
24.(2022 镇海区二模)如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为 。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是 。
(3)t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是 。
25.(2022 慈溪市模拟)如图是精致的叶脉书签,其制作原理是利用氢氧化钠的腐蚀性,10%的氢氧化钠溶液可腐蚀叶肉且不破坏叶脉。
(1)腐蚀掉的叶肉是 ,叶脉中的 能够向下运输有机物。
(2)如果用40%的氢氧化钠溶液来配制所需氢氧化钠溶液500g,需要加水 g。
26.(2022 海曙区模拟)甲烧杯中盛有30℃溶质质量分数为20%的饱和硫酸铜溶液100克,进行如图所示实验(不考虑水分蒸发)。
(1)乙中溶液 (填“是”“不是”或“可能是”)饱和溶液。
(2)若丙中无晶体析出,则溶液的溶质质量分数为(结果保留到0.1%) 。
三.实验探究题(共1小题)
27.(2023 镇海区模拟)如图甲是小平网购收到的活鱼,鱼在密封袋中存活时间长短与水中溶解氧的含量相关。为了探究氧气在水中溶解能力的影响因素,小平做了以下实验。
步骤1:将相同的7个密封容器标为1号、2号、3号......,在容器内分别装入等量的水后排尽容器内的空气,再充入足够的氧气。
步骤2:将7个密封容器的水温控制在0℃、5℃、10℃、15℃、20℃、25℃、30℃,然后通过调整密封圈把容器内气压调整为0.9×105帕。通过氧气含量传感器显示水中溶解氧气的质量(如图乙)。
步骤3:将气压调整到1×105帕、1.05×105帕,重复步骤2,记录数据并绘制如图丙所示曲线。
(1)步骤1中“排尽容器内的空气,再充入足够的氧气”的目的是: 。
(2)某同学认为氧气在水中的溶解能力为微溶,即使在步骤1中加入的氧气没有完全等量也不会影响实验结果,你认为该观点是否合理,并说明理由: 。
(3)在容器内气压为1.0×105帕时,把水温从20℃调整到该类鱼生存最适合温度30℃,通过调整密封圈来改变容器内的气压,使水中溶解氧的量保持不变,气压该怎么调整,请说明理由: 。
四.计算题(共1小题)
28.(2023 宁波模拟)四个相同的容器中,分别加入一定质量、均匀混合的Na2CO3和NaHCO3固体,每个容器中逐滴滴入溶质质量分数为14.6%的稀盐酸,产生气体的情况如下表所示。
组别 甲 乙 丙 丁
混合固体质量/g 6.85 13.7 27.4 ?
稀盐酸质量/g 50 50 50 100
产生气体的质量/g 3.3 6.6 4.4 0
已知:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑
请分析计算:
(1)混合固体中Na2CO3和NaHCO3的质量比。
(2)丙组反应结束后,剩余溶液中NaHCO3的溶质质量分数是多少?(假设溶液不饱和,计算结果保留一位小数)
(3)丁中加入混合固体的质量至少是多少?
五.解答题(共2小题)
29.(2023 宁波模拟)葡萄酒中充入SO2具有保鲜、杀菌、抗氧化等作用,但过多摄入SO2对人类身体有一定的毒性作用,我国规定人体每天SO2摄入量最高不超过0.7mg/kg。小宁每次见爸爸喝酒时都提前打开葡萄酒,倒入形状特殊的容器中“醒酒”,喝时倒少许葡萄酒且不停轻摇酒杯。小宁取150mL该葡萄酒(加适量稀酸),加热使SO2全部逸出并将SO2通入足量的H2O2溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液50g。求:
(1)分析可知:当压强一定时,升高温度,SO2在水中的溶解度将 。
(2)SO2通入足量H2O2溶液中发生化合反应,可用化学方程式 表示。
(3)假设小宁爸爸一次喝葡萄酒300mL,酒中的SO2全部被喝入。计算说明体重为75kg的他爸爸SO2摄入量是否超标?
(4)小宁将选择形状类似 (选填“量筒”或“烧瓶”)的容器来“醒酒”,明白了喝时倒少许葡萄酒且不停轻摇酒杯是为了 。
30.(2022 海曙区校级三模)2020年出现了罕见的新型冠状病毒疫情后,使得消毒剂的选择、利用以及相关问题的探讨与研究又成了热门话题.常见的消毒消毒剂有:84消毒液、过氧乙酸(CH3COOOH)溶液、双氧水溶液、醋酸(CH3COOH)溶液等,请回答以下几个问题:
(1)相同分子数的过氧乙酸和醋酸,所含氧原子的个数比是 ;
(2)84消毒液和洁厕灵混合使用时会发生化学反应NaClO+2HCl=NaCl+H2O+X↑,X气体有毒,因此二者不能混合使用。那么X的化学式为 ;
(3)要配制2%的双氧水溶液,已经有4%的双氧水溶液100g,所需水的质量为 。
参考答案与试题解析
一.选择题(共19小题)
1.【解答】解:A、第一次蒸发10g水,没有晶体析出,则甲烧杯中一定是不饱和溶液,故选项说法错误。
B、第一次蒸发10g水,没有晶体析出,乙烧杯中的溶液可能是不饱和溶液,也可能是恰好饱和的溶液,故选项说法错误。
C、丙烧杯和丁烧杯中的溶液均为一定温度下的饱和溶液,溶质质量分数相等,故选项说法正确。
D、由于温度相同,固体在丙烧杯和丁烧杯中的溶解度相同,故选项说法错误。
故选:C。
2.【解答】解:A、20℃时,将等质量a、b两种固体,分别加入到盛有相同质量水的烧杯中,b固体完全溶解度,a固体没有完全溶解,所以图甲a、b溶液中的溶质质量不相等,故A错误;
B、由于图甲中可以知道20℃时a的溶解度小于b的溶解度,图乙无溶质剩余,所以b一定是不饱和溶液,而在50℃时,a的溶解度大于b的溶解度,所以a一定也是不饱和溶液,故B正确;
C、信息根据图甲中可以知道20℃时a的溶解度小于b的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故M表示的是a物质的溶解度曲线,故C错误;
D、根据图丙可知两种物质的溶解度都随温度升高而增大,因此30℃时,a、b的溶解度都比20℃时大,且30℃时两物质的溶解度相等,当a中的物质完全溶解时,溶质的质量分数就会相等,故D错误。
故选:B。
3.【解答】解:A、20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物,充分溶解后,甲中不溶解的物质最多,丙其次,乙全部溶解,所得溶液甲、丙一定是饱和溶液,乙可能是恰好饱和的溶液,也可能是不饱和溶液,故选项说法正确。
B、溶剂质量相等,溶解的溶质质量由多到少的顺序是乙>丙>甲,溶液溶质的质量分数:乙>丙>甲,故选项说法错误。
C、乙中的溶质全部溶解,因此20℃时,乙溶液的溶质质量最大,故选项说法错误。
D、无法确定溶解度受温度影响的变化趋势,升高温度,溶液溶质的质量分数不一定变大,故选项说法错误。
故选:A。
4.【解答】解:A、丙物质未溶解固体的质量为0,则丙溶液可能恰好为饱和溶液,也可能为不饱和溶液,故选项说法错误。
B、溶剂质量相同,而甲、乙、丙、丁四种溶液中溶质质量的大小关系为丙>乙>甲>丁,则丙溶液的溶质质量分数最大,故选项说法错误。
C、溶剂质量相同(100g),而甲、乙、丙、丁四种溶液中溶质质量的大小关系为丙>乙>甲>丁,则20℃时四种物质质溶解度的关系为:丙>乙>甲>丁,故选项说法错误。
D、根据图表中的数据知,在20℃时,甲、乙、丙、丁在100g水中溶解的质量分别是:(40g﹣8.4g=31.6g)、(40g﹣4g=36g)、40g、(40g﹣18.4g=21.6g),则四杯溶液中各加入20℃的100g水后,剩余固体均全部溶解,四种物质均为不饱和溶液,溶液质量相等,故选项说法正确。
故选:D。
5.【解答】解:A、20℃时,氯化钠的溶解度为36.0g,则20℃时,饱和氯化钠溶液的溶质质量分数为×100%<36%,故选项说法错误。
B、20℃时,氯酸钾的溶解度为7.4g,则20℃时,100克水最多溶解7.4克氯酸钾,故选项说法正确。
C、20℃时,硝酸钾的溶解度为31.6g,则20℃时,100克水最多溶解31.6g硝酸钾,则20℃时,将20克硝酸钾加入到50克水中,最多能溶解15.8g,形成的是饱和溶液,故选项说法错误。
D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶剂质量、溶质质量多少的影响,20℃时,增加水的质量不能增大氢氧化钙的溶解度,故选项说法错误。
故选:B。
6.【解答】解:A、操作I不一定是加溶质,也可能是蒸发溶剂或降低温度,故选项说法错误。
B、若采用的是降低温度至恰好饱和的方法,①与②的溶质质量可能相等,故选项说法正确。
C、②与③均为该温度下的饱和溶液,②与③的溶质质量分数一定相等,故选项说法错误。
D、操作I可能采用的降低温度的方法,则整个实验过程中硝酸钾的溶解度会发生改变,故选项说法错误。
故选:B。
7.【解答】解:A、由图可知,20℃时,NaCl溶解度为36g,故A正确;
B、②是溶解过程,溶解过程中玻璃棒的作用是搅拌,加快溶解,故B正确;
C、20℃时,NaCl溶解度为36g,则20℃时,25g水中最多溶解9g氯化钠,而粗盐中含有难溶性杂质,则9g粗盐中,氯化钠的质量小于9g,则20℃时,将9g粗盐溶于25g水中得到的是NaCl的不饱和溶液,而不是NaCl饱和溶液,故C错误;
D、④是蒸发过程,蒸发过程中待蒸发皿内出现较多固体时,停止加热,利用余热蒸干,故D正确;
故选:C。
8.【解答】解:A、室温为20℃时,将45g氯化钠固体均分成五份。依次加入到盛有100g水的烧杯中,充分溶解,最多能形成136g溶液,则该温度下100g水中最多能溶解36g氯化钠,则20℃时,氯化钠的溶解度为36g,氯化钠的饱和溶液的质量分数为×100%<36%,故选项说法错误。
B、表格数据是20℃时,100g水中最多能形成136g溶液,不能得出氯化钠的溶解度随着温度升高而增大,故选项说法错误。
C、仅凭实验④无法判断氯化钠溶液是否饱和,还需结合⑤中数据确定其不能继续溶解氯化钠,故选项说法正确。
D、④⑤均是该温度下的饱和溶液,溶液的溶质质量分数相等,故选项说法错误。
故选:C。
9.【解答】解:A、由乙到丙的操作可知,温度升高,剩余固体的质量减少;操作Ⅲ不一定是加溶剂,也可能是升高温度的方法,故选项说法错误。
B、甲加入该溶质后,有不能继续溶解的溶质存在,甲可能是饱和溶液,则甲与乙的溶质质量分数可能相等,故选项说法错误。
C、甲乙丙丁中,溶剂质量相等,丁中溶质质量最多,则丁的溶质质量分数最高,故选项说法错误。
D、由乙到丙的操作可知,温度升高,剩余固体的质量减少,该溶质的溶解度随温度升高而增大,故选项说法正确。
故选:D。
10.【解答】解:A、由题意和图示可知,向16.8g铁粉中先加入200g稀硫酸,参加反应的铁的质量为16.8g﹣11.2g=5.6g,与硫酸铜反应的铁的质量为11.2g,
设稀硫酸中溶质的质量为x。
Fe+H2SO4=FeSO4+H2↑
56 98
5.6g x
解得:x=9.8g
稀硫酸中硫酸质量分数为:=4.9%。
故A错误。
B、a点是铁与稀硫酸恰好反应,b点是铁与硫酸铜部分反应,溶液中的溶质都是硫酸亚铁和硫酸铜,溶液中的溶质种类相同,故B正确;
C、设生成铜的质量为y。
Fe+CuSO4=Cu+FeSO4
56 64
11.2g y
解得:y=12.8g
故C错误;
D、由图像可知,c点铁与硫酸铜恰好完全反应,固体中只有铜,加入稀硫酸,没有气泡产生,故D错误。
故选:B。
11.【解答】解:A、20℃时一定质量的甲溶液进行恒温蒸发10g水,析出1g甲,再蒸发10g水,析出5g甲,共6g甲;再蒸发10g水,析出5g甲,共析出11g甲;故选项正确;
B、20℃时一定质量的甲溶液进行恒温蒸发10g水,析出1g甲,再蒸发10g水,析出5g甲,说明原溶液是不饱和溶液,饱和错误;故选项错误;
C、甲的溶解度随温度升高一定增大错误,应该是可能增大;故选项错误;
D、20℃时,甲饱和溶液的溶质质量分数=,50%错误,故选项错误;
故选:A。
12.【解答】解:A、反应中催化剂不会影响产物的质量,故错误;
B、等质量的Mg粉、Zn粉中分别逐滴滴入相同质量分数的稀盐酸,初始阶段生成氢气的质量相同,斜线相同,最终生成氢气的质量为镁产生的氢气多,故错误;
C、在一定量 AgNO3 和 Cu(NO3)2 的混合溶液中加入铁粉,铁先与硝酸银反应,当硝酸银完全反应后再与硝酸铜反应,随着铁的加入,金属单质逐渐为只有银,到银和铜,最后为银、铜和铁,故正确;
D、氧化钙能与水发生反应生成氢氧化钙,氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,最终变为0,故错误;
故选:C。
13.【解答】解:A、在图甲中,P点是硝酸钾和氯化钠的溶解度曲线的交点,P点时硝酸钾和氯化钠的溶解度相等,故A错误;
B、在20℃时,氯化钠的溶解度大于硝酸钾的溶解度,在图乙中,A中溶质全部溶解了,B中溶质有剩余,A烧杯内溶解的是氯化钠,故B正确;
C、由上述分析可知,在B中溶解的是硝酸钾,在50℃硝酸钾的溶解度是85.5g,现在只溶解了36g,是不饱和溶液,故C错误;
D、在图丙中,A烧杯内溶液的溶质质量分数为≈26.5%,故D错误。
故选:B。
14.【解答】解:A.在室温下,溶液①溶质全部溶解,故不一定为饱和溶液;错误;
B.在t℃时,10g物质A全部溶解到20g水中不一定得到饱和溶液,故在t℃时,A的溶解度不一定为50克;
C.由图示可知,溶液②和溶液④都是室温时,且溶质和溶剂的质量相等,故的溶质质量分数相同;
D.由图示可知,溶液③是在t℃时,10g物质A全部溶解到20g水中;溶液④是由t℃冷却到室温时,由溶液②可知会有晶体析出的,故溶液③和溶液④的溶液质量不相同;
故选:C。
15.【解答】解:A、10℃时,在100g的水中,加入40g的硝酸钾,形成溶液的质量为120.9g,所以硝酸钾的溶解度为20.9g,故A正确;
B、②中的固体全部溶解,因此②所得溶液不一定是60℃时硝酸钾的饱和溶液,故B正确;
C、若通过加热将①中剩余硝酸钾全部溶解,溶质质量增大,则溶液的溶质质量分数增大,故C错误;
D、②所得溶液溶质质量分数为×100%≈28.6%,降温至10℃,溶质质量分数变成×100%≈17.3%,则溶液的溶质质量分数会变小,故D正确。
故选:C。
16.【解答】解:A、①所得溶液,其溶质和溶剂的质量比为40:100=2:5,故错误;
B、②所得溶液,其溶质的质量分数为≈33.3%,故错误;
C、③和④溶液中溶质只能溶解54.6g,所得溶液均为20℃时MgCl2的饱和溶液,故正确;
D、③和④溶液中溶质都溶解54.6g,且溶液质量相等,即③所得溶液的溶质质量分数等于④所得溶液,故错误。
故选:C。
17.【解答】解:A、通电分解水,生成氢气和氧气的体积(而不是质量)之比为2:1,故选项图象错误。
B、等质量且形状、大小均相同的锌、铁两种金属分别逐滴滴入过量的同种稀硫酸,若消耗硫酸相同,则生成氢气质量相同,故开始两斜线重合,后因硫酸过量,铁消耗硫酸多,生成氢气多,拐点高些,故选项图象错误。
C、锌的金属活动性比银、铜强,硝酸银、硝酸铜的混合溶液加入锌粉至过量,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完,若还有锌粉,锌才能与硝酸铜反应生成硝酸锌和铜;Zn+2AgNO3═Zn(NO3)2+2Ag,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,溶液的质量会减少,则硝酸铜的质量分数先增大,后逐渐减小,最终减小至0,故选项图象正确。
D、氯化镁溶液与氢氧化钙溶液混合生成氢氧化镁沉淀和氯化钙,氢氧化镁和氯化钙的质量增加,氯化镁和氢氧化钙的质量减少,最终氯化镁或氢氧化钙的质量减少至0;反应的化学方程式为Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,每74份质量的氢氧化钙与95份质量的氯化镁反应生成58份质量的氢氧化镁沉淀和111份质量的氯化钙,图中一种反应物减少的质量与一种生成物增加的质量相等,是不可能的,故选项图象错误。
故选:C。
18.【解答】解:观察图象可知,木块排开液体的体积增大,由F=ρgV排,则液体的密度减小。
①增加溶质,不能继续溶解,溶液的密度不变,不符合要求。
②蒸发溶剂,有硝酸钾晶体析出,溶液仍是该温度下的饱和溶液,溶液的密度不变,不符合要求。
③增加溶剂,溶液的密度变小,符合要求。
④升高温度,硝酸钾的溶解度增大,但溶液的组成没有发生改变,不符合要求。
⑤硝酸钾的溶解度随着温度的升高而增大,温度降低,有硝酸钾晶体析出,溶液的密度变小,可采用降低温度的方法。
故③⑤符合题意。
故选:D。
19.【解答】解:A、镁在氧气中燃烧生成氧化镁,一定量的镁在过量的氧气中充分燃烧后镁的质量0,氧气的质量不为0,氧化镁质量等于参加反应的氧气和镁的质量和,A图正确;
B、红磷在密闭容器中燃烧生成五氧化二磷固体,反应后固体质量不为0,B图错误;
C、粉末状碳酸钙与稀盐酸反应速率快,完全反应所用时间短,C图错误;
D、电解水实验中,生成的氢气和氧气之间的质量比为1:8,体积比为2:1,D图错误;
故选:A。
二.填空题(共7小题)
20.【解答】解:(1)饱和溶液中溶质质量分数=×100%,20℃时饱和溶液的溶质质量分数为35%,则20℃时,ZnSO4的溶解度大于35g/100g水。
(2)70℃时,N点位于对应曲线的下方,70℃时,N点对应的ZnSO4溶液是不饱和溶液。
故答案为:
(1)大于;
(2)不饱和。
21.【解答】解:(1)当摄像系统接收到的障碍物图像越来越大时,像变大,像距变大,物距变小,则机器人与障碍物之间的距离变化是变小;
(2)对环境进行消毒属于预防传染病的切断传播途径;
(3)设需20%的过氧化氢溶液的质量为m,则:m×20%=4kg×5%,解得m=1kg。
故答案为:(1)变小;
(2)切断传播途径;
(3)1。
22.【解答】解:(1)烧杯里的硝酸铵溶液一定是饱和溶液的是图丙,丙是有不能继续溶解的硝酸铵存在,一定是饱和溶液。
(2)发现玻璃上的水结冰使烧杯和玻璃粘在一起,水由液体变为固体,该过程中玻璃上水发生物态变化的名称是凝固。
故答案为:
(1)丙;
(2)凝固。
23.【解答】解:(1)设需要60%的H2O2溶液的质量为x。
80g×48%=x×60%
解得x=64g;
(2)过氧化氢分解生成水和氧气,则化学反应方程式为2H2O22H2O+O2↑。
故答案为:(1)64;(2)2H2O22H2O+O2↑。
24.【解答】解:(1)t2℃时,A物质的溶解度为40 g,即100克水中最多可溶解49克A物质,将30 gA物质放入50 g水中,最多可溶解20克A物质,所以所得溶液中溶质与溶剂的质量比为20g:50g=2:5;故答案为:2:5;
(2)A物质的溶解度随温度的升高变化比B大,故A物质中混有少量的B物质,若提纯A物质,可采用的结晶方法是降温结晶;故答案为:降温结晶;
(3)观察图1可知t1℃时,A和C的溶解度相等,再根据饱和溶液中溶质的质量分数的大小与溶解度的大小关系一致,所以此时两溶液中溶质的质量分数大小相等;t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的硝酸铵固体溶解,硝酸铵溶解吸热,会导致试管内溶液的温度下降,溶质的溶解度也随之发生变化;A物质的溶解度随温度的升高而增大,出现降温结晶现象,溶质的质量分数减小,C物质的溶解度随温度的升高而减小,使得饱和溶液变为了不饱和溶液,但溶质的质量分数保持不变,故A、C溶液的溶质质量分数的大小关系是A<C;故答案为:A<C。
25.【解答】解:(1)叶肉主要由叶肉细胞构成,主要是通过光合作用制作有机物,属于营养组织;叶脉内有导管和筛管,其中筛管向下输到有机物。
(2)设需要40%的氢氧化钠溶液的质量为x。
x×40%=500g×10%
x=125g
所以需要加水的质量为500g﹣125g=375g。
故答案为:(1)营养组织;筛管;
(2)375。
26.【解答】解:(1)由题目的信息可知,在该温度下,乙溶液又加了5g无水硫酸铜粉末全部溶解,说明了乙中溶液是不是饱和溶液。
(2)丙中溶液的溶质质量分数=≈23.8%。
故答案为:(1)不是;
(2)23.8%。
三.实验探究题(共1小题)
27.【解答】解:(1)按体积计算,空气中氧气约占21%,为了保证水中溶解的氧气达到饱和状态,需要充入足够的氧气,故步骤1中排尽容器内的空气,再充入足够的氧气的目的是提高容器中氧气含量,使氧气在水中的溶解达到饱和状态;
(2)只要其他条件相同,氧气在水中的溶解达到饱和状态就不会对实验结果产生影响,故在步骤1中加入的氧气没有完全等量也不会影响实验结果,原因是只要都达到饱和,且袋内气压相等,气体质量略有差异,不会对实验结果造成影响;
(3)氧气的溶解度随温度的升高而减小,随压强的增大而增大,故在温度升高的条件下,要保持氧气的溶解度不变,可以增大压强。故在容器内气压为1.0×105帕时,把水温从20℃调整到该类鱼生存最适合温度30℃,使水中溶解氧的量保持不变,气压如何调整及理由是由图丙可知溶解氧含量随气压升高而增大,随温度升高而减小,所以在升高温度的情况下,要保证溶解氧含量不变,需增大压强。
故答案为:(1)提高容器中氧气含量,使氧气在水中的溶解达到饱和状态;
(2)合理,只要都达到饱和,且袋内气压相等,气体质量略有差异,不会对实验结果造成影响;
(3)由图丙可知溶解氧含量随气压升高而增大,随温度升高而减小,所以在升高温度的情况下,要保证溶解氧含量不变,需增大压强。
四.计算题(共1小题)
28.【解答】解:(1)设甲组中参加反应的碳酸氢钠的质量为x。
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
x 3.3g
x=6.3g
设甲组中碳酸钠的质量为y。
Na2CO3+HCl═NaHCO3+NaCl
106 84 Δm=106﹣84=22
y 6.85g﹣6.3g=0.55g
y=2.65g
则甲组中碳酸氢钠的质量为:6.85g﹣2.65g=4.2g
混合固体中Na2CO3和NaHCO3的质量比=2.65g:4.2g=53:84
答:混合固体中Na2CO3和NaHCO3的质量比53:84。
(2)根据混合固体中Na2CO3和NaHCO3的质量比=2.65g:4.2g=53:84,丙组27.4g固体混合物中碳酸钠的质量为:27.4g×=10.6g,
则固体混合物中碳酸氢钠的质量为:27.4g﹣10.6g=16.8g。
10.6g碳酸钠完全反应生成碳酸氢钠的质量为z。
Na2CO3+HCl═NaHCO3+NaCl
106 84
10.6g z
z=8.4g
设丙组中参加反应碳酸氢钠的质量为m。
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
m 4.4g
m=8.4g
则丙组反应结束后,剩余NaHCO3的质质为:16.8g+8.4g﹣8.4g=16.8g
丙组反应结束后,剩余溶液中NaHCO3的溶质质量分数为:=23.0%
答:丙组反应结束后,剩余溶液中NaHCO3的溶质质量分数是23.0%。
(3)设丁组中碳酸钠与稀盐酸恰好完全反应时,参加反应碳酸钠的质量为n。
Na2CO3+HCl═NaHCO3+NaCl
106 36.5
n 100g×14.6%
n=42.4g
根据混合固体中Na2CO3和NaHCO3的质量比=2.65g:4.2g=53:84,丁组固体混合物的质量至少为:42.4g÷=109.6g
答:丁中加入混合固体的质量至少是109.6g。
故答案为:(1)53:84;
(2)23.0%;
(3)109.6g。
五.解答题(共2小题)
29.【解答】解:(1)由题中信息可知,加热能使SO2全部逸出,则当压强一定时,升高温度,SO2在水中的溶解度将减小。
(2)SO2通入足量H2O2溶液中发生化合反应生成硫酸,可用化学方程式:SO2+H2O2═H2SO4表示。
(3)小宁取150mL该葡萄酒(加适量稀酸),加热使SO2全部逸出并将SO2通入足量的H2O2溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液50g,50g溶质质量分数为0.098%的硫酸溶液中,硫酸的质量为:50g×0.098%=0.049g,
设150mL该葡萄酒中SO2的质量为x,
SO2+H2O2═H2SO4
64 98
x 0.049g
=
x=0.032g
所以150mL该葡萄酒中SO2的质量为0.032g,则300mL该葡萄酒中SO2的质量为:0.032g×2=0.064g=64mg,体重为75kg的他爸爸SO2摄入量为:≈0.85mg/kg>0.7mg/kg,所以他爸爸SO2摄入量超标。
(4)小宁将选择形状类似烧瓶的容器来“醒酒”,明白了喝时倒少许葡萄酒且不停轻摇酒杯是为了使溶解的SO2尽量逸出。
故答案为:
(1)减小;
(2)SO2+H2O2═H2SO4;
(3)超标。
(4)烧瓶;使溶解的SO2尽量逸出。
30.【解答】解:(1)1个分子的过氧乙酸和醋酸中所含氧原子的个数分别为3和2,相同分子数的过氧乙酸和醋酸,所含氧原子的个数比是3:2;
(2)由反应的化学方程式NaClO+2HCl═NaCl+H2O+X↑可知,反应物中钠、氯、氢、氯原子个数分别为1、3、2、1,反应后的生成物中钠、氯、氢、氯原子个数分别为1、1、2、1,依据化学反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2;
(3)设需要水的质量是x。
则4%×100g=(100g+x)×2%
解得x=100g。
故答案为:(1)3:2;(2)Cl2;(3)100g。
