第一单元 物质及其变化 B卷 能力提升(含解析)_2023-2024学年高一化学人教版(2019)必修第一册单元达标测试卷
文档属性
| 名称 | 第一单元 物质及其变化 B卷 能力提升(含解析)_2023-2024学年高一化学人教版(2019)必修第一册单元达标测试卷 |  | |
| 格式 | docx | ||
| 文件大小 | 512.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 18:28:06 | ||
图片预览




文档简介
第一单元 物质及其变化 B卷 能力提升—2023-2024学年高一化学人教版(2019)必修第一册单元达标测试卷
(满分100分 考试时间:90分)
一、选择题:本题共15小题,每题3分,共45分。
1.下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是( )
A.定期清淤,疏通河道
B.化工企业“三废”处理后,达标排放
C.利用微生物降解水域中的有毒有害物质
D.河道中的垃圾回收分类后,进行无害化处理
2.按照物质的树状分类法和交叉分类法,应属于( )
①酸
②氢化物
③氧化物
④含氧酸
⑤难挥发性酸
⑥强氧化性酸
⑦一元酸
⑧化合物
⑨混合物
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①⑨ D.①④⑤⑥⑦
3.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A.胆矾的化学式为
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
4.当一束光通过下列分散系时,能产生丁达尔效应的是( )
A.稀盐酸 B.蔗糖水
C.胶体 D.溶液
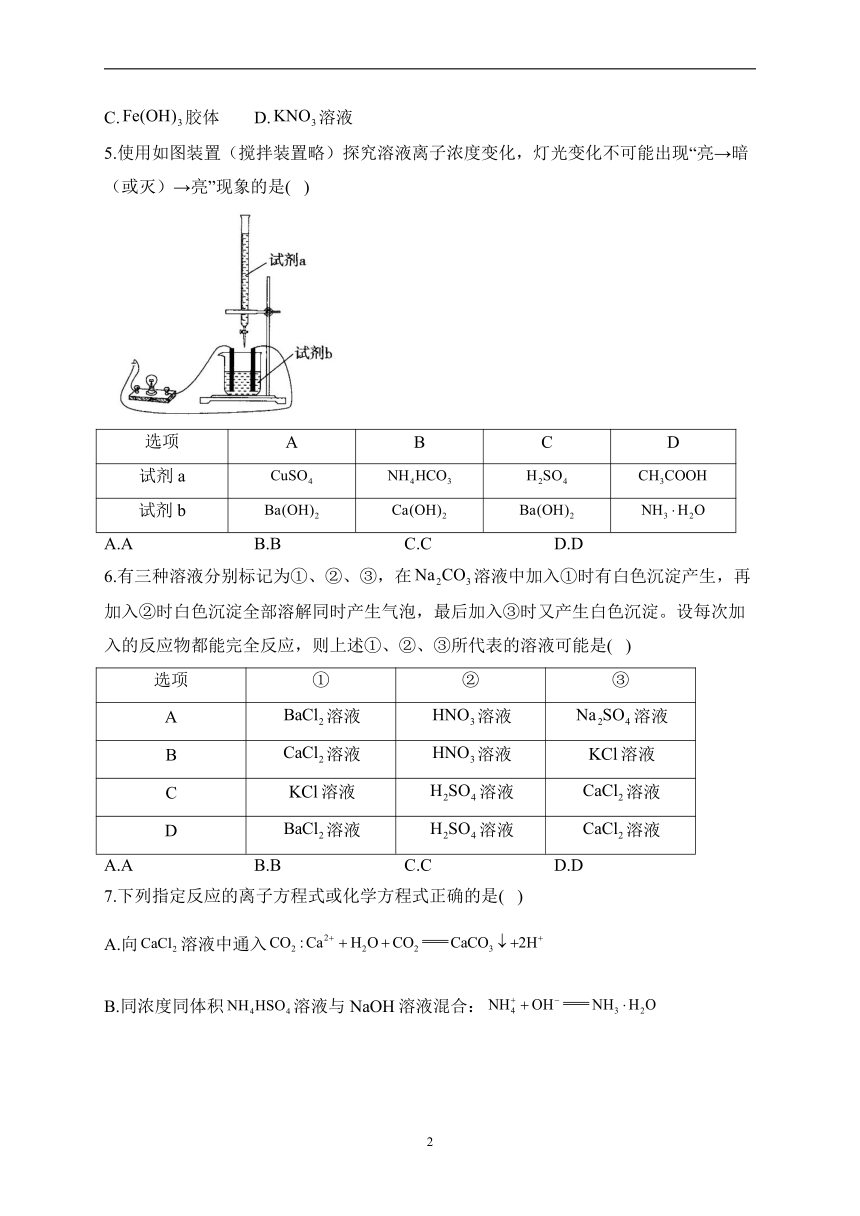
5.使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项 A B C D
试剂a
试剂b
A.A B.B C.C D.D
6.有三种溶液分别标记为①、②、③,在溶液中加入①时有白色沉淀产生,再加入②时白色沉淀全部溶解同时产生气泡,最后加入③时又产生白色沉淀。设每次加入的反应物都能完全反应,则上述①、②、③所代表的溶液可能是( )
选项 ① ② ③
A 溶液 溶液 溶液
B 溶液 溶液 溶液
C 溶液 溶液 溶液
D 溶液 溶液 溶液
A.A B.B C.C D.D
7.下列指定反应的离子方程式或化学方程式正确的是( )
A.向溶液中通入
B.同浓度同体积溶液与NaOH溶液混合:
C.澄清的石灰水久置后出现白色固体:
D.向溶液中加入足量Zn粉,溶液蓝色消失:
8.汽车剧烈碰撞时,安全气囊中发生反应。对于该反应,下列判断正确的是( )
A.中氮元素的化合价为-3价
B.氧化剂和还原剂是同一物质
C.氧化产物与还原产物分子数之比为15:1
D.反应过程中转移10个电子,则产生10个分子
9.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.稀氨水:
B.稀盐酸:
C.稀溶液:
D.稀溶液:
10.有一包白色固体粉末,其中可能含有中的一种或几种,现做以下实验(所加试剂均足量):
则下列说法正确的是( )
A.原粉末中一定有
B.KCl是否存在无法确定
C.白色沉淀乙可能是AgCl和的混合物
D.原粉末中一定没有,可能有KCl
11.下列物质的应用中,利用了氧化还原反应的是( )
A.用石灰乳脱除烟气中的
B.用明矾溶于水形成胶体处理污水
C.用盐酸去除铁锈(主要成分)
D.用84消毒液(有效成分NaClO)杀灭细菌
12.草酸()是一种弱酸,加热至100℃失去结晶水,温度高于157℃后草酸升华(固态变为气态),并逐渐分解生成。草酸能使酸性高锰酸钾溶液褪色,草酸的钠盐溶于水,钙盐难溶于水。下列说法不正确的是( )
A.草酸具有还原性
B.加热至100℃,分解产生的气体通过无水硫酸铜,可以检验生成的
C.把加热温度高于157℃后分解产生的气体依次通过足量的NaOH溶液、浓硫酸、灼热的CuO固体、澄清石灰水,可检验生成的CO
D.把加热温度高于157℃后分解产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有
13.已知和均有还原性,它们在酸性溶液中还原性强弱顺序为,则下列反应中不可能发生的是( )
A.
B.
C.
D.
14.硒(Se)在人体中具有抗氧化和结合重金属的作用,科学补硒可以减少疾病的发生。工业上从硒化亚铜中提取Se涉及的其中一步反应为。下列说法错误的是( )
A.该反应中浓硫酸表现的性质既有氧化性也有酸性
B.该反应表现出还原性强弱为
C.该反应每生成4个,转移电子总数为8
D.该反应的还原产物只有,氧化产物只有
15.在常温下,发生下列几种反应:
①
②
③
下列结论判断错误的是( )
A.溶液中可发生反应:
B.氧化性强弱顺序为
C.酸性条件下不能将氧化为
D.是的还原产物
二、填空题:本题共5题,共55分。
16.按要求书写化学方程式或离子方程式。
(1)以为原料制备的方法是:先向溶液中加入计量的,生成碘化物;再向混合溶液中加入溶液,反应得到。上述制备的总反应的离子方程式为________。
(2)①为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备的化学方程式为________。
②常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到溶液。上述过程中,生成的反应属于歧化反应,产生“气泡”的化学方程式为________。
17.某同学利用实验室中几种等浓度溶液:①NaOH溶液,②盐酸,③溶液,④溶液,⑤溶液,进行以下实验。
序号 操作 现象 离子方程式
ⅰ 向盛有2mL①的试管中加入1 mL ③ 产生蓝色沉淀 a
ⅱ 向盛有5mL②的试管中加入⑤1 mL b c
(1)将表格补充完整。
a.______;
b.______;
c.______。
(2)该同学认为从理论上即可推测④与⑤不反应,预测的依据是____。
(3)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的五种溶液设计简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入2mL②,____(从操作、现象、结论方面描述)。
18.回答下列问题:
(1)在下列物质中,可以导电的是______(填序号,下同),是电解质的有______。
①干燥的氯化钠晶体
②干燥的氢氧化钠固体
③蔗糖晶体
④酒精
⑤溶液
⑥氢氧化钠溶液
⑦稀盐酸
⑧溶液
(2)向盛有⑧的烧杯中逐滴加入⑤,当溶液中的恰好完全沉淀时,发生反应的离子方程式为_________。
(3)工业上利用电解①的饱和溶液可制备和NaOH,发生反应的化学方程式为________。
(4)某无色透明溶液中可能含有下列离子中的一种或几种:。现进行如下实验:
①取少量溶液用红色石蕊试纸检验,试纸变蓝。
②另取少量溶液逐滴滴加盐酸至过量,有气体放出,再加入溶液,没有沉淀生成。
③另取少量溶液用足量硝酸酸化后,加入溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定有________,肯定没有________。
19.取一定量的酸性硫酸锰()溶液,向其中依次加人下列物质,对应现象如表所示:
步骤1 步骤2 步骤3
试剂 适量 过量的溶液 适量KI-淀粉混合液
实验现象 溶液呈紫红色 紫红色消失,产生气泡 现象A
已知:①金属铋(Bi)价态为+3时较稳定;②铋酸钠()无色,难溶于水,高锰酸根离子()呈紫红色;③淀粉溶液遇到变成蓝色。
(1)步骤1的氧化产物为___(填序号:①、②)。
(2)步骤2中过量的可以氧化KI,则步骤3对应的现象A为___。
(3)由上述现象可得上述反应中物质的氧化性由强到弱的顺序为(填序号:①、②)。
(4)根据上述结论,推断下列离子反应可能发生且书写正确的是___(填字母)。
A.
B.
C.
20.高锰酸盐具有强氧化性,常用于杀菌消毒。回答下列问题:
(1)已知是一种不稳定的物质,具有强氧化性,可发生反应:。
①配平该反应的离子方程式:____。
②该反应的实验现象为____。
③上述反应中,发生还原反应的粒子是____(写化学式),每消耗3个,反应转移电子的个数为____。
(2)已知某容器中发生了一个化学反应,反应过程中存在六种粒子。在反应过程中测得和的粒子数目随时间变化的曲线如图所示。
①写出该反应的离子方程式:_____。
②该反应中,氧化剂与还原剂的粒子数目之比为_____。
③若消耗11.9g,则生成氧气的质量为_____。
答案以及解析
1.答案:A
解析:A项,清淤只是物质的空间移动,不涉及化学变化,符合题意;B项,“三废”中含有害物质,必须把有害物质转化为无害物质才能排放,涉及化学变化,不符合题意;C项,利用微生物把有毒有害物质降解为无毒无害物质,涉及化学变化,不符合题意;D项,无害化处理是通过物理、化学或生物的方法将有毒有害物质转化为无毒无害物质,涉及化学变化,不符合题意。
2.答案:B
解析:①硝酸在水溶液中电离出的阳离子全部是氢离子,所以硝酸属于酸;②氢化物是氢元素与其他元素形成的二元化合物,而硝酸的组成元素为3种;③氧化物是氧元素与其他元素形成的二元化合物,而硝酸的组成元素为3种;④硝酸属于酸,且其组成元素中有氧元素,所以属于含氧酸;⑤硝酸易挥发,属于挥发性酸;⑥硝酸具有强氧化性,属于强氧化性酸;⑦每个硝酸分子在水中能电离出一个氢离子,所以硝酸属于一元酸;⑧硝酸属于化合物;⑨硝酸属于纯净物。
3.答案:A
解析:A项,胆矾是硫酸铜晶体,其化学式为,错误;B项,湿法治铜中的一步反应是铁与溶液发生置换反应,故胆矾可作为湿法冶铜的原料,正确;C项,将溶液蒸发浓缩,再冷却结晶可得胆矾,正确;D项,铁与硫酸铜溶液发生置换反应,置换出来的铜附在铁釜上,正确。
4.答案:C
解析:当一束光通过胶体时,能产生丁达尔效应,故选C。
5.答案:D
解析:溶液中随着溶液滴入反应生成沉淀,灯光由亮变暗(或灭),当溶液过量时,灯光又变亮,A不符合题意;溶液中逐滴滴入溶液发生反应生成和,溶液中离子浓度减小,灯光逐渐变暗,当溶液过量时,灯光又变亮,B不符合题意;溶液中滴入溶液,生成沉淀和,灯光逐渐变暗(或灭),当溶液过量时,灯光又变亮,C不符合题意;与反应生成易溶易电离的,溶液导电性增强,灯光逐渐变亮,不会出现“亮→暗(或灭)→亮”的现象,D符合题意。
6.答案:A
解析:溶液中加入溶液生成白色沉淀,再加入溶液,和反应生成和,沉淀全部溶解,最后加入溶液,与反应生成白色沉淀,故A符合题意;溶液中加入溶液生成白色沉淀,再加入溶液,与反应生成和,沉淀全部溶解,最后加入KCl溶液,不能生成沉淀,故B不符合题意;溶液中加入KCl溶液不能生成沉淀,故C不符合题意;溶液中加入溶液生成白色沉淀,再加入硫酸,和反应生成白色沉淀、和,沉淀不能溶解,故D不符合题意。
7.答案:CD
解析:氯化钙与二氧化碳不发生反应,A项错误;电离出的优先和NaOH溶液反应,同浓度同体积的溶液与NaOH溶液混合,氢离子和氢氧根离子恰好完全反应,正确的离子方程式应为,B项错误;澄清的石灰水久置后,氢氧化钙与空气中的二氧化碳反应生成碳酸钙白色沉淀,反应的离子方程式为,C项正确;金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的化学方程式为,使溶液的蓝色消失,D项正确。
8.答案:C
解析:根据化合物中各元素正、负化合价的代数和为0知,中N元素的化合价不是-3价,A错误;中N元素化合价升高,作还原剂,中N元素化合价降低,作氧化剂,氧化剂和还原剂不是同一物质,B错误;根据化学方程式,10个被氧化,生成的分子数为15,2个被还原,生成的分子数为1,氧化产物与还原产物分子数之比为15:1,C正确;根据化学方程式,反应过程中转移10个电子,产生16个分子,D错误。
9.答案:A
解析:稀氨水中,之间不发生反应,能大量共存,A项正确;稀盐酸中的能与反应而不能大量共存,B项错误;具有强氧化性,能与发生氧化还原反应而不能大量共存,C项错误;稀溶液中的与反应均生成沉淀而不能大量共存,D项错误。
10.答案:A
解析:固体粉末加水溶解后过滤,滤渣能完全溶于稀硝酸,该滤渣可能是或,则原粉末中一定有;滤液加稀硫酸产生白色沉淀甲,该白色沉淀只能是,则原粉末中一定有,一定没有,且滤液中含,不含;滤液加溶液产生白色沉淀乙,该白色沉淀只能是AgCl,则原粉末中一定有KCl。故选A。
11.答案:D
解析:用石灰乳脱除烟气中的,是石灰乳中的与发生反应生成和,该反应不属于氧化还原反应,A项错误;明矾溶于水形成的胶体有吸附性,可吸附污水中的杂质,该过程中没有元素化合价的变化,没有利用氧化还原反应,B项错误;用盐酸除铁锈,发生的反应为,该反应中没有元素化合价的变化,不是氧化还原反应,C项错误;84消毒液杀菌的原理是利用NaClO的强氧化性使细菌的蛋白质变性,利用了氧化还原反应,D项正确。
12.答案:D
解析:酸性高锰酸钾溶液具有强氧化性,草酸能使酸性高锰酸钾溶液褪色,说明草酸具有还原性,故A正确;无水硫酸铜遇水变蓝,可以检验生成的,故B正确;草酸受热分解产生的气体()先通过足量的NaOH溶液除去气体,然后通过浓硫酸除去水,再通过灼热的CuO固体,最后将反应后的气体通入澄清石灰水,若观察到固体由黑色(CuO)变为红色(Cu),澄清石灰水变浑浊(产生沉淀),证明气体中含有CO,故C正确;草酸受热分解产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,可能是生成了草酸钙或碳酸钙,不能说明产生的气体中一定有,故D错误。
13.答案:A
解析:A项,反应中硫元素化合价降低,过氧化氢中氧元素化合价升高,则还原剂的还原性大于还原产物,不符合题给条件;B项,反应中还原剂的还原性大于还原产物HI,符合题给条件;C项,反应中还原剂的还原性大于还原产物,符合题给条件;D项,反应中还原剂的还原性大于还原产物,符合题给条件。故选A。
14.答案:D
解析:根据化学方程式,浓硫酸中硫元素化合价部分降低,部分未变化,故浓硫酸既表现氧化性又表现酸性,A正确;还原剂的还原性大于还原产物,为还原剂,为还原产物,故还原性:,B正确;该反应每生成4个,转移电子总数为8,C正确;为还原产物,和为氧化产物,D错误。
15.答案:C
解析:氧化性:,则溶液中可发生反应:,A正确;由审题指导可知,B正确;氧化性:,酸性条件下能将氧化为,C错误;反应①中,X元素的化合价降低,被还原,是还原产物,D正确。
16.答案:(1)
(2)①;②
解析:(1)结合题给信息:第一步为,第二步为,总反应为。
(2)①发生歧化反应生成和,则HgO和反应的化学方程式为;②由反应物可知产生的“气泡”为,即与反应的化学方程式为。
17.答案:(1);有气泡产生;
(2)不符合复分解反应发生的条件:生成气体、沉淀或难电离的物质
(3)振荡后,向溶液中加入1mL⑤,无气泡产生,说明①与②发生了反应(或振荡后,向溶液中加入1mL③,无蓝色沉淀产生,说明①与②发生了反应)
解析:(1)向盛有2mLNaOH溶液的试管中加入1mL溶液,发生反应的离子方程式为。向盛有5mL盐酸的试管中加入1mL溶液,发生反应的离子方程式为。
18.答案:(1)⑤⑥⑦⑧;①②
(2)
(3)
(4);
解析:(1)①②虽为电解质,但其固体中不含自由移动的离子,不能导电;而③④均为非电解质,不导电;⑤⑥⑦⑧均为混合物,均含自由移动的离子,能导电但不属于电解质。
(2)向溶液中逐滴加入溶液,当恰好沉淀完全时,即二者反应的化学计量数之比为1:1,其离子方程式为。
(3)根据题意和得失电子守恒可写出并配平该化学方程式:。
(4)由于溶液无色,则不能含;根据实验①可知溶液呈碱性,即含,则溶液中不含;由实验②可知生成的气体只能是,即溶液中含,由加入溶液无沉淀生成,可知溶液中无;根据实验③可知生成AgCl沉淀,则溶液中含;结合溶液呈电中性可知溶液中含。综上分析溶液中一定含,一定不含,无法确定是否含。
19.答案:(1)②
(2)溶液变蓝
(3)②;①
(4)B
解析:(1)根据题给步骤1实验现象“溶液呈紫红色”,说明发生了氧化反应,化合价升高,氧化产物为。
(2)过量的可以氧化KI生成,淀粉溶液遇变蓝。
(3)根据题给步骤1实验现象知,作氧化剂氧化,为氧化产物;根据题给步骤2实验现象知,作氧化剂氧化;根据(2)分析知,作氧化剂氧化,为氧化产物,综上所述可得氧化性由强到弱的顺序为。
(4)A项,中O元素的化合价降低,作氧化剂,为氧化产物,不符合(3)中得出的氧化性强弱规律;B项,中Bi元素的化合价降低,作氧化剂,为氧化产物,符合(3)中得出的氧化性强弱规律;C项,中I元素的化合价降低,作氧化剂,为氧化产物,不符合(3)中得出的氧化性强弱规律。
20.答案:(1)①;②有气泡产生,溶液变成紫红色;③;15
(2)①;②2:5;③8g
解析:(1)①由得失电子守恒、原子守恒和电荷守恒可得反应的离子方程式为。③由反应的离子方程式可知,每消耗3个,反应转移电子的个数为15。
(2)①由题图知,反应过程中逐渐减少,为反应物;逐渐增多,为生成物。则反应的离子方程式为。②氧化剂为,还原剂为,故氧化剂与还原剂的粒子数目之比为2:5。③设生成的质量为x,由两种粒子的对应关系得
解得x=8g。
2
(满分100分 考试时间:90分)
一、选择题:本题共15小题,每题3分,共45分。
1.下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是( )
A.定期清淤,疏通河道
B.化工企业“三废”处理后,达标排放
C.利用微生物降解水域中的有毒有害物质
D.河道中的垃圾回收分类后,进行无害化处理
2.按照物质的树状分类法和交叉分类法,应属于( )
①酸
②氢化物
③氧化物
④含氧酸
⑤难挥发性酸
⑥强氧化性酸
⑦一元酸
⑧化合物
⑨混合物
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①⑨ D.①④⑤⑥⑦
3.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A.胆矾的化学式为
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
4.当一束光通过下列分散系时,能产生丁达尔效应的是( )
A.稀盐酸 B.蔗糖水
C.胶体 D.溶液
5.使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是( )
选项 A B C D
试剂a
试剂b
A.A B.B C.C D.D
6.有三种溶液分别标记为①、②、③,在溶液中加入①时有白色沉淀产生,再加入②时白色沉淀全部溶解同时产生气泡,最后加入③时又产生白色沉淀。设每次加入的反应物都能完全反应,则上述①、②、③所代表的溶液可能是( )
选项 ① ② ③
A 溶液 溶液 溶液
B 溶液 溶液 溶液
C 溶液 溶液 溶液
D 溶液 溶液 溶液
A.A B.B C.C D.D
7.下列指定反应的离子方程式或化学方程式正确的是( )
A.向溶液中通入
B.同浓度同体积溶液与NaOH溶液混合:
C.澄清的石灰水久置后出现白色固体:
D.向溶液中加入足量Zn粉,溶液蓝色消失:
8.汽车剧烈碰撞时,安全气囊中发生反应。对于该反应,下列判断正确的是( )
A.中氮元素的化合价为-3价
B.氧化剂和还原剂是同一物质
C.氧化产物与还原产物分子数之比为15:1
D.反应过程中转移10个电子,则产生10个分子
9.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.稀氨水:
B.稀盐酸:
C.稀溶液:
D.稀溶液:
10.有一包白色固体粉末,其中可能含有中的一种或几种,现做以下实验(所加试剂均足量):
则下列说法正确的是( )
A.原粉末中一定有
B.KCl是否存在无法确定
C.白色沉淀乙可能是AgCl和的混合物
D.原粉末中一定没有,可能有KCl
11.下列物质的应用中,利用了氧化还原反应的是( )
A.用石灰乳脱除烟气中的
B.用明矾溶于水形成胶体处理污水
C.用盐酸去除铁锈(主要成分)
D.用84消毒液(有效成分NaClO)杀灭细菌
12.草酸()是一种弱酸,加热至100℃失去结晶水,温度高于157℃后草酸升华(固态变为气态),并逐渐分解生成。草酸能使酸性高锰酸钾溶液褪色,草酸的钠盐溶于水,钙盐难溶于水。下列说法不正确的是( )
A.草酸具有还原性
B.加热至100℃,分解产生的气体通过无水硫酸铜,可以检验生成的
C.把加热温度高于157℃后分解产生的气体依次通过足量的NaOH溶液、浓硫酸、灼热的CuO固体、澄清石灰水,可检验生成的CO
D.把加热温度高于157℃后分解产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有
13.已知和均有还原性,它们在酸性溶液中还原性强弱顺序为,则下列反应中不可能发生的是( )
A.
B.
C.
D.
14.硒(Se)在人体中具有抗氧化和结合重金属的作用,科学补硒可以减少疾病的发生。工业上从硒化亚铜中提取Se涉及的其中一步反应为。下列说法错误的是( )
A.该反应中浓硫酸表现的性质既有氧化性也有酸性
B.该反应表现出还原性强弱为
C.该反应每生成4个,转移电子总数为8
D.该反应的还原产物只有,氧化产物只有
15.在常温下,发生下列几种反应:
①
②
③
下列结论判断错误的是( )
A.溶液中可发生反应:
B.氧化性强弱顺序为
C.酸性条件下不能将氧化为
D.是的还原产物
二、填空题:本题共5题,共55分。
16.按要求书写化学方程式或离子方程式。
(1)以为原料制备的方法是:先向溶液中加入计量的,生成碘化物;再向混合溶液中加入溶液,反应得到。上述制备的总反应的离子方程式为________。
(2)①为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备的化学方程式为________。
②常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到溶液。上述过程中,生成的反应属于歧化反应,产生“气泡”的化学方程式为________。
17.某同学利用实验室中几种等浓度溶液:①NaOH溶液,②盐酸,③溶液,④溶液,⑤溶液,进行以下实验。
序号 操作 现象 离子方程式
ⅰ 向盛有2mL①的试管中加入1 mL ③ 产生蓝色沉淀 a
ⅱ 向盛有5mL②的试管中加入⑤1 mL b c
(1)将表格补充完整。
a.______;
b.______;
c.______。
(2)该同学认为从理论上即可推测④与⑤不反应,预测的依据是____。
(3)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的五种溶液设计简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入2mL②,____(从操作、现象、结论方面描述)。
18.回答下列问题:
(1)在下列物质中,可以导电的是______(填序号,下同),是电解质的有______。
①干燥的氯化钠晶体
②干燥的氢氧化钠固体
③蔗糖晶体
④酒精
⑤溶液
⑥氢氧化钠溶液
⑦稀盐酸
⑧溶液
(2)向盛有⑧的烧杯中逐滴加入⑤,当溶液中的恰好完全沉淀时,发生反应的离子方程式为_________。
(3)工业上利用电解①的饱和溶液可制备和NaOH,发生反应的化学方程式为________。
(4)某无色透明溶液中可能含有下列离子中的一种或几种:。现进行如下实验:
①取少量溶液用红色石蕊试纸检验,试纸变蓝。
②另取少量溶液逐滴滴加盐酸至过量,有气体放出,再加入溶液,没有沉淀生成。
③另取少量溶液用足量硝酸酸化后,加入溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定有________,肯定没有________。
19.取一定量的酸性硫酸锰()溶液,向其中依次加人下列物质,对应现象如表所示:
步骤1 步骤2 步骤3
试剂 适量 过量的溶液 适量KI-淀粉混合液
实验现象 溶液呈紫红色 紫红色消失,产生气泡 现象A
已知:①金属铋(Bi)价态为+3时较稳定;②铋酸钠()无色,难溶于水,高锰酸根离子()呈紫红色;③淀粉溶液遇到变成蓝色。
(1)步骤1的氧化产物为___(填序号:①、②)。
(2)步骤2中过量的可以氧化KI,则步骤3对应的现象A为___。
(3)由上述现象可得上述反应中物质的氧化性由强到弱的顺序为(填序号:①、②)。
(4)根据上述结论,推断下列离子反应可能发生且书写正确的是___(填字母)。
A.
B.
C.
20.高锰酸盐具有强氧化性,常用于杀菌消毒。回答下列问题:
(1)已知是一种不稳定的物质,具有强氧化性,可发生反应:。
①配平该反应的离子方程式:____。
②该反应的实验现象为____。
③上述反应中,发生还原反应的粒子是____(写化学式),每消耗3个,反应转移电子的个数为____。
(2)已知某容器中发生了一个化学反应,反应过程中存在六种粒子。在反应过程中测得和的粒子数目随时间变化的曲线如图所示。
①写出该反应的离子方程式:_____。
②该反应中,氧化剂与还原剂的粒子数目之比为_____。
③若消耗11.9g,则生成氧气的质量为_____。
答案以及解析
1.答案:A
解析:A项,清淤只是物质的空间移动,不涉及化学变化,符合题意;B项,“三废”中含有害物质,必须把有害物质转化为无害物质才能排放,涉及化学变化,不符合题意;C项,利用微生物把有毒有害物质降解为无毒无害物质,涉及化学变化,不符合题意;D项,无害化处理是通过物理、化学或生物的方法将有毒有害物质转化为无毒无害物质,涉及化学变化,不符合题意。
2.答案:B
解析:①硝酸在水溶液中电离出的阳离子全部是氢离子,所以硝酸属于酸;②氢化物是氢元素与其他元素形成的二元化合物,而硝酸的组成元素为3种;③氧化物是氧元素与其他元素形成的二元化合物,而硝酸的组成元素为3种;④硝酸属于酸,且其组成元素中有氧元素,所以属于含氧酸;⑤硝酸易挥发,属于挥发性酸;⑥硝酸具有强氧化性,属于强氧化性酸;⑦每个硝酸分子在水中能电离出一个氢离子,所以硝酸属于一元酸;⑧硝酸属于化合物;⑨硝酸属于纯净物。
3.答案:A
解析:A项,胆矾是硫酸铜晶体,其化学式为,错误;B项,湿法治铜中的一步反应是铁与溶液发生置换反应,故胆矾可作为湿法冶铜的原料,正确;C项,将溶液蒸发浓缩,再冷却结晶可得胆矾,正确;D项,铁与硫酸铜溶液发生置换反应,置换出来的铜附在铁釜上,正确。
4.答案:C
解析:当一束光通过胶体时,能产生丁达尔效应,故选C。
5.答案:D
解析:溶液中随着溶液滴入反应生成沉淀,灯光由亮变暗(或灭),当溶液过量时,灯光又变亮,A不符合题意;溶液中逐滴滴入溶液发生反应生成和,溶液中离子浓度减小,灯光逐渐变暗,当溶液过量时,灯光又变亮,B不符合题意;溶液中滴入溶液,生成沉淀和,灯光逐渐变暗(或灭),当溶液过量时,灯光又变亮,C不符合题意;与反应生成易溶易电离的,溶液导电性增强,灯光逐渐变亮,不会出现“亮→暗(或灭)→亮”的现象,D符合题意。
6.答案:A
解析:溶液中加入溶液生成白色沉淀,再加入溶液,和反应生成和,沉淀全部溶解,最后加入溶液,与反应生成白色沉淀,故A符合题意;溶液中加入溶液生成白色沉淀,再加入溶液,与反应生成和,沉淀全部溶解,最后加入KCl溶液,不能生成沉淀,故B不符合题意;溶液中加入KCl溶液不能生成沉淀,故C不符合题意;溶液中加入溶液生成白色沉淀,再加入硫酸,和反应生成白色沉淀、和,沉淀不能溶解,故D不符合题意。
7.答案:CD
解析:氯化钙与二氧化碳不发生反应,A项错误;电离出的优先和NaOH溶液反应,同浓度同体积的溶液与NaOH溶液混合,氢离子和氢氧根离子恰好完全反应,正确的离子方程式应为,B项错误;澄清的石灰水久置后,氢氧化钙与空气中的二氧化碳反应生成碳酸钙白色沉淀,反应的离子方程式为,C项正确;金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的化学方程式为,使溶液的蓝色消失,D项正确。
8.答案:C
解析:根据化合物中各元素正、负化合价的代数和为0知,中N元素的化合价不是-3价,A错误;中N元素化合价升高,作还原剂,中N元素化合价降低,作氧化剂,氧化剂和还原剂不是同一物质,B错误;根据化学方程式,10个被氧化,生成的分子数为15,2个被还原,生成的分子数为1,氧化产物与还原产物分子数之比为15:1,C正确;根据化学方程式,反应过程中转移10个电子,产生16个分子,D错误。
9.答案:A
解析:稀氨水中,之间不发生反应,能大量共存,A项正确;稀盐酸中的能与反应而不能大量共存,B项错误;具有强氧化性,能与发生氧化还原反应而不能大量共存,C项错误;稀溶液中的与反应均生成沉淀而不能大量共存,D项错误。
10.答案:A
解析:固体粉末加水溶解后过滤,滤渣能完全溶于稀硝酸,该滤渣可能是或,则原粉末中一定有;滤液加稀硫酸产生白色沉淀甲,该白色沉淀只能是,则原粉末中一定有,一定没有,且滤液中含,不含;滤液加溶液产生白色沉淀乙,该白色沉淀只能是AgCl,则原粉末中一定有KCl。故选A。
11.答案:D
解析:用石灰乳脱除烟气中的,是石灰乳中的与发生反应生成和,该反应不属于氧化还原反应,A项错误;明矾溶于水形成的胶体有吸附性,可吸附污水中的杂质,该过程中没有元素化合价的变化,没有利用氧化还原反应,B项错误;用盐酸除铁锈,发生的反应为,该反应中没有元素化合价的变化,不是氧化还原反应,C项错误;84消毒液杀菌的原理是利用NaClO的强氧化性使细菌的蛋白质变性,利用了氧化还原反应,D项正确。
12.答案:D
解析:酸性高锰酸钾溶液具有强氧化性,草酸能使酸性高锰酸钾溶液褪色,说明草酸具有还原性,故A正确;无水硫酸铜遇水变蓝,可以检验生成的,故B正确;草酸受热分解产生的气体()先通过足量的NaOH溶液除去气体,然后通过浓硫酸除去水,再通过灼热的CuO固体,最后将反应后的气体通入澄清石灰水,若观察到固体由黑色(CuO)变为红色(Cu),澄清石灰水变浑浊(产生沉淀),证明气体中含有CO,故C正确;草酸受热分解产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,可能是生成了草酸钙或碳酸钙,不能说明产生的气体中一定有,故D错误。
13.答案:A
解析:A项,反应中硫元素化合价降低,过氧化氢中氧元素化合价升高,则还原剂的还原性大于还原产物,不符合题给条件;B项,反应中还原剂的还原性大于还原产物HI,符合题给条件;C项,反应中还原剂的还原性大于还原产物,符合题给条件;D项,反应中还原剂的还原性大于还原产物,符合题给条件。故选A。
14.答案:D
解析:根据化学方程式,浓硫酸中硫元素化合价部分降低,部分未变化,故浓硫酸既表现氧化性又表现酸性,A正确;还原剂的还原性大于还原产物,为还原剂,为还原产物,故还原性:,B正确;该反应每生成4个,转移电子总数为8,C正确;为还原产物,和为氧化产物,D错误。
15.答案:C
解析:氧化性:,则溶液中可发生反应:,A正确;由审题指导可知,B正确;氧化性:,酸性条件下能将氧化为,C错误;反应①中,X元素的化合价降低,被还原,是还原产物,D正确。
16.答案:(1)
(2)①;②
解析:(1)结合题给信息:第一步为,第二步为,总反应为。
(2)①发生歧化反应生成和,则HgO和反应的化学方程式为;②由反应物可知产生的“气泡”为,即与反应的化学方程式为。
17.答案:(1);有气泡产生;
(2)不符合复分解反应发生的条件:生成气体、沉淀或难电离的物质
(3)振荡后,向溶液中加入1mL⑤,无气泡产生,说明①与②发生了反应(或振荡后,向溶液中加入1mL③,无蓝色沉淀产生,说明①与②发生了反应)
解析:(1)向盛有2mLNaOH溶液的试管中加入1mL溶液,发生反应的离子方程式为。向盛有5mL盐酸的试管中加入1mL溶液,发生反应的离子方程式为。
18.答案:(1)⑤⑥⑦⑧;①②
(2)
(3)
(4);
解析:(1)①②虽为电解质,但其固体中不含自由移动的离子,不能导电;而③④均为非电解质,不导电;⑤⑥⑦⑧均为混合物,均含自由移动的离子,能导电但不属于电解质。
(2)向溶液中逐滴加入溶液,当恰好沉淀完全时,即二者反应的化学计量数之比为1:1,其离子方程式为。
(3)根据题意和得失电子守恒可写出并配平该化学方程式:。
(4)由于溶液无色,则不能含;根据实验①可知溶液呈碱性,即含,则溶液中不含;由实验②可知生成的气体只能是,即溶液中含,由加入溶液无沉淀生成,可知溶液中无;根据实验③可知生成AgCl沉淀,则溶液中含;结合溶液呈电中性可知溶液中含。综上分析溶液中一定含,一定不含,无法确定是否含。
19.答案:(1)②
(2)溶液变蓝
(3)②;①
(4)B
解析:(1)根据题给步骤1实验现象“溶液呈紫红色”,说明发生了氧化反应,化合价升高,氧化产物为。
(2)过量的可以氧化KI生成,淀粉溶液遇变蓝。
(3)根据题给步骤1实验现象知,作氧化剂氧化,为氧化产物;根据题给步骤2实验现象知,作氧化剂氧化;根据(2)分析知,作氧化剂氧化,为氧化产物,综上所述可得氧化性由强到弱的顺序为。
(4)A项,中O元素的化合价降低,作氧化剂,为氧化产物,不符合(3)中得出的氧化性强弱规律;B项,中Bi元素的化合价降低,作氧化剂,为氧化产物,符合(3)中得出的氧化性强弱规律;C项,中I元素的化合价降低,作氧化剂,为氧化产物,不符合(3)中得出的氧化性强弱规律。
20.答案:(1)①;②有气泡产生,溶液变成紫红色;③;15
(2)①;②2:5;③8g
解析:(1)①由得失电子守恒、原子守恒和电荷守恒可得反应的离子方程式为。③由反应的离子方程式可知,每消耗3个,反应转移电子的个数为15。
(2)①由题图知,反应过程中逐渐减少,为反应物;逐渐增多,为生成物。则反应的离子方程式为。②氧化剂为,还原剂为,故氧化剂与还原剂的粒子数目之比为2:5。③设生成的质量为x,由两种粒子的对应关系得
解得x=8g。
2
