1.3.4氧化还原反应的配平 课件(共20张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.4氧化还原反应的配平 课件(共20张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 18:27:09 | ||
图片预览







文档简介
(共20张PPT)
第三节
氧化还原反应
第4课时
氧化还原反应的配平
第一章
学习目标
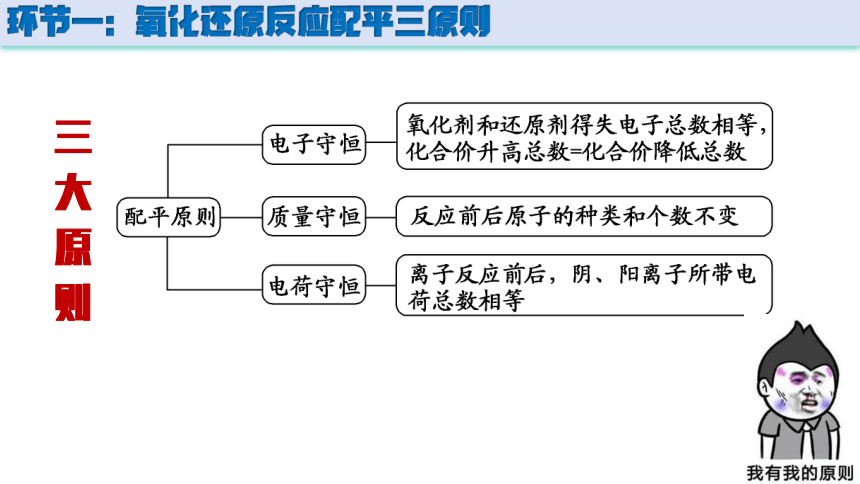
配平原则:电子守恒 质量守恒 电荷守恒
配平步骤:化合价升降法(一标、二等、三定、四平、五查)
配平技巧:一般配平法 自身配平法 缺项配平法
环节一:氧化还原反应配平三原则
三 大 原 则
环节一:氧化还原反应配平五步骤
一标:化合价
二等: 化合价升降总数相等
三定: 确定氧化剂-还原产物,还原剂-氧化产物的计量数
四平: 观察法配平其他物质
五查: 查原子、电荷、电子是否守恒
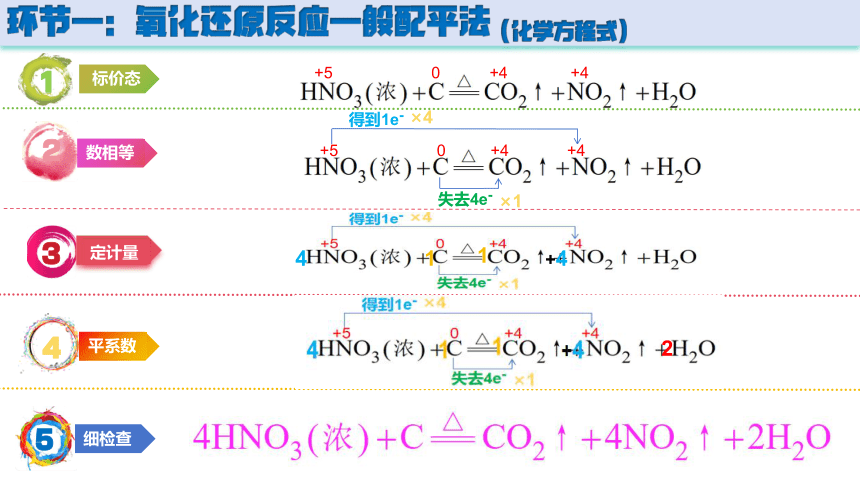
环节一:氧化还原反应一般配平法(化学方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
+5 0 +4 +4
+5 0 +4 +4
得到1e-
失去4e-
×4
×1
4
+4
1
1
2
环节一:氧化还原反应一般配平法(化学方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【练习】
1.
2.
3.
环节一:氧化还原反应一般配平法(化学方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【答案】
1.
2.
3.
环节一:氧化还原反应一般配平法(离子方程式)
Fe2++ Cr2O72-+ H+ ======= Fe3++ Cr3++ H2O
+2 +6 +3 +3
Fe2++ Cr2O72-+ H+ ======= Fe3++ Cr3++ H2O
+2 +6 +3 +3
得到1e-
×6
失去2×3e-
×1
Fe2++ Cr2O72-+ H+ ======= Fe3++ Cr3++ H2O
+2 +6 +3 +3
得到1e-
×6
失去2×3e-
×1
6
6
1
2
7
24
12-2+?=24
6Fe2++ Cr2O72-+ 14H+ ======= 6Fe3++ 2 Cr3++ 7 H2O
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
环节一:氧化还原反应一般配平法(离子方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【练习】
MnO4-+ Cl-+ H+===== Mn2++ Cl2 + H2O
环节一:氧化还原反应一般配平法(离子方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【答案】
2MnO4-+10Cl-+16H+===== 2Mn2++5Cl2 +8H2O
环节二:氧化还原反应自身配平法
逆向配平
Cl2+ OH- ==== Cl-+ ClO3- + H2O
0 -1 +5
1
5
×1
×5
3
5
1
5+1=6
6
6
3
3Cl2+6OH- ====5Cl-+ClO3- +3H2O
歧化反应(中间价态两边跑)
环节二:氧化还原反应自身配平法
【练习】
1.
2.
3.
4.
环节二:氧化还原反应自身配平法
【答案】
1.
2.
3.
4.
环节二:氧化还原反应自身配平法
归中反应(高低价态中间跑)
正向配平
-1 +5 0
1
5
×5
×1
5
1
3
3
3
3
环节三:氧化还原反应正向配平法
【练习】
1.
2.
3.
4.
环节二:氧化还原反应自身配平法
【答案】
1.
2.
3.
4.
环节三:氧化还原反应配平法——缺项配平
【缺项配平】:先用“化合价升降法”配平变价元素,再由质量守恒确定未知数。
条件 补项原则
酸性 缺H或多O补H+,少O补H2O
碱性 缺H或多O补H2O,少O补OH-
【原则】:
环节三:氧化还原反应配平法——缺项配平
【练习】
环节三:氧化还原反应配平法——缺项配平
【答案】
少O补H2O
第三节
氧化还原反应
第4课时
氧化还原反应的配平
第一章
学习目标
配平原则:电子守恒 质量守恒 电荷守恒
配平步骤:化合价升降法(一标、二等、三定、四平、五查)
配平技巧:一般配平法 自身配平法 缺项配平法
环节一:氧化还原反应配平三原则
三 大 原 则
环节一:氧化还原反应配平五步骤
一标:化合价
二等: 化合价升降总数相等
三定: 确定氧化剂-还原产物,还原剂-氧化产物的计量数
四平: 观察法配平其他物质
五查: 查原子、电荷、电子是否守恒
环节一:氧化还原反应一般配平法(化学方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
+5 0 +4 +4
+5 0 +4 +4
得到1e-
失去4e-
×4
×1
4
+4
1
1
2
环节一:氧化还原反应一般配平法(化学方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【练习】
1.
2.
3.
环节一:氧化还原反应一般配平法(化学方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【答案】
1.
2.
3.
环节一:氧化还原反应一般配平法(离子方程式)
Fe2++ Cr2O72-+ H+ ======= Fe3++ Cr3++ H2O
+2 +6 +3 +3
Fe2++ Cr2O72-+ H+ ======= Fe3++ Cr3++ H2O
+2 +6 +3 +3
得到1e-
×6
失去2×3e-
×1
Fe2++ Cr2O72-+ H+ ======= Fe3++ Cr3++ H2O
+2 +6 +3 +3
得到1e-
×6
失去2×3e-
×1
6
6
1
2
7
24
12-2+?=24
6Fe2++ Cr2O72-+ 14H+ ======= 6Fe3++ 2 Cr3++ 7 H2O
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
环节一:氧化还原反应一般配平法(离子方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【练习】
MnO4-+ Cl-+ H+===== Mn2++ Cl2 + H2O
环节一:氧化还原反应一般配平法(离子方程式)
1
2
3
4
5
标价态
数相等
定计量
平系数
细检查
【答案】
2MnO4-+10Cl-+16H+===== 2Mn2++5Cl2 +8H2O
环节二:氧化还原反应自身配平法
逆向配平
Cl2+ OH- ==== Cl-+ ClO3- + H2O
0 -1 +5
1
5
×1
×5
3
5
1
5+1=6
6
6
3
3Cl2+6OH- ====5Cl-+ClO3- +3H2O
歧化反应(中间价态两边跑)
环节二:氧化还原反应自身配平法
【练习】
1.
2.
3.
4.
环节二:氧化还原反应自身配平法
【答案】
1.
2.
3.
4.
环节二:氧化还原反应自身配平法
归中反应(高低价态中间跑)
正向配平
-1 +5 0
1
5
×5
×1
5
1
3
3
3
3
环节三:氧化还原反应正向配平法
【练习】
1.
2.
3.
4.
环节二:氧化还原反应自身配平法
【答案】
1.
2.
3.
4.
环节三:氧化还原反应配平法——缺项配平
【缺项配平】:先用“化合价升降法”配平变价元素,再由质量守恒确定未知数。
条件 补项原则
酸性 缺H或多O补H+,少O补H2O
碱性 缺H或多O补H2O,少O补OH-
【原则】:
环节三:氧化还原反应配平法——缺项配平
【练习】
环节三:氧化还原反应配平法——缺项配平
【答案】
少O补H2O
