化学人教版(2019)必修第一册1.1.4.物质的转化 课件(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.4.物质的转化 课件(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 93.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 21:37:08 | ||
图片预览







文档简介
(共25张PPT)
第4课时 物质的转化
新人教版高中化学必修第一册
第一章 物质及其变化
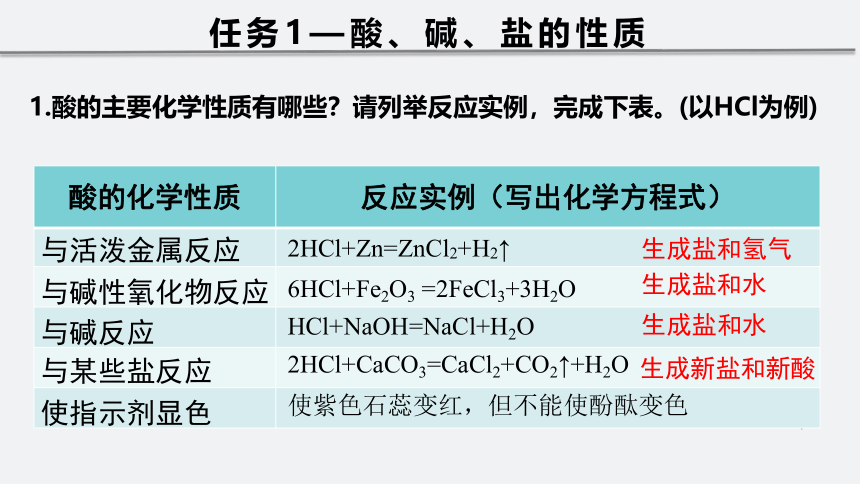
知识回顾—酸、碱、盐的概念酸碱盐初三化学阶段学习了酸、碱、盐,还记得他们是如何定义的吗?酸:提供的阳离子全部是氢离子的化合物。盐:提供的阳离子为金属离子或铵根离子,阴离子为酸根离子的化合物。碱:提供的阴离子全部是氢氧根离子的化合物。知识回顾—四大基本反应类型化合反应:由两种或两种以上的物质反应生成一种新物质的反应。符号表示:A+B=AB置换反应:指一种单质与一种化合物反应生成另外一种单质和另外一种化合物的反应。符号表示:AB+C=A+BC知识回顾—四大基本反应类型分解反应:由一种物质反应生成两种或两种以上新物质的反应叫做分解反应。符号表示:AB=A+B复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的实质:发生复分解反应的两种物质在水溶液中交换离子,生成沉淀、气体或水。符号表示:AB+CD=AD+CB酸的化学性质反应实例(写出化学方程式)与活泼金属反应与碱性氧化物反应与碱反应与某些盐反应使指示剂显色2HCl+Zn=ZnCl2+H2↑6HCl+Fe2O3=2FeCl3+3H2OHCl+NaOH=NaCl+H2O2HCl+CaCO3=CaCl2+CO2↑+H2O生成盐和氢气生成盐和水生成盐和水生成新盐和新酸任务1—酸、碱、盐的性质1.酸的主要化学性质有哪些?请列举反应实例,完成下表。(以HCl为例)使紫色石蕊变红,但不能使酚酞变色2.碱的主要化学性质有哪些?请列举反应实例,完成下表。(以火碱为例)
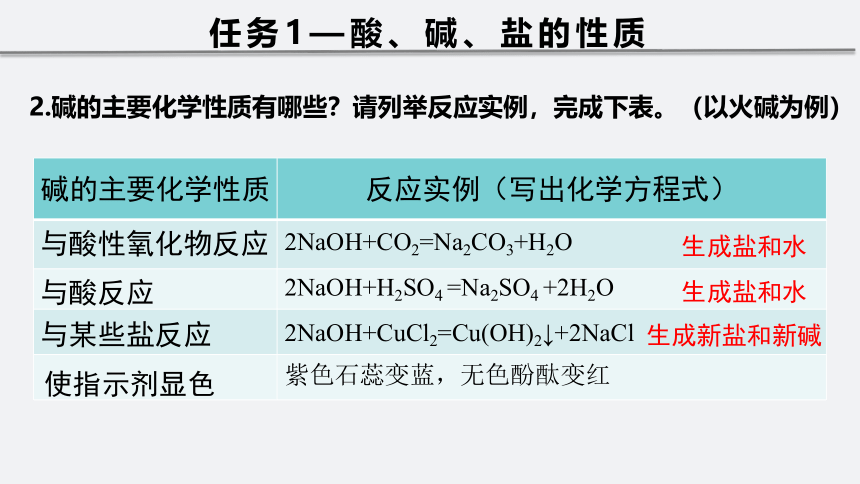
碱的主要化学性质 反应实例(写出化学方程式)
2NaOH+H2SO4 =Na2SO4 +2H2O
2NaOH+CO2=Na2CO3+H2O
2NaOH+CuCl2=Cu(OH)2↓+2NaCl
与酸性氧化物反应
与酸反应
与某些盐反应
使指示剂显色
生成盐和水
生成盐和水
生成新盐和新碱
任务1—酸、碱、盐的性质
紫色石蕊变蓝,无色酚酞变红
盐的主要化学性质反应实例(写出化学方程式)CuSO4+Fe=Cu+FeSO4FeCl3+3NaOH=3NaCl+Fe(OH)3↓CaCO3+2HCl=CaCl2+CO2↑+H2OBaCl2+CuSO4=CuCl2+BaSO4↓与较活泼金属反应与碱反应与酸反应与某些盐反应生成新金属和新盐生成新盐和新碱生成新盐和新酸生成新盐3.盐的主要化学性质有哪些?请列举反应实例,完成下表。任务1—酸、碱、盐的性质思考1:为什么不同的酸(或碱)具有相似的化学性质?任务1—酸、碱、盐的性质阴离子阳离子OH-NO3-Cl-SO42-CO32-H+溶、挥溶、挥溶溶NH4+溶、挥溶溶溶溶K+溶溶溶溶溶Na+溶溶溶溶溶Ba2+溶溶溶不不Ca2+微溶溶微不Mg2+不溶溶溶微Al3+不溶溶溶—Mn2+不溶溶溶不Zn2+不溶溶溶不Fe2+不溶溶溶不Fe3+不溶溶溶—Cu2+不溶溶溶不Ag+—溶不微不酸碱任务1—酸、碱、盐的性质思考1:为什么不同的酸(或碱)具有相似的化学性质?因为它们在组成上有相似性:不同的酸溶液中都含有H+不同的碱溶液中都含有OH-由此可以推测,如果盐在组成上有相似性,那么盐在性质上也会有相似性。任务1—酸、碱、盐的性质阴离子阳离子OH-NO3-Cl-SO42-CO32-H+溶、挥溶、挥溶溶NH4+溶、挥溶溶溶溶K+溶溶溶溶溶Na+溶溶溶溶溶Ba2+溶溶溶不不Ca2+微溶溶微不Mg2+不溶溶溶微Al3+不溶溶溶—Mn2+不溶溶溶不Zn2+不溶溶溶不Fe2+不溶溶溶不Fe3+不溶溶溶—Cu2+不溶溶溶不Ag+—溶不微不盐铵 盐钠 盐钙 盐铝 盐硝 酸 盐氯化物(盐酸盐)硫 酸 盐碳 酸 盐任务1—酸、碱、盐的性质由此可见,根据物质的组成对物质进行分类,可以更好地帮助我们学习一类物质的化学性质;而同类物质具有相似的化学性质正是由于它们的组成相似所导致。思考2:在以上酸、碱、盐的主要化学性质中,涉及哪些反应类型?置换反应Zn+H2SO4=ZnSO4+H2↑Fe+CuSO4=Cu+FeSO4HCl+NaOH=NaCl+H2OCaCO3+2HCl=CaCl2+CO2↑+H2O2NaOH+CuCl2=Cu(OH)2↓+2NaClBaCl2+CuSO4=CuCl2+BaSO4↓复分解反应任务2—物质的转化观察下列物质之间的转化,归纳由金属单质到盐、非金属单质到盐的转化关系:CaCaO Ca(OH)2CaSO4金属单质 碱性氧化物 碱 盐CCO2H2CO3CaCO3氧气水酸或酸性氧化物非金属单质 酸性氧化物 酸 盐氧气水碱或碱性氧化物拓展:以Na元素与S元素尝试构建物质的转化关系。任务2—物质的转化Na金属单质碱性氧化物碱盐O2H2O酸或 酸性氧化物Na2ONaOHNa2CO3S非金属单质酸性氧化物酸盐O2H2O碱或 碱性氧化物SO2H2SO4MgSO4转化规律SO32Na +SNa2S△Na2O + H2O = 2NaOH4Na +O2= 2Na2O2NaOH+CO2= Na2CO3+H2OS +O2SO2点燃SO3+ H2O = H2SO4Mg(OH)2+H2SO4= MgSO4+2H2ONa2O + SO2= Na2SO3Na2O + SO3= Na2SO42NaOH+SO2= Na2SO3+H2O2NaOH+SO3= Na2SO4+H2O2NaOH+H2SO4= Na2SO4+2H2O2NaOH+MgSO4= Na2SO4+ Mg(OH)2↓Na2CO3+H2SO4= Na2SO4+CO2↑+H2ONa2CO3+MgSO4= Na2SO4+MgCO3↓Na2O +H2SO4= Na2SO4+ H2O任务2—物质的转化金属碱性氧化物碱盐非金属酸性氧化物酸盐盐盐+水另两种盐盐+氢气金属+盐盐+碱盐+酸任务2—物质的转化思考3:要制取氢氧化钠可以采用哪些方法?1.碱性氧化物与水反应Na2O + H2O═2NaOH2.盐与另一种碱反应Na2CO3+ Ca(OH)2═CaCO3↓+2NaOH3.工业上制取氢氧化钠:电解饱和食盐水任务3—物质转化的应用思考4:现有原料CuCO3,能否通过转化关系图找到制取Cu单质的可能方法?CuCO3难溶盐可溶盐酸金属金属CuSO4CuH2SO4FeCuCO3+H2SO4═CuSO4+CO2↑+H2OCuSO4+Fe═Cu+FeSO4任务3—物质转化的应用同一类型物质往往具有相同的组成,根据物质的组成对物质进行分类有助于我们掌握物质的化学性质,进而通过化学变化可以实现物质之间的转化。任务3—物质转化的应用6.写出下列物质之间转化的化学方程式。(1) Cu → CuO → CuSO4→ Cu(OH)2→ CuSO4→ Cu2Cu +O22CuO△CuO +H2SO4CuSO4+H2OCuSO4+2NaOH Cu(OH)2↓+Na2SO4Cu(OH)2+H2SO4CuSO4+2H2OFe+CuSO4Cu+FeSO4练习与应用练习与应用6.写出下列物质之间转化的化学方程式。(2) C → CO2→CaCO3→ CaO → Ca(OH)2→ CaCl2C +O2CO2点燃△CaCO3CaO+ CO2↑Ca(OH)2+CO2CaCO3↓+H2OCaO + H2O Ca(OH)2Ca(OH)2+ 2HCl CaCl2+2H2O7.采用不同方法制取下列物质,并写出反应的化学方程式。(1)以Fe、CuO、H2SO4三种物质为原料,用两种方法制取Cu。方法二:CuO +H2SO4CuSO4+H2OFe+CuSO4Cu+FeSO4(1)方法一:Fe+H2SO4FeSO4+H2↑CuO +H2Cu+H2O△练习与应用7.采用不同方法制取下列物质,并写出反应的化学方程式。(2)用3种方法制取MgCl2。(2)方法一:Mg +Cl2MgCl2点燃方法二:MgO +2HCl MgCl2+H2OMg(OH)2+2HCl MgCl2+2H2O方法三:MgSO4+BaCl2MgCl2+BaSO4↓MgCO3+2HCl MgCl2+CO2↑+H2O方法四:Mg +2HCl MgCl2+H2↑练习与应用课后请仔细复习这一阶段的内容
第4课时 物质的转化
新人教版高中化学必修第一册
第一章 物质及其变化
知识回顾—酸、碱、盐的概念酸碱盐初三化学阶段学习了酸、碱、盐,还记得他们是如何定义的吗?酸:提供的阳离子全部是氢离子的化合物。盐:提供的阳离子为金属离子或铵根离子,阴离子为酸根离子的化合物。碱:提供的阴离子全部是氢氧根离子的化合物。知识回顾—四大基本反应类型化合反应:由两种或两种以上的物质反应生成一种新物质的反应。符号表示:A+B=AB置换反应:指一种单质与一种化合物反应生成另外一种单质和另外一种化合物的反应。符号表示:AB+C=A+BC知识回顾—四大基本反应类型分解反应:由一种物质反应生成两种或两种以上新物质的反应叫做分解反应。符号表示:AB=A+B复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的实质:发生复分解反应的两种物质在水溶液中交换离子,生成沉淀、气体或水。符号表示:AB+CD=AD+CB酸的化学性质反应实例(写出化学方程式)与活泼金属反应与碱性氧化物反应与碱反应与某些盐反应使指示剂显色2HCl+Zn=ZnCl2+H2↑6HCl+Fe2O3=2FeCl3+3H2OHCl+NaOH=NaCl+H2O2HCl+CaCO3=CaCl2+CO2↑+H2O生成盐和氢气生成盐和水生成盐和水生成新盐和新酸任务1—酸、碱、盐的性质1.酸的主要化学性质有哪些?请列举反应实例,完成下表。(以HCl为例)使紫色石蕊变红,但不能使酚酞变色2.碱的主要化学性质有哪些?请列举反应实例,完成下表。(以火碱为例)
碱的主要化学性质 反应实例(写出化学方程式)
2NaOH+H2SO4 =Na2SO4 +2H2O
2NaOH+CO2=Na2CO3+H2O
2NaOH+CuCl2=Cu(OH)2↓+2NaCl
与酸性氧化物反应
与酸反应
与某些盐反应
使指示剂显色
生成盐和水
生成盐和水
生成新盐和新碱
任务1—酸、碱、盐的性质
紫色石蕊变蓝,无色酚酞变红
盐的主要化学性质反应实例(写出化学方程式)CuSO4+Fe=Cu+FeSO4FeCl3+3NaOH=3NaCl+Fe(OH)3↓CaCO3+2HCl=CaCl2+CO2↑+H2OBaCl2+CuSO4=CuCl2+BaSO4↓与较活泼金属反应与碱反应与酸反应与某些盐反应生成新金属和新盐生成新盐和新碱生成新盐和新酸生成新盐3.盐的主要化学性质有哪些?请列举反应实例,完成下表。任务1—酸、碱、盐的性质思考1:为什么不同的酸(或碱)具有相似的化学性质?任务1—酸、碱、盐的性质阴离子阳离子OH-NO3-Cl-SO42-CO32-H+溶、挥溶、挥溶溶NH4+溶、挥溶溶溶溶K+溶溶溶溶溶Na+溶溶溶溶溶Ba2+溶溶溶不不Ca2+微溶溶微不Mg2+不溶溶溶微Al3+不溶溶溶—Mn2+不溶溶溶不Zn2+不溶溶溶不Fe2+不溶溶溶不Fe3+不溶溶溶—Cu2+不溶溶溶不Ag+—溶不微不酸碱任务1—酸、碱、盐的性质思考1:为什么不同的酸(或碱)具有相似的化学性质?因为它们在组成上有相似性:不同的酸溶液中都含有H+不同的碱溶液中都含有OH-由此可以推测,如果盐在组成上有相似性,那么盐在性质上也会有相似性。任务1—酸、碱、盐的性质阴离子阳离子OH-NO3-Cl-SO42-CO32-H+溶、挥溶、挥溶溶NH4+溶、挥溶溶溶溶K+溶溶溶溶溶Na+溶溶溶溶溶Ba2+溶溶溶不不Ca2+微溶溶微不Mg2+不溶溶溶微Al3+不溶溶溶—Mn2+不溶溶溶不Zn2+不溶溶溶不Fe2+不溶溶溶不Fe3+不溶溶溶—Cu2+不溶溶溶不Ag+—溶不微不盐铵 盐钠 盐钙 盐铝 盐硝 酸 盐氯化物(盐酸盐)硫 酸 盐碳 酸 盐任务1—酸、碱、盐的性质由此可见,根据物质的组成对物质进行分类,可以更好地帮助我们学习一类物质的化学性质;而同类物质具有相似的化学性质正是由于它们的组成相似所导致。思考2:在以上酸、碱、盐的主要化学性质中,涉及哪些反应类型?置换反应Zn+H2SO4=ZnSO4+H2↑Fe+CuSO4=Cu+FeSO4HCl+NaOH=NaCl+H2OCaCO3+2HCl=CaCl2+CO2↑+H2O2NaOH+CuCl2=Cu(OH)2↓+2NaClBaCl2+CuSO4=CuCl2+BaSO4↓复分解反应任务2—物质的转化观察下列物质之间的转化,归纳由金属单质到盐、非金属单质到盐的转化关系:CaCaO Ca(OH)2CaSO4金属单质 碱性氧化物 碱 盐CCO2H2CO3CaCO3氧气水酸或酸性氧化物非金属单质 酸性氧化物 酸 盐氧气水碱或碱性氧化物拓展:以Na元素与S元素尝试构建物质的转化关系。任务2—物质的转化Na金属单质碱性氧化物碱盐O2H2O酸或 酸性氧化物Na2ONaOHNa2CO3S非金属单质酸性氧化物酸盐O2H2O碱或 碱性氧化物SO2H2SO4MgSO4转化规律SO32Na +SNa2S△Na2O + H2O = 2NaOH4Na +O2= 2Na2O2NaOH+CO2= Na2CO3+H2OS +O2SO2点燃SO3+ H2O = H2SO4Mg(OH)2+H2SO4= MgSO4+2H2ONa2O + SO2= Na2SO3Na2O + SO3= Na2SO42NaOH+SO2= Na2SO3+H2O2NaOH+SO3= Na2SO4+H2O2NaOH+H2SO4= Na2SO4+2H2O2NaOH+MgSO4= Na2SO4+ Mg(OH)2↓Na2CO3+H2SO4= Na2SO4+CO2↑+H2ONa2CO3+MgSO4= Na2SO4+MgCO3↓Na2O +H2SO4= Na2SO4+ H2O任务2—物质的转化金属碱性氧化物碱盐非金属酸性氧化物酸盐盐盐+水另两种盐盐+氢气金属+盐盐+碱盐+酸任务2—物质的转化思考3:要制取氢氧化钠可以采用哪些方法?1.碱性氧化物与水反应Na2O + H2O═2NaOH2.盐与另一种碱反应Na2CO3+ Ca(OH)2═CaCO3↓+2NaOH3.工业上制取氢氧化钠:电解饱和食盐水任务3—物质转化的应用思考4:现有原料CuCO3,能否通过转化关系图找到制取Cu单质的可能方法?CuCO3难溶盐可溶盐酸金属金属CuSO4CuH2SO4FeCuCO3+H2SO4═CuSO4+CO2↑+H2OCuSO4+Fe═Cu+FeSO4任务3—物质转化的应用同一类型物质往往具有相同的组成,根据物质的组成对物质进行分类有助于我们掌握物质的化学性质,进而通过化学变化可以实现物质之间的转化。任务3—物质转化的应用6.写出下列物质之间转化的化学方程式。(1) Cu → CuO → CuSO4→ Cu(OH)2→ CuSO4→ Cu2Cu +O22CuO△CuO +H2SO4CuSO4+H2OCuSO4+2NaOH Cu(OH)2↓+Na2SO4Cu(OH)2+H2SO4CuSO4+2H2OFe+CuSO4Cu+FeSO4练习与应用练习与应用6.写出下列物质之间转化的化学方程式。(2) C → CO2→CaCO3→ CaO → Ca(OH)2→ CaCl2C +O2CO2点燃△CaCO3CaO+ CO2↑Ca(OH)2+CO2CaCO3↓+H2OCaO + H2O Ca(OH)2Ca(OH)2+ 2HCl CaCl2+2H2O7.采用不同方法制取下列物质,并写出反应的化学方程式。(1)以Fe、CuO、H2SO4三种物质为原料,用两种方法制取Cu。方法二:CuO +H2SO4CuSO4+H2OFe+CuSO4Cu+FeSO4(1)方法一:Fe+H2SO4FeSO4+H2↑CuO +H2Cu+H2O△练习与应用7.采用不同方法制取下列物质,并写出反应的化学方程式。(2)用3种方法制取MgCl2。(2)方法一:Mg +Cl2MgCl2点燃方法二:MgO +2HCl MgCl2+H2OMg(OH)2+2HCl MgCl2+2H2O方法三:MgSO4+BaCl2MgCl2+BaSO4↓MgCO3+2HCl MgCl2+CO2↑+H2O方法四:Mg +2HCl MgCl2+H2↑练习与应用课后请仔细复习这一阶段的内容
