2.3.2《配位键》教学课件(共22张PPT)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.3.2《配位键》教学课件(共22张PPT)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-13 22:31:57 | ||
图片预览





文档简介
(共22张PPT)
第2章 第3节 第2课时 《配位键》
鲁科版 选择性必修2
H2O
无水硫酸铜
盐酸
氨水
【百变魔法】
配位键
课标要点 核心素养
1.知道配位键的特点、认识简单配位化合物的成键特征。 2.了解配位化合物的存在与应用。通过探究配合物的制备,了解外界条件对配合物的影响。
发展宏观辨识与微观探析
落实变化观念与平衡思想
培养实验探究与创新意识
今 日 之 星
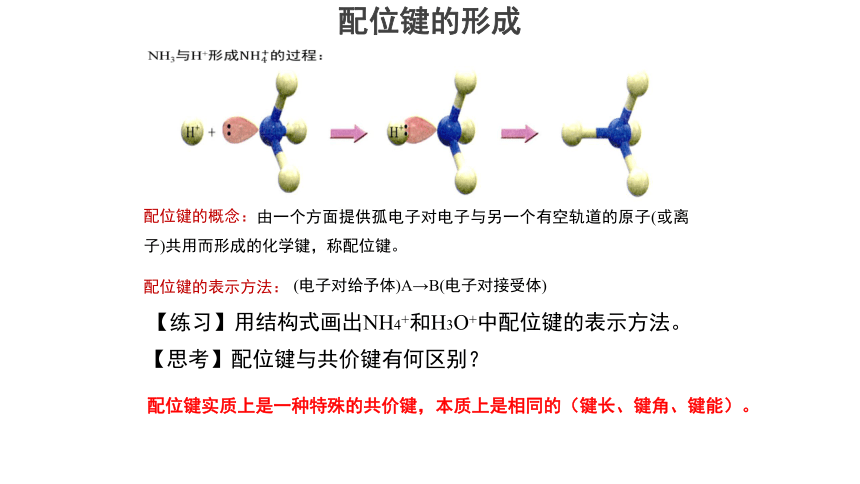
配位键的形成
NH3与H+形成的过程:
由一个方面提供孤电子对电子与另一个有空轨道的原子(或离子)共用而形成的化学键,称配位键。
配位键的概念:
配位键的表示方法:
(电子对给予体)A→B(电子对接受体)
【思考】配位键与共价键有何区别?
配位键实质上是一种特殊的共价键,本质上是相同的(键长、键角、键能)。
【练习】用结构式画出NH4+和H3O+中配位键的表示方法。
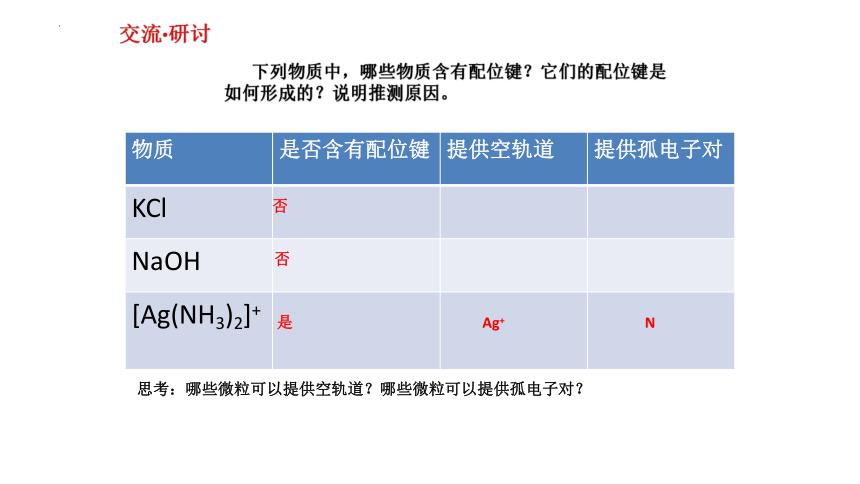
交流·研讨
下列物质中,哪些物质含有配位键?它们的配位键是
如何形成的?说明推测原因。
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
否
是
否
Ag+
N
思考:哪些微粒可以提供空轨道?哪些微粒可以提供孤电子对?
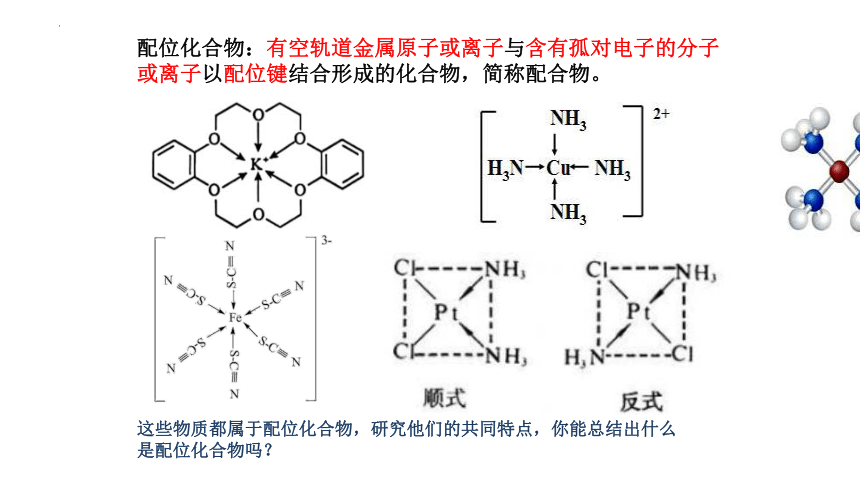
这些物质都属于配位化合物,研究他们的共同特点,你能总结出什么是配位化合物吗?
配位化合物:有空轨道金属原子或离子与含有孤对电子的分子
或离子以配位键结合形成的化合物,简称配合物。
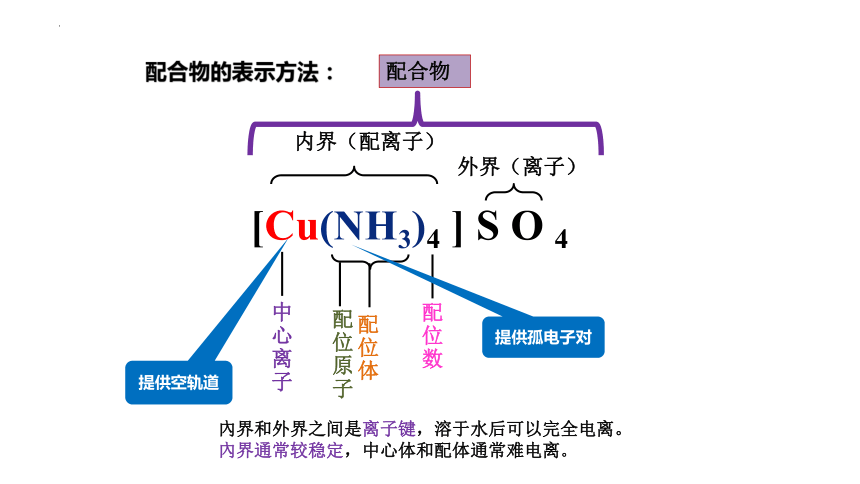
[Cu(NH3)4 ] S O 4
外界(离子)
配
位
数
中
心
离
子
配
位
体
配
位
原
子
配合物的表示方法:
提供孤电子对
提供空轨道
内界(配离子)
配合物
內界和外界之间是离子键,溶于水后可以完全电离。
內界通常较稳定,中心体和配体通常难电离。
物质性质比较
物质 颜色 150℃持续加热 摩尔电导率测定 加入足量的硝酸银
CoCl3·6NH3 橙色 无氨气释放 1mol该物质在水中电离出4mol离子 1mol该物质生产3molAgCl沉淀
CoCl3·5NH3 紫色 无氨气释放 1mol该物质在水中电离出3mol离子 1mol该物质生产2molAgCl沉淀
【探究1】 18世纪末,人们刚开始研究配合物时,发现这
两种配合物的性质让人困惑不已,请同学们认真观察,仔细思考。
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
探究配位化合物的结构
配合物的形成条件
①中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
②配位体:提供孤电子对的原子、离子或分子,如原子ⅤA、ⅥA、ⅦA族元素的原子;分子CO、NH3、H2O等,阴离子F-、CN-、OH - 、 Cl- 、SCN-等。配位原子必须有孤电子对。
③配位数:配位原子的数目。
H2O
无水硫酸铜
盐酸
氨水
【魔法解密】
[Cu(H2O)4]2+
[CuCl4]2-
[Cu(NH3)4]2+
在配位化学及其应用领域做出重要贡献的我国著名化学家
科学态度与社会责任
专长量子化学;关于“配位场理论”
的研究,共发表学术论文260多篇,
学术专著8部。
被誉为“中国稀土之父”、
“稀土界的袁隆平”
实验任务 实验过程 实验现象 结论
1.探究氯化铜溶液稀释过程中所发生的变化
2. Fe(NO3)3和FeCl3溶液显黄色的原因
3.对比Cu2+与氨水和OH-反应的差异
4. 制备[Ag(NH3)2]+
【实验探究】
探究配位化合物制备和配合物的形成因素
实验任务 实验现象 结论
1.探究氯化铜溶液稀释过程中所发生的变化
2. Fe(NO3)3和FeCl3溶液显黄色的原因
黄绿色溶液最后变为蓝色溶液
[CuCl4]2-+4H2O
黄绿
[Cu(H2O)4]2++4Cl-
蓝色
Fe3+水解与OH-配位呈现黄色
[Fe(H2O)6-n(OH)n]3-n+nH3O+ [Fe(H2O)6]3++nH2O
[Fe(H2O)6]3++4Cl- [FeCl4]-+6H2O
Fe3+与Cl-配位呈现黄色
向硝酸铁的溶液中滴加几滴稀硝酸,黄色溶液变为无色
向褪色后的硝酸铁中滴加氯化钠溶液
无色溶液变为黄色
向FeCl3溶液中滴加几滴稀硝酸黄色溶液几乎无变化
实验任务 实验现象 结论
3.对比Cu2+与氨水和OH-反应的差异
4. 制备[Ag(NH3)2]+
【实验探究】
蓝色溶液转化为蓝色沉淀最后变为蓝色溶液
无色溶液转化为白色沉淀最后沉淀消失产生无色溶液
蓝色溶液转化为蓝色沉淀最后变为深蓝色溶液
①Cu2++2OH- Cu(OH)2↓
②Cu(OH)2+2OH- [ Cu(OH)4]2-
①Cu2++2NH3·H2O Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O [ Cu(NH3)4]2++2OH-+4H2O
Ag++NH3·H2O AgOH↓+NH4+
AgOH+2NH3·H2O [Ag(NH3)2]++ OH- + 2H2O
Fe3+的配位化合物较稳定几用途广泛。Fe3+可与H2O、SCN-、F-等配体形成溶液呈浅紫色的[(Fe(H2O)6]3+、红色的[Fe(SCN)6]3+、无色的[FeF6]3+配离子。某同学按如下步骤完成实验:
【直击高考】
[(Fe(H2O)6]3+呈浅紫色,但溶液1呈现黄色,其原因是 ,
为了能观察到溶液Ⅰ中[(Fe(H2O)6]3+的浅紫色,可采取的方法是 。
Fe3+和OH-形成配离子的颜色
向该溶液中加入适量硝酸
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
配位化合物应用
我们需要继续探索,
未来世界的大门等着我们去开启!
CO为什么能使人中毒?
采取怎样的措施?
课堂小结:
→ 配合物
概 念
形成条件
表示方法
形成与结构
配合物的制备
配合物的应用
配位键
1.0.01molCrCl3·6H2O在水溶液中用过量硝酸银溶液处理,
生成0.02molAgCl沉淀。已知该CrCl3·6H2O中Cr3+形成六个配位键,
则其结构是( )
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl]Cl2·2H2O D.[Cr(H2O)3Cl3]Cl2·3H2O
2.下列说法中错误的是( )
A.含有配位键的化合物就是配位化合物
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.[Cu(NH3)4]2+中的Cu2+提供空轨道,NH3中的N原子提供孤对电子形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应等领域都有着广泛的应用
B
A
【当堂检测】
【任务1】完成课后习题
【任务2】乙二胺(H2NCH2CH2NH2)能否与Cu2+形成配位键呢?
请画出成键示意图。
【课后提升】
谢谢!
第2章 第3节 第2课时 《配位键》
鲁科版 选择性必修2
H2O
无水硫酸铜
盐酸
氨水
【百变魔法】
配位键
课标要点 核心素养
1.知道配位键的特点、认识简单配位化合物的成键特征。 2.了解配位化合物的存在与应用。通过探究配合物的制备,了解外界条件对配合物的影响。
发展宏观辨识与微观探析
落实变化观念与平衡思想
培养实验探究与创新意识
今 日 之 星
配位键的形成
NH3与H+形成的过程:
由一个方面提供孤电子对电子与另一个有空轨道的原子(或离子)共用而形成的化学键,称配位键。
配位键的概念:
配位键的表示方法:
(电子对给予体)A→B(电子对接受体)
【思考】配位键与共价键有何区别?
配位键实质上是一种特殊的共价键,本质上是相同的(键长、键角、键能)。
【练习】用结构式画出NH4+和H3O+中配位键的表示方法。
交流·研讨
下列物质中,哪些物质含有配位键?它们的配位键是
如何形成的?说明推测原因。
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
否
是
否
Ag+
N
思考:哪些微粒可以提供空轨道?哪些微粒可以提供孤电子对?
这些物质都属于配位化合物,研究他们的共同特点,你能总结出什么是配位化合物吗?
配位化合物:有空轨道金属原子或离子与含有孤对电子的分子
或离子以配位键结合形成的化合物,简称配合物。
[Cu(NH3)4 ] S O 4
外界(离子)
配
位
数
中
心
离
子
配
位
体
配
位
原
子
配合物的表示方法:
提供孤电子对
提供空轨道
内界(配离子)
配合物
內界和外界之间是离子键,溶于水后可以完全电离。
內界通常较稳定,中心体和配体通常难电离。
物质性质比较
物质 颜色 150℃持续加热 摩尔电导率测定 加入足量的硝酸银
CoCl3·6NH3 橙色 无氨气释放 1mol该物质在水中电离出4mol离子 1mol该物质生产3molAgCl沉淀
CoCl3·5NH3 紫色 无氨气释放 1mol该物质在水中电离出3mol离子 1mol该物质生产2molAgCl沉淀
【探究1】 18世纪末,人们刚开始研究配合物时,发现这
两种配合物的性质让人困惑不已,请同学们认真观察,仔细思考。
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
探究配位化合物的结构
配合物的形成条件
①中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
②配位体:提供孤电子对的原子、离子或分子,如原子ⅤA、ⅥA、ⅦA族元素的原子;分子CO、NH3、H2O等,阴离子F-、CN-、OH - 、 Cl- 、SCN-等。配位原子必须有孤电子对。
③配位数:配位原子的数目。
H2O
无水硫酸铜
盐酸
氨水
【魔法解密】
[Cu(H2O)4]2+
[CuCl4]2-
[Cu(NH3)4]2+
在配位化学及其应用领域做出重要贡献的我国著名化学家
科学态度与社会责任
专长量子化学;关于“配位场理论”
的研究,共发表学术论文260多篇,
学术专著8部。
被誉为“中国稀土之父”、
“稀土界的袁隆平”
实验任务 实验过程 实验现象 结论
1.探究氯化铜溶液稀释过程中所发生的变化
2. Fe(NO3)3和FeCl3溶液显黄色的原因
3.对比Cu2+与氨水和OH-反应的差异
4. 制备[Ag(NH3)2]+
【实验探究】
探究配位化合物制备和配合物的形成因素
实验任务 实验现象 结论
1.探究氯化铜溶液稀释过程中所发生的变化
2. Fe(NO3)3和FeCl3溶液显黄色的原因
黄绿色溶液最后变为蓝色溶液
[CuCl4]2-+4H2O
黄绿
[Cu(H2O)4]2++4Cl-
蓝色
Fe3+水解与OH-配位呈现黄色
[Fe(H2O)6-n(OH)n]3-n+nH3O+ [Fe(H2O)6]3++nH2O
[Fe(H2O)6]3++4Cl- [FeCl4]-+6H2O
Fe3+与Cl-配位呈现黄色
向硝酸铁的溶液中滴加几滴稀硝酸,黄色溶液变为无色
向褪色后的硝酸铁中滴加氯化钠溶液
无色溶液变为黄色
向FeCl3溶液中滴加几滴稀硝酸黄色溶液几乎无变化
实验任务 实验现象 结论
3.对比Cu2+与氨水和OH-反应的差异
4. 制备[Ag(NH3)2]+
【实验探究】
蓝色溶液转化为蓝色沉淀最后变为蓝色溶液
无色溶液转化为白色沉淀最后沉淀消失产生无色溶液
蓝色溶液转化为蓝色沉淀最后变为深蓝色溶液
①Cu2++2OH- Cu(OH)2↓
②Cu(OH)2+2OH- [ Cu(OH)4]2-
①Cu2++2NH3·H2O Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O [ Cu(NH3)4]2++2OH-+4H2O
Ag++NH3·H2O AgOH↓+NH4+
AgOH+2NH3·H2O [Ag(NH3)2]++ OH- + 2H2O
Fe3+的配位化合物较稳定几用途广泛。Fe3+可与H2O、SCN-、F-等配体形成溶液呈浅紫色的[(Fe(H2O)6]3+、红色的[Fe(SCN)6]3+、无色的[FeF6]3+配离子。某同学按如下步骤完成实验:
【直击高考】
[(Fe(H2O)6]3+呈浅紫色,但溶液1呈现黄色,其原因是 ,
为了能观察到溶液Ⅰ中[(Fe(H2O)6]3+的浅紫色,可采取的方法是 。
Fe3+和OH-形成配离子的颜色
向该溶液中加入适量硝酸
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
配位化合物应用
我们需要继续探索,
未来世界的大门等着我们去开启!
CO为什么能使人中毒?
采取怎样的措施?
课堂小结:
→ 配合物
概 念
形成条件
表示方法
形成与结构
配合物的制备
配合物的应用
配位键
1.0.01molCrCl3·6H2O在水溶液中用过量硝酸银溶液处理,
生成0.02molAgCl沉淀。已知该CrCl3·6H2O中Cr3+形成六个配位键,
则其结构是( )
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl]Cl2·2H2O D.[Cr(H2O)3Cl3]Cl2·3H2O
2.下列说法中错误的是( )
A.含有配位键的化合物就是配位化合物
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.[Cu(NH3)4]2+中的Cu2+提供空轨道,NH3中的N原子提供孤对电子形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应等领域都有着广泛的应用
B
A
【当堂检测】
【任务1】完成课后习题
【任务2】乙二胺(H2NCH2CH2NH2)能否与Cu2+形成配位键呢?
请画出成键示意图。
【课后提升】
谢谢!
