2023-2024学年高中化学苏教版2019必修第一册 1-2-3物质的化学计量(第3课时) 课件(共26张)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 1-2-3物质的化学计量(第3课时) 课件(共26张) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 08:39:50 | ||
图片预览





文档简介
(共26张PPT)
专题一第二单元
物质的化学计量
03
气体摩尔体积
一个班在操场上列队的面积与什么有关?
学生人数
学生之间的距离
学生胖瘦
物质的体积与什么有关?
粒子数目
粒子大小
粒子之间的距离
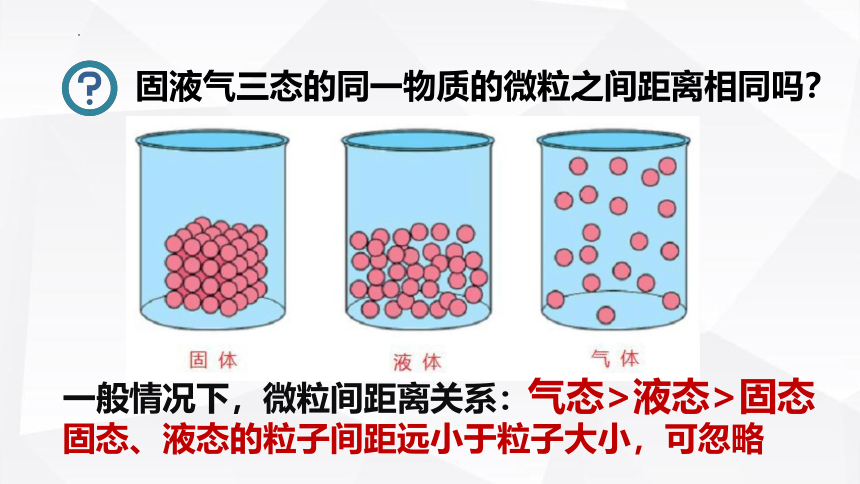
固液气三态的同一物质的微粒之间距离相同吗?
气态>液态>固态
一般情况下,微粒间距离关系:
固态、液态的粒子间距远小于粒子大小,可忽略
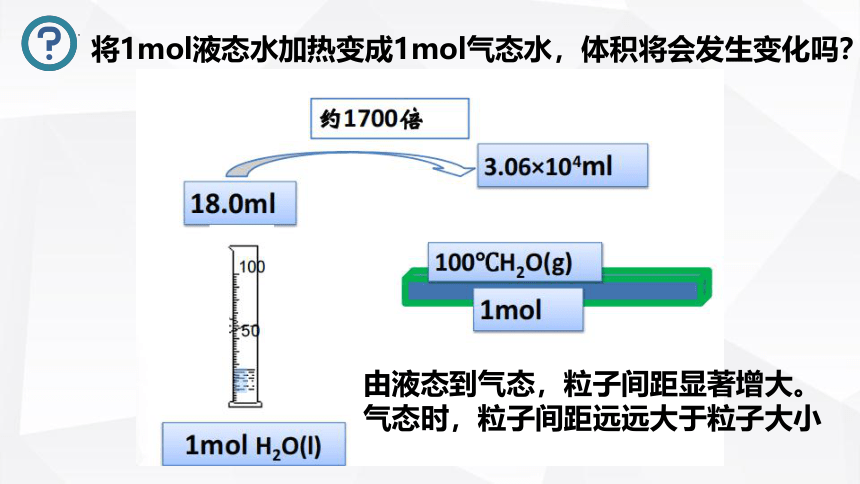
将1mol液态水加热变成1mol气态水,体积将会发生变化吗?
由液态到气态,粒子间距显著增大。
气态时,粒子间距远远大于粒子大小
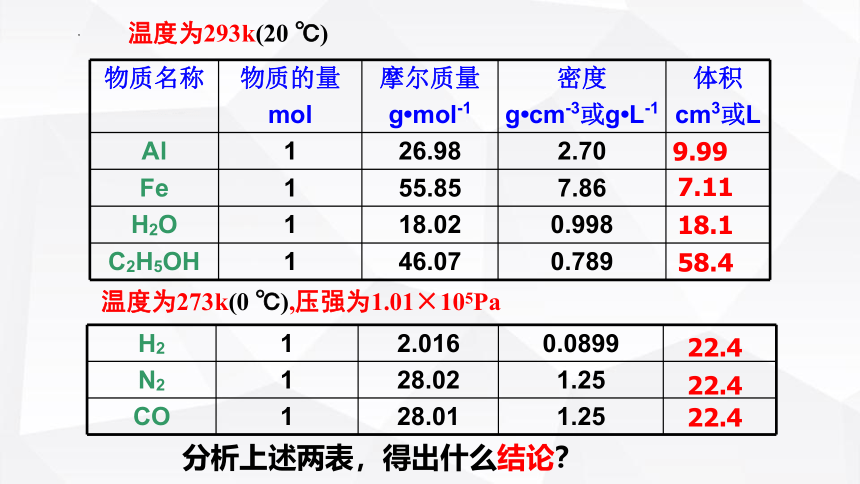
物质名称 物质的量 mol 摩尔质量 g mol-1 密度 g cm-3或g L-1 体积
cm3或L
Al 1 26.98 2.70 9.99
Fe 1 55.85 7.86
H2O 1 18.02 0.998
C2H5OH 1 46.07 0.789
7.11
18.1
58.4
温度为293k(20 ℃)
H2 1 2.016 0.0899
N2 1 28.02 1.25
CO 1 28.01 1.25
22.4
22.4
22.4
温度为273k(0 ℃),压强为1.01×105Pa
分析上述两表,得出什么结论?
1、1mol不同的固态或液态物质,体积不同;
在相同状态下,1mol气体的体积基本相同。
结论:
固体或液体
气体
结论:温度升高,体积增大,温度降低,体积减小
原因:温度升高,粒子间距增大,温度降低,粒子间距减小。
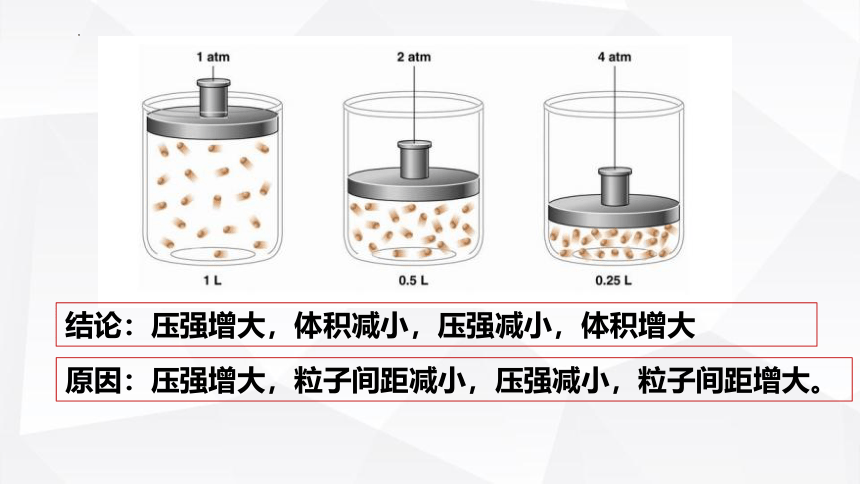
结论:压强增大,体积减小,压强减小,体积增大
原因:压强增大,粒子间距减小,压强减小,粒子间距增大。
如果温度和压强一定,则微粒间的平均距离一定,等量的气体的体积也就一定。
在相同状态下,1mol气体(单一气体或混合气体)的体积基本相同。
气体摩尔体积
1.定义:单位物质的量的气体所占的体积。即每mol气体所占的体积。
3.符号:L/mol,L·mol-1
2.符号:Vm 。
4.对象:任何气体(纯净或混合气体)
Vm = ---
V
n
5.公式:
不同温度和压强下,气体摩尔体积(Vm)不同。
几种气体在不同条件下的摩尔体积
H2 O2 CO2 HCl N2
0℃、101KPa (L/mol) 22.4 22.4 22.3 22.4 22.4
0℃、202KPa (L/mol) 11.2 11.2 11.2 11.2 11.2
20℃、101KPa (L/mol) 24.0 24.0 23.9 24.0 24.0
标准状况( 温度0 oC(273K)、压强 1.01×105 Pa)下
气体摩尔体积Vm约22.4L/mol
即 1mol任何气体在标准状况下体积约为22.4L
气体摩尔体积
注意事项:
(1)适用范围:气态物质,可以是单一气体,也可以是混合气体。
如:H2O、酒精、SO3
(2)物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·mol-1进行计算。
(3)1 mol气体在非标准状况下的体积,可能是22.4 L,也可能不是22.4 L。
强化巩固
1. 标准状况下,1mol任何物质的体积都约是22.4L。
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
(错,不一定)
强化巩固
填写下列空白:
1、标准状况下,0.5molH2,占有的体积约是 。
2、标准状况下,4.48LCO2 的物质的量是 。
11.2L
0.2mol
标准状况下,气体摩尔体积的有关计算
相关计算
①气体的物质的量n= mol;
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
③气体的分子数N=n·NA= ·NA;
④气体的质量m=n·M= ·M g。
=
N
NA
n
=
m
M
=
V
Vm
强化巩固
填写下列空白:
1、标准状况下,33.6 L Cl2的物质的量是 ,16 g O2所占体积约是 。
2、标准状况下,含有1.5 mol H2和0.5 mol O2的混合气体所占体积约是 。
1.5mol
2mol
3、标准状况下,34 g NH3的物质的量是 ,所占体积约是 ,所含的NH3分子数是 。
11.2L
44.8L
44.8L
1.204×1024
阿伏伽德罗定律
PV=nRT
在同温、同压下,相同体积的任何气体都含有相同数目的分子。
阿伏伽德罗定律
PV=nRT
三同定一同
同温(T)、同压(P)下,相同体积(V)的任何气体
都含有相同数目(N)的分子。
同温(T)、同压(P)下,相同体积(V)的任何气体
物质的量相同(n)。
同温(T)、同压(P)下,相同物质的量(n)的任何气体
体积相同(V)。
强化巩固
同温同压下,等体积的H2与CO2两种气体具有相同的( )
A. 质量 B.物质的量 C.原子个数 D.质子数
2.同温同压下,4.4克CO2与9.6克 O2所占的体积比是多少?
b
1:3
同温同压下,气体体积之比等于分子数之比,等于物质的量之比。
V1
V2
N1
N2
n1
n2
=
=
阿伏伽德罗定律
强化巩固
在一定温度和压强下,1体积X2(气)和3体积Y2(气)化合生成两体积气体化合物,则该化合物的分子式是( )
(A)XY3 (B)XY (C)X3Y (D)X2Y3
A
延时符
课堂小结
01
02
气体摩尔体积及单位
公式及相关计算
03
阿伏伽德罗定律及应用
课堂练习
D
1、下列物质的体积约为22.4 L的是( )
A.标准状况下1 mol H2O
B.20 ℃、101 kPa时36.5 g HCl
C.常温常压下17 g NH3
D.标准状况下0.4 mol H2和0.6 mol O2的混合气体
2、用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.非标准状况下,1 mol NH3的体积不可能是22.4 L
B.含有NA个氦原子的氦气在标准状况下的体积为11.2 L
C.11.2 L Cl2含有的分子数为0.5NA
D.标准状况下,11.2 L H2中含有的分子数为0.5NA
课堂练习
D
专题一第二单元
物质的化学计量
03
气体摩尔体积
一个班在操场上列队的面积与什么有关?
学生人数
学生之间的距离
学生胖瘦
物质的体积与什么有关?
粒子数目
粒子大小
粒子之间的距离
固液气三态的同一物质的微粒之间距离相同吗?
气态>液态>固态
一般情况下,微粒间距离关系:
固态、液态的粒子间距远小于粒子大小,可忽略
将1mol液态水加热变成1mol气态水,体积将会发生变化吗?
由液态到气态,粒子间距显著增大。
气态时,粒子间距远远大于粒子大小
物质名称 物质的量 mol 摩尔质量 g mol-1 密度 g cm-3或g L-1 体积
cm3或L
Al 1 26.98 2.70 9.99
Fe 1 55.85 7.86
H2O 1 18.02 0.998
C2H5OH 1 46.07 0.789
7.11
18.1
58.4
温度为293k(20 ℃)
H2 1 2.016 0.0899
N2 1 28.02 1.25
CO 1 28.01 1.25
22.4
22.4
22.4
温度为273k(0 ℃),压强为1.01×105Pa
分析上述两表,得出什么结论?
1、1mol不同的固态或液态物质,体积不同;
在相同状态下,1mol气体的体积基本相同。
结论:
固体或液体
气体
结论:温度升高,体积增大,温度降低,体积减小
原因:温度升高,粒子间距增大,温度降低,粒子间距减小。
结论:压强增大,体积减小,压强减小,体积增大
原因:压强增大,粒子间距减小,压强减小,粒子间距增大。
如果温度和压强一定,则微粒间的平均距离一定,等量的气体的体积也就一定。
在相同状态下,1mol气体(单一气体或混合气体)的体积基本相同。
气体摩尔体积
1.定义:单位物质的量的气体所占的体积。即每mol气体所占的体积。
3.符号:L/mol,L·mol-1
2.符号:Vm 。
4.对象:任何气体(纯净或混合气体)
Vm = ---
V
n
5.公式:
不同温度和压强下,气体摩尔体积(Vm)不同。
几种气体在不同条件下的摩尔体积
H2 O2 CO2 HCl N2
0℃、101KPa (L/mol) 22.4 22.4 22.3 22.4 22.4
0℃、202KPa (L/mol) 11.2 11.2 11.2 11.2 11.2
20℃、101KPa (L/mol) 24.0 24.0 23.9 24.0 24.0
标准状况( 温度0 oC(273K)、压强 1.01×105 Pa)下
气体摩尔体积Vm约22.4L/mol
即 1mol任何气体在标准状况下体积约为22.4L
气体摩尔体积
注意事项:
(1)适用范围:气态物质,可以是单一气体,也可以是混合气体。
如:H2O、酒精、SO3
(2)物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·mol-1进行计算。
(3)1 mol气体在非标准状况下的体积,可能是22.4 L,也可能不是22.4 L。
强化巩固
1. 标准状况下,1mol任何物质的体积都约是22.4L。
2. 1mol气体的体积约为22.4L。
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,物质应是气体)
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
(错,不一定)
强化巩固
填写下列空白:
1、标准状况下,0.5molH2,占有的体积约是 。
2、标准状况下,4.48LCO2 的物质的量是 。
11.2L
0.2mol
标准状况下,气体摩尔体积的有关计算
相关计算
①气体的物质的量n= mol;
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
③气体的分子数N=n·NA= ·NA;
④气体的质量m=n·M= ·M g。
=
N
NA
n
=
m
M
=
V
Vm
强化巩固
填写下列空白:
1、标准状况下,33.6 L Cl2的物质的量是 ,16 g O2所占体积约是 。
2、标准状况下,含有1.5 mol H2和0.5 mol O2的混合气体所占体积约是 。
1.5mol
2mol
3、标准状况下,34 g NH3的物质的量是 ,所占体积约是 ,所含的NH3分子数是 。
11.2L
44.8L
44.8L
1.204×1024
阿伏伽德罗定律
PV=nRT
在同温、同压下,相同体积的任何气体都含有相同数目的分子。
阿伏伽德罗定律
PV=nRT
三同定一同
同温(T)、同压(P)下,相同体积(V)的任何气体
都含有相同数目(N)的分子。
同温(T)、同压(P)下,相同体积(V)的任何气体
物质的量相同(n)。
同温(T)、同压(P)下,相同物质的量(n)的任何气体
体积相同(V)。
强化巩固
同温同压下,等体积的H2与CO2两种气体具有相同的( )
A. 质量 B.物质的量 C.原子个数 D.质子数
2.同温同压下,4.4克CO2与9.6克 O2所占的体积比是多少?
b
1:3
同温同压下,气体体积之比等于分子数之比,等于物质的量之比。
V1
V2
N1
N2
n1
n2
=
=
阿伏伽德罗定律
强化巩固
在一定温度和压强下,1体积X2(气)和3体积Y2(气)化合生成两体积气体化合物,则该化合物的分子式是( )
(A)XY3 (B)XY (C)X3Y (D)X2Y3
A
延时符
课堂小结
01
02
气体摩尔体积及单位
公式及相关计算
03
阿伏伽德罗定律及应用
课堂练习
D
1、下列物质的体积约为22.4 L的是( )
A.标准状况下1 mol H2O
B.20 ℃、101 kPa时36.5 g HCl
C.常温常压下17 g NH3
D.标准状况下0.4 mol H2和0.6 mol O2的混合气体
2、用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.非标准状况下,1 mol NH3的体积不可能是22.4 L
B.含有NA个氦原子的氦气在标准状况下的体积为11.2 L
C.11.2 L Cl2含有的分子数为0.5NA
D.标准状况下,11.2 L H2中含有的分子数为0.5NA
课堂练习
D
