2023-2024学年高中化学苏教版2019必修第一册 1-3物质的分散系 课件(共33张)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 1-3物质的分散系 课件(共33张) |  | |
| 格式 | pptx | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 08:40:45 | ||
图片预览









文档简介
(共33张PPT)
专题一第二单元
物质的分散系
01
物质的分散系
物质的分散系
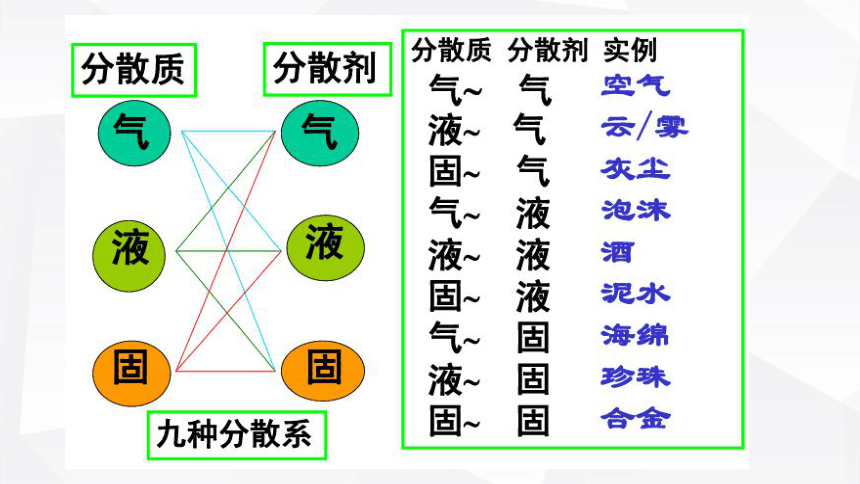
定义:由一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合物体系
分散质:
分散剂:
溶液就是一种均一、稳定的分散系
溶质:NaCl
溶剂:水
玻璃
某些胶态金属氧化物
分散质:
分散剂:
水滴或冰晶
空气
分散质:
分散剂:
物质的分散系
固体小颗粒
空气
分散质:
分散剂:
碳酸钙
水
分散质:
分散剂:
物质的分散系
物质的分散系
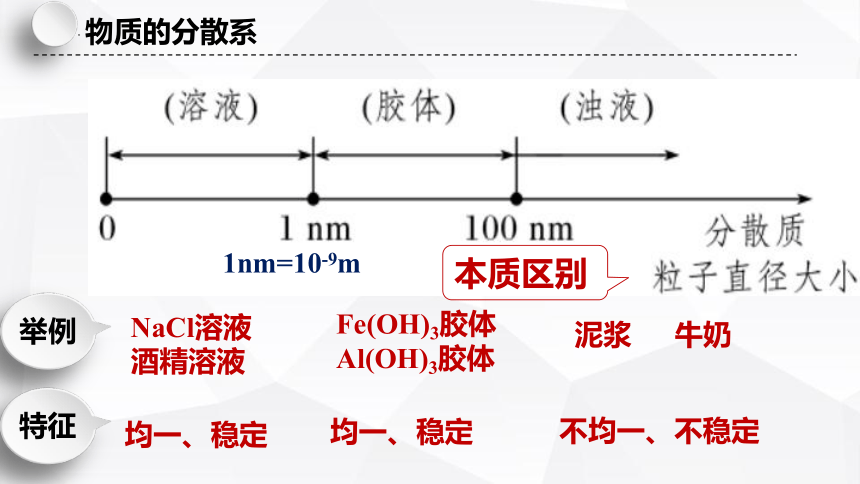
举例
均一、稳定
NaCl溶液
酒精溶液
特征
本质区别
均一、稳定
Fe(OH)3胶体
Al(OH)3胶体
不均一、不稳定
泥浆 牛奶
1nm=10-9m
如何制备Fe(OH)3胶体?
胶体
如何鉴别胶体和溶液?
胶体
当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路,该现象称为丁达尔效应
胶体
胶体
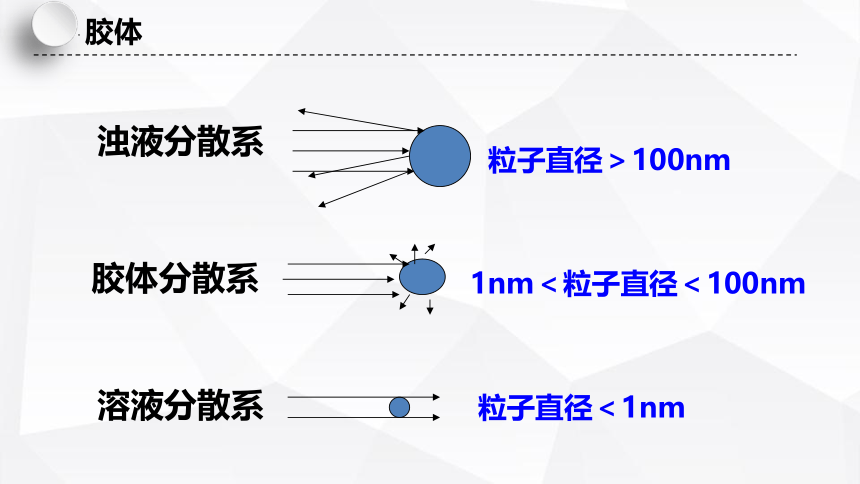
浊液分散系
粒子直径>100nm
胶体分散系
1nm<粒子直径<100nm
溶液分散系
粒子直径<1nm
胶体
生活中的丁达尔现象
胶体
溶液、胶体可透过滤纸
胶体
溶液离子可透过半透膜,胶体不能。
胶体
应用
1
在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改善材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改善材料的光学性质。有色玻璃就是将某些胶态金属氧化物分散于玻璃中制成的。
胶体应用领域正在不断扩大,形成了化学研究的重要分支——胶体与表面化学。
胶体
应用
2
医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
胶体应用领域正在不断扩大,形成了化学研究的重要分支——胶体与表面化学。
胶体
应用
3
国防工业中有些火药、炸药须制成胶体。一些纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造都会用到胶体。
胶体应用领域正在不断扩大,形成了化学研究的重要分支——胶体与表面化学。
电解质溶液
Distilled 蒸馏水
EtOH 乙醇溶液
可导电
不可导电
NaCl溶液、NaOH溶液、HCl溶液
Na+
液 面
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
H2O
Cl-
Na+
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
NaCl溶液
H2O
H2O
H2O
H2O
H2O
液 面
EtOH
EtOH
EtOH
H2O
EtOH
EtOH
EtOH
乙醇溶液
H2O
H2O
H2O
H2O
H2O
物质导电条件:自由移动带电荷的粒子
NaCl在水中的溶解和电离的示意图
电解质:在水溶液中或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下都不导电的化合物。
电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
电离:
物质
混合物
纯净物
化合物
单质
电解质
非电解质
酸、碱、盐、水
活泼金属氧化物
非金属氧化物
大部分有机物(乙醇、蔗糖)
既不是电解质也不是非电解质
电解质溶液
分析对错:铁丝和盐酸能导电,所以二者是电解质,液态硫酸不导电,所以硫酸是非电解质。
电解质溶液
不对。
因为电解质和非电解质都是化合物,而铁是单质,盐酸是混合物,故两者既不是电解质,也不是非电解质;
硫酸溶液能导电,硫酸是电解质。
判断一个物质是否是电解质的依据是什么?
在水溶液中或熔融状态下能导电。
电解质溶液
1、判断SO2、NH3是否是电解质?
2、电解质在水溶液中和熔融状态下都能导电?
3、化合物不是电解质就是非电解质?
4、固体氯化钠不导电,所以它不是电解质?
溶于水后能导电的是H2SO3、NH3·H2O,不是SO2、NH3本身,故H2SO3、NH3·H2O是电解质,SO2、NH3是非电解质。
不一定
对的
氯化钠在水溶液中或熔融状态下均能导电,是电解质。
强化巩固
下列物质:
①液态氯化氢 ②硫酸 ③熔融MgCl2 ④胆矾晶体
⑤食盐水 ⑥酒精 ⑦氨水 ⑧液氨 ⑨汞
⑩BaSO4 ⑾SO3 ⑿石墨
其中能导电的物质有 ,
属于电解质的是 ,
属于非电解质的是 。
③⑤⑦⑨⑿
①②③④⑩
⑥⑧⑾
电解质溶液
干燥的NaCl固体不导电
NaCl溶液和熔融的NaCl均能电离出自由移动的Na+和Cl-;
但干燥的NaCl固体不能
电离的表示——电离方程式
电解质溶液
用化学符号表示电解质电离成自由移动离子的过程。
NaCl = Na+ + Cl-
KNO3= K+ + NO3-
NaOH=Na+ + OH-
书写步骤:
①阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、
OH-、NH4+、CO32-等不能拆。
②构成物质的原子或原子团的个数在书写成离子时为化学计量数。
Al2(SO4)3==
2Al3++3SO42-
电解质溶液
书写注意事项
①式子左边书写化学式,表示电解质还未电离时的状态;
右边书写离子符号,表示电解质电离产生的离子。
②离子所带的电荷数应等于元素或原子团的化合价数。 ③电离方程式左右两边正负电荷之和相等
电解质溶液
从电离角度理解酸、碱、盐:
H+
OH-
电解质溶液
延时符
课堂小结
01
02
物质分散系
胶体及性质
03
电解质及非电解质及判断
04
电离方程式
课堂练习
C
1.下列叙述正确的是( )
A.直径介于1~100 nm之间的粒子称为胶体
B.用过滤的方法可以将胶体和溶液分离
C.利用丁达尔效应可以区别溶液与胶体
D.胶体区别于其他分散系的本质特征是丁达尔效应
课堂练习
2.现有下列物质:
①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩胆矾晶体
请用序号填空:
(1)上述状态下可导电的是__________。
(2)属于电解质的是_____________。
(3)属于非电解质的是______。
(4)上述状态下的电解质不能导电的是__________。
②④⑥⑨
①③⑦⑨⑩
⑤⑧
①③⑦⑩
专题一第二单元
物质的分散系
01
物质的分散系
物质的分散系
定义:由一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合物体系
分散质:
分散剂:
溶液就是一种均一、稳定的分散系
溶质:NaCl
溶剂:水
玻璃
某些胶态金属氧化物
分散质:
分散剂:
水滴或冰晶
空气
分散质:
分散剂:
物质的分散系
固体小颗粒
空气
分散质:
分散剂:
碳酸钙
水
分散质:
分散剂:
物质的分散系
物质的分散系
举例
均一、稳定
NaCl溶液
酒精溶液
特征
本质区别
均一、稳定
Fe(OH)3胶体
Al(OH)3胶体
不均一、不稳定
泥浆 牛奶
1nm=10-9m
如何制备Fe(OH)3胶体?
胶体
如何鉴别胶体和溶液?
胶体
当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路,该现象称为丁达尔效应
胶体
胶体
浊液分散系
粒子直径>100nm
胶体分散系
1nm<粒子直径<100nm
溶液分散系
粒子直径<1nm
胶体
生活中的丁达尔现象
胶体
溶液、胶体可透过滤纸
胶体
溶液离子可透过半透膜,胶体不能。
胶体
应用
1
在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改善材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改善材料的光学性质。有色玻璃就是将某些胶态金属氧化物分散于玻璃中制成的。
胶体应用领域正在不断扩大,形成了化学研究的重要分支——胶体与表面化学。
胶体
应用
2
医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
胶体应用领域正在不断扩大,形成了化学研究的重要分支——胶体与表面化学。
胶体
应用
3
国防工业中有些火药、炸药须制成胶体。一些纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造都会用到胶体。
胶体应用领域正在不断扩大,形成了化学研究的重要分支——胶体与表面化学。
电解质溶液
Distilled 蒸馏水
EtOH 乙醇溶液
可导电
不可导电
NaCl溶液、NaOH溶液、HCl溶液
Na+
液 面
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
H2O
Cl-
Na+
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
NaCl溶液
H2O
H2O
H2O
H2O
H2O
液 面
EtOH
EtOH
EtOH
H2O
EtOH
EtOH
EtOH
乙醇溶液
H2O
H2O
H2O
H2O
H2O
物质导电条件:自由移动带电荷的粒子
NaCl在水中的溶解和电离的示意图
电解质:在水溶液中或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下都不导电的化合物。
电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
电离:
物质
混合物
纯净物
化合物
单质
电解质
非电解质
酸、碱、盐、水
活泼金属氧化物
非金属氧化物
大部分有机物(乙醇、蔗糖)
既不是电解质也不是非电解质
电解质溶液
分析对错:铁丝和盐酸能导电,所以二者是电解质,液态硫酸不导电,所以硫酸是非电解质。
电解质溶液
不对。
因为电解质和非电解质都是化合物,而铁是单质,盐酸是混合物,故两者既不是电解质,也不是非电解质;
硫酸溶液能导电,硫酸是电解质。
判断一个物质是否是电解质的依据是什么?
在水溶液中或熔融状态下能导电。
电解质溶液
1、判断SO2、NH3是否是电解质?
2、电解质在水溶液中和熔融状态下都能导电?
3、化合物不是电解质就是非电解质?
4、固体氯化钠不导电,所以它不是电解质?
溶于水后能导电的是H2SO3、NH3·H2O,不是SO2、NH3本身,故H2SO3、NH3·H2O是电解质,SO2、NH3是非电解质。
不一定
对的
氯化钠在水溶液中或熔融状态下均能导电,是电解质。
强化巩固
下列物质:
①液态氯化氢 ②硫酸 ③熔融MgCl2 ④胆矾晶体
⑤食盐水 ⑥酒精 ⑦氨水 ⑧液氨 ⑨汞
⑩BaSO4 ⑾SO3 ⑿石墨
其中能导电的物质有 ,
属于电解质的是 ,
属于非电解质的是 。
③⑤⑦⑨⑿
①②③④⑩
⑥⑧⑾
电解质溶液
干燥的NaCl固体不导电
NaCl溶液和熔融的NaCl均能电离出自由移动的Na+和Cl-;
但干燥的NaCl固体不能
电离的表示——电离方程式
电解质溶液
用化学符号表示电解质电离成自由移动离子的过程。
NaCl = Na+ + Cl-
KNO3= K+ + NO3-
NaOH=Na+ + OH-
书写步骤:
①阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、
OH-、NH4+、CO32-等不能拆。
②构成物质的原子或原子团的个数在书写成离子时为化学计量数。
Al2(SO4)3==
2Al3++3SO42-
电解质溶液
书写注意事项
①式子左边书写化学式,表示电解质还未电离时的状态;
右边书写离子符号,表示电解质电离产生的离子。
②离子所带的电荷数应等于元素或原子团的化合价数。 ③电离方程式左右两边正负电荷之和相等
电解质溶液
从电离角度理解酸、碱、盐:
H+
OH-
电解质溶液
延时符
课堂小结
01
02
物质分散系
胶体及性质
03
电解质及非电解质及判断
04
电离方程式
课堂练习
C
1.下列叙述正确的是( )
A.直径介于1~100 nm之间的粒子称为胶体
B.用过滤的方法可以将胶体和溶液分离
C.利用丁达尔效应可以区别溶液与胶体
D.胶体区别于其他分散系的本质特征是丁达尔效应
课堂练习
2.现有下列物质:
①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩胆矾晶体
请用序号填空:
(1)上述状态下可导电的是__________。
(2)属于电解质的是_____________。
(3)属于非电解质的是______。
(4)上述状态下的电解质不能导电的是__________。
②④⑥⑨
①③⑦⑨⑩
⑤⑧
①③⑦⑩
