2023-2024学年高中化学苏教版2019必修第一册 2.2.2溶液组成的定量研究 课件(共21张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 2.2.2溶液组成的定量研究 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 12:53:37 | ||
图片预览







文档简介
(共21张PPT)
专题二第二单元
溶液组成的定量研究
02
一定物质的量浓度溶液的配置
40g NaOH 溶于 2L 水中配成溶液,其物质的量浓度为 0.5mol/L,对吗?
溶液的体积不等于溶剂水的体积。
配置溶液时,如何保证溶液的总体积?
容量瓶
温度
容积
50 mL、100 mL、250 mL、500 mL、1 000 mL
容量瓶
加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
使用前要检验容量瓶是否漏水。
容量瓶
为什么检查后要将瓶塞旋转 180°后再检查一次?
为防止容量瓶的瓶塞、瓶口内部不规则而造成误判。
容量瓶
容量瓶是配制一定物质的量浓度溶液的专用仪器。
使用容量瓶注意“五不”
不能溶解固体
不能稀释浓溶液
不能加热
不能做反应容器
不能长期贮存溶液
容量瓶
配制450 mL 0.1 mol·L-1的NaCl溶液,
需选择 。
500 mL容量瓶
配制500 mL 0.1 mol·L-1的NaCl溶液需要的玻璃仪器除烧杯、玻璃棒外,还需要的是________________。
书写容量瓶时一定要标明规格
500 mL容量瓶
选择容量瓶应遵循“大而近”的原则
所配溶液的体积等于或略小于容量瓶的容积。
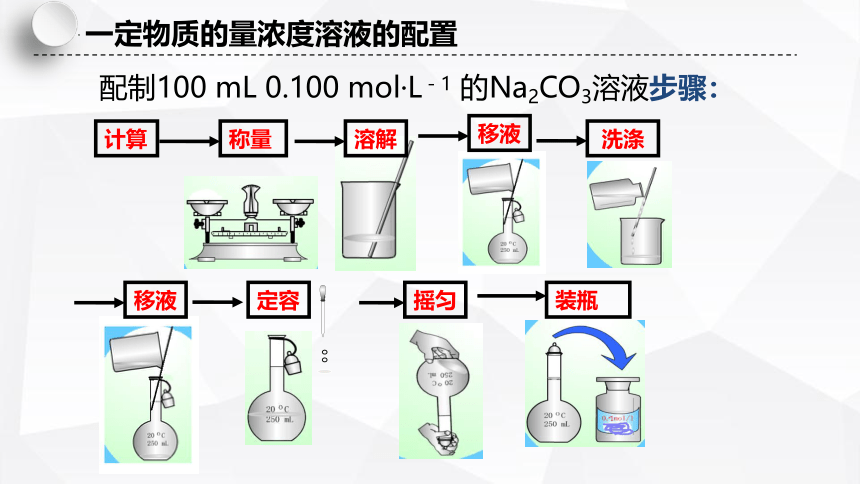
计算
溶解
洗涤
移液
定容
摇匀
移液
称量
装瓶
配制100 mL 0.100 mol·L-1 的Na2CO3溶液步骤:
一定物质的量浓度溶液的配置
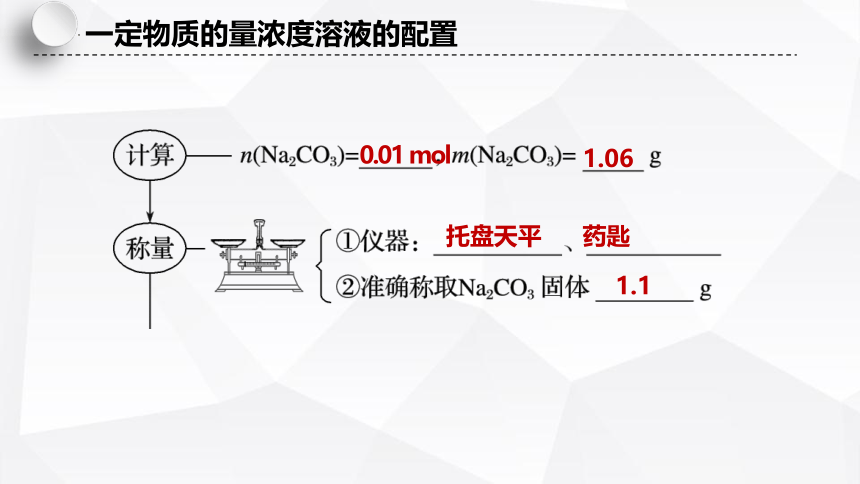
0.01 mol
1.06
托盘天平
药匙
1.1
一定物质的量浓度溶液的配置
玻璃棒
烧杯
一定物质的量浓度溶液的配置
稀释或溶解总有一定的热效应。容量瓶在使用前有一定的温度指数,只标明一定温度下的正确体
积(20℃,250mL),其含义是,只有当液体的温度与容量瓶上标出温度相同时,体积才是准确值。
100 mL容量瓶
玻璃棒
一定物质的量浓度溶液的配置
向容量瓶转移溶液或加入水,用玻璃棒引流并且玻璃棒的下端要靠在刻度线以下的内壁上,棒身要在瓶中央位置。
2~3
容量瓶
一定物质的量浓度溶液的配置
烧杯中的溶液转移到容量瓶后,烧杯的内壁上还沾有少量溶液,若不用蒸馏水洗涤烧杯,容量瓶中的溶质就会减少,即容量瓶内容质的物质的量减少,导致所配溶液中溶质的浓度会偏低。
1~2 cm
凹液面
与刻度线相切
一定物质的量浓度溶液的配置
若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?
重新配制!
一定物质的量浓度溶液的配置
定容后,反复振荡,液面低于刻度线,为什么?能否再加水?
振荡后液面低,是因为极少量溶液在润湿磨口处损耗了。刻度是以容纳量为依据,所以不再加水至刻度,否则,溶液浓度偏低。
一定物质的量浓度溶液的配置
误差分析:
n
V
c
m
MV
m、V决定误差大小
步骤 具体情况 产生的误差
称量 砝码生锈 _____
砝码残缺 _____
将砝码放在左盘且使用了游码 _____
量取液体溶质时量筒内有水 _____
偏大
偏小
偏小
偏小
称量 量取液体溶质时仰视量筒刻度读数 _____
吸湿性、挥发性药品长时间暴露在空气中 _____
把吸湿性药品(如NaOH)放在纸上称量 _____
偏大
偏小
偏小
一定物质的量浓度溶液的配置
溶解与洗涤 溶解搅拌时有溶液溅出 _____
转移时有溶液溅出瓶外 _____
未洗涤烧杯和玻璃棒 _____
除洗涤烧杯和玻璃棒外,还洗涤了量取浓溶液的量筒,并将洗涤液注入了容量瓶 _____
偏小
偏小
偏小
偏大
步骤 具体情况 产生的误差
定容 溶液未冷却就转入容量瓶 _____
定容时仰视容量瓶刻度线 _____
在定容之后再上下倒置摇匀,发现液面低于刻度线,再加水至刻度线 _____
在定容时不小心加水超过了标线,又用滴管把多余的液体吸出 _____
偏大
偏小
偏小
偏小
一定物质的量浓度溶液的配置
仰视、俯视对结果的影响
(1)仰视刻度线(如图a):加水量高于基准线(刻度线),溶液体积偏大,c偏小。
(2)俯视刻度线(如图b):加水量低于基准线(刻度线),溶液体积偏小,c偏大。
一定物质的量浓度溶液的配置
延时符
课堂小结
01
02
一定物质的量浓度溶液的配置步骤及误差分析
1、欲配制1.0 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
溶液沿 移入 mL的容量瓶中
②将称好的氢氧化钠固体放入 中,
加 的蒸馏水将其溶解,待 后将
10.0
烧杯
适量
冷却
玻璃棒
250
课堂练习
课堂练习
A
2、配制一定物质的量浓度的氢氧化钾溶液时,导致浓度偏小的原因可能是( )
A.用敞口容器称量氢氧化钾且时间过长
B.配制前先向容量瓶中加入少量蒸馏水
C.容量瓶盛过氢氧化钾溶液,使用前未洗涤
D.溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
专题二第二单元
溶液组成的定量研究
02
一定物质的量浓度溶液的配置
40g NaOH 溶于 2L 水中配成溶液,其物质的量浓度为 0.5mol/L,对吗?
溶液的体积不等于溶剂水的体积。
配置溶液时,如何保证溶液的总体积?
容量瓶
温度
容积
50 mL、100 mL、250 mL、500 mL、1 000 mL
容量瓶
加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
使用前要检验容量瓶是否漏水。
容量瓶
为什么检查后要将瓶塞旋转 180°后再检查一次?
为防止容量瓶的瓶塞、瓶口内部不规则而造成误判。
容量瓶
容量瓶是配制一定物质的量浓度溶液的专用仪器。
使用容量瓶注意“五不”
不能溶解固体
不能稀释浓溶液
不能加热
不能做反应容器
不能长期贮存溶液
容量瓶
配制450 mL 0.1 mol·L-1的NaCl溶液,
需选择 。
500 mL容量瓶
配制500 mL 0.1 mol·L-1的NaCl溶液需要的玻璃仪器除烧杯、玻璃棒外,还需要的是________________。
书写容量瓶时一定要标明规格
500 mL容量瓶
选择容量瓶应遵循“大而近”的原则
所配溶液的体积等于或略小于容量瓶的容积。
计算
溶解
洗涤
移液
定容
摇匀
移液
称量
装瓶
配制100 mL 0.100 mol·L-1 的Na2CO3溶液步骤:
一定物质的量浓度溶液的配置
0.01 mol
1.06
托盘天平
药匙
1.1
一定物质的量浓度溶液的配置
玻璃棒
烧杯
一定物质的量浓度溶液的配置
稀释或溶解总有一定的热效应。容量瓶在使用前有一定的温度指数,只标明一定温度下的正确体
积(20℃,250mL),其含义是,只有当液体的温度与容量瓶上标出温度相同时,体积才是准确值。
100 mL容量瓶
玻璃棒
一定物质的量浓度溶液的配置
向容量瓶转移溶液或加入水,用玻璃棒引流并且玻璃棒的下端要靠在刻度线以下的内壁上,棒身要在瓶中央位置。
2~3
容量瓶
一定物质的量浓度溶液的配置
烧杯中的溶液转移到容量瓶后,烧杯的内壁上还沾有少量溶液,若不用蒸馏水洗涤烧杯,容量瓶中的溶质就会减少,即容量瓶内容质的物质的量减少,导致所配溶液中溶质的浓度会偏低。
1~2 cm
凹液面
与刻度线相切
一定物质的量浓度溶液的配置
若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?
重新配制!
一定物质的量浓度溶液的配置
定容后,反复振荡,液面低于刻度线,为什么?能否再加水?
振荡后液面低,是因为极少量溶液在润湿磨口处损耗了。刻度是以容纳量为依据,所以不再加水至刻度,否则,溶液浓度偏低。
一定物质的量浓度溶液的配置
误差分析:
n
V
c
m
MV
m、V决定误差大小
步骤 具体情况 产生的误差
称量 砝码生锈 _____
砝码残缺 _____
将砝码放在左盘且使用了游码 _____
量取液体溶质时量筒内有水 _____
偏大
偏小
偏小
偏小
称量 量取液体溶质时仰视量筒刻度读数 _____
吸湿性、挥发性药品长时间暴露在空气中 _____
把吸湿性药品(如NaOH)放在纸上称量 _____
偏大
偏小
偏小
一定物质的量浓度溶液的配置
溶解与洗涤 溶解搅拌时有溶液溅出 _____
转移时有溶液溅出瓶外 _____
未洗涤烧杯和玻璃棒 _____
除洗涤烧杯和玻璃棒外,还洗涤了量取浓溶液的量筒,并将洗涤液注入了容量瓶 _____
偏小
偏小
偏小
偏大
步骤 具体情况 产生的误差
定容 溶液未冷却就转入容量瓶 _____
定容时仰视容量瓶刻度线 _____
在定容之后再上下倒置摇匀,发现液面低于刻度线,再加水至刻度线 _____
在定容时不小心加水超过了标线,又用滴管把多余的液体吸出 _____
偏大
偏小
偏小
偏小
一定物质的量浓度溶液的配置
仰视、俯视对结果的影响
(1)仰视刻度线(如图a):加水量高于基准线(刻度线),溶液体积偏大,c偏小。
(2)俯视刻度线(如图b):加水量低于基准线(刻度线),溶液体积偏小,c偏大。
一定物质的量浓度溶液的配置
延时符
课堂小结
01
02
一定物质的量浓度溶液的配置步骤及误差分析
1、欲配制1.0 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
溶液沿 移入 mL的容量瓶中
②将称好的氢氧化钠固体放入 中,
加 的蒸馏水将其溶解,待 后将
10.0
烧杯
适量
冷却
玻璃棒
250
课堂练习
课堂练习
A
2、配制一定物质的量浓度的氢氧化钾溶液时,导致浓度偏小的原因可能是( )
A.用敞口容器称量氢氧化钾且时间过长
B.配制前先向容量瓶中加入少量蒸馏水
C.容量瓶盛过氢氧化钾溶液,使用前未洗涤
D.溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
