2023-2024学年高中化学苏教版2019必修第一册 2.3.2人类对原子结构的认识 课件(共18张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 2.3.2人类对原子结构的认识 课件(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 12:56:48 | ||
图片预览




文档简介
(共18张PPT)
专题二第三单元
人类对原子结构的认识
02
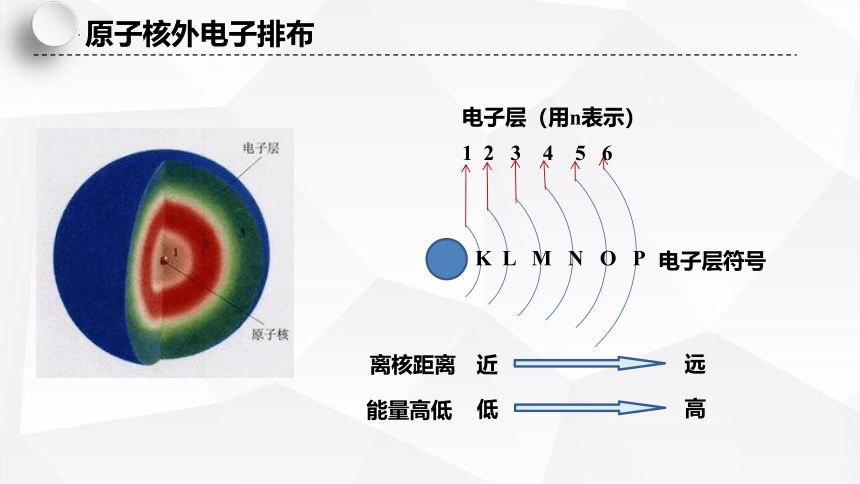
原子核外电子排布
K L M N O P
1 2 3 4 5 6
电子层(用n表示)
电子层符号
离核距离
能量高低
近
远
低
高
原子核外电子排布
原子核外电子排布
电子在原子核外排布时,总是尽量先排在能量最低的电子层,然后由内向外依次排布在能量较高的电子层。
能量规律
即电子最先排K层,当K层排满后,再排L层等
原子核外电子排布
数量规律
01
02
03
各电子层最多能容纳的电子数为2n2
最外电子层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)
次外电子层最多只能容纳18个电子
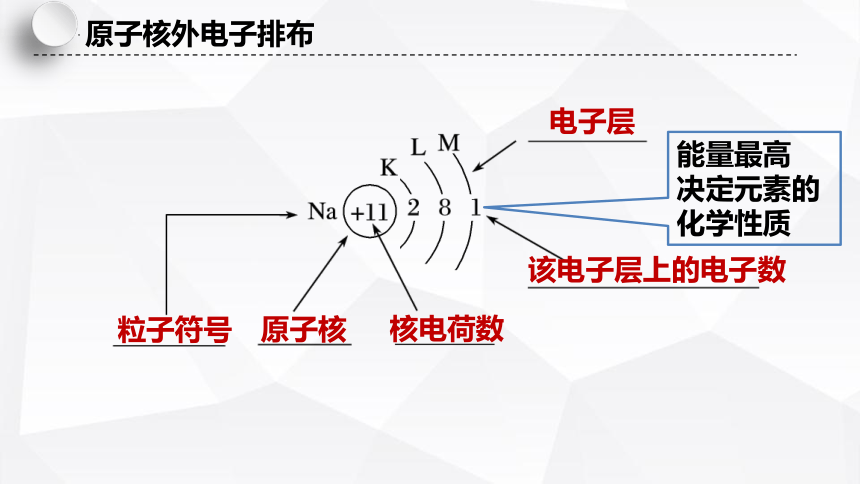
电子层
该电子层上的电子数
粒子符号
原子核
核电荷数
原子核外电子排布
能量最高
决定元素的化学性质
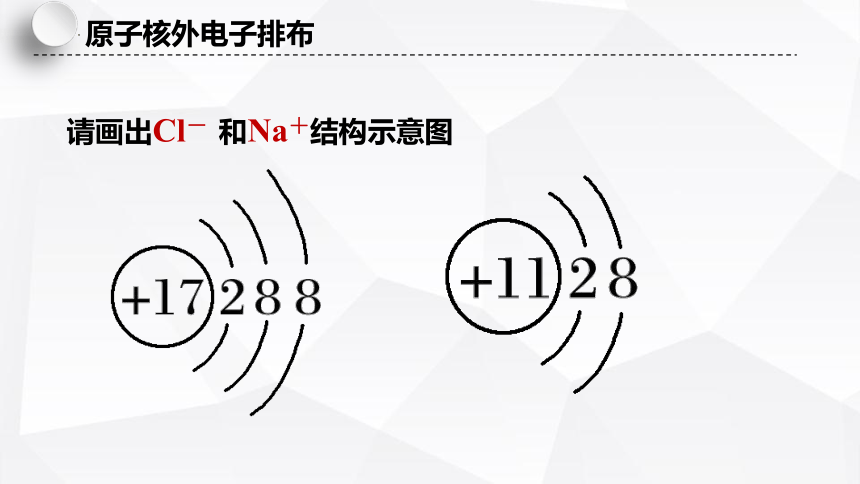
请画出Cl- 和Na+结构示意图
原子核外电子排布
原子核外电子排布
稀有气体元素原子电子层排布
元素名称 元素符号 各电子层的电子数
1 2 3 4 5 6 最外层电子数
氦 2He 2 2
氖 10Ne 2 8 8
氩 18Ar 2 8 8 8
氪 36Kr 2 8 18 8 8
氙 54Xe 2 8 18 18 8 8
氡 86Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布,结合其化学活动性,你发现了什么?
稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
原子核外电子排布
稳定结构
原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定。
(如He、Ne、Ar)
不稳定结构
(如易失电子的金属元素、易得电子的非金属元素)
在活泼金属单质与活泼非金属单质的反应中:
氧化镁的形成
原子核外电子排布
金属元素的原子失去电子,形成阳离子,在生成的化合物中呈现正化合价;非金属元素的原子得到电子,形成阴离子,在生成的化合物中呈现负化合价。
原子核外电子排布
元素的化学性质主要取决于原子的最外层电子排布,元素的化合价的数值也与原子的电子层结构特别是最外层电子数有关。
原子核外电子排布
1.金属元素原子最外层电子数一般 4,较易 电子,化合价常显_ _价,且正化合价=失电子数=最外层电子数。
2.非金属元素原子最外层电子数一般 4,通常
易 电子,化合价常显 价,且负化合价=-(得电子数)=最外层电子数-8。
小于
失去
正
大于或等于
得到
负
强化巩固
(1)电子层排布相同的是____。
(2)属于同种元素的是____。
(3)属于金属元素的是___。
(4)属于稀有气体元素的是__,稀有气体一般不参与化学反应的原因是
_____________________________________________________________
____________。
BC
AB
D
C
原子的最外电子层已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)写出D参加化学反应后所得离子的结构示意图_______。
10电子微粒
强化巩固
1.与OH-具有相同电子总数和质子总数的微粒是
A.K+ B.Na+ C.F- D.Ne
B
2.核外电子层结构相同的一组粒子是
A.Mg2+、Al3+、Cl-、Ar B.Na+、F-、S2-、Ne
C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、K+
C
延时符
课堂小结
01
02
原子核外电子排布
10电子微粒
课堂练习
C
A. B.
1.下列各原子结构示意图中所表示的核外电子排布正确的是
C. D.
课堂练习
2.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:___________。
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同的离子:______________。
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
专题二第三单元
人类对原子结构的认识
02
原子核外电子排布
K L M N O P
1 2 3 4 5 6
电子层(用n表示)
电子层符号
离核距离
能量高低
近
远
低
高
原子核外电子排布
原子核外电子排布
电子在原子核外排布时,总是尽量先排在能量最低的电子层,然后由内向外依次排布在能量较高的电子层。
能量规律
即电子最先排K层,当K层排满后,再排L层等
原子核外电子排布
数量规律
01
02
03
各电子层最多能容纳的电子数为2n2
最外电子层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)
次外电子层最多只能容纳18个电子
电子层
该电子层上的电子数
粒子符号
原子核
核电荷数
原子核外电子排布
能量最高
决定元素的化学性质
请画出Cl- 和Na+结构示意图
原子核外电子排布
原子核外电子排布
稀有气体元素原子电子层排布
元素名称 元素符号 各电子层的电子数
1 2 3 4 5 6 最外层电子数
氦 2He 2 2
氖 10Ne 2 8 8
氩 18Ar 2 8 8 8
氪 36Kr 2 8 18 8 8
氙 54Xe 2 8 18 18 8 8
氡 86Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布,结合其化学活动性,你发现了什么?
稀有气体元素原子中最外电子层都已经填满,形成了稳定的电子层结构。
原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
原子核外电子排布
稳定结构
原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定。
(如He、Ne、Ar)
不稳定结构
(如易失电子的金属元素、易得电子的非金属元素)
在活泼金属单质与活泼非金属单质的反应中:
氧化镁的形成
原子核外电子排布
金属元素的原子失去电子,形成阳离子,在生成的化合物中呈现正化合价;非金属元素的原子得到电子,形成阴离子,在生成的化合物中呈现负化合价。
原子核外电子排布
元素的化学性质主要取决于原子的最外层电子排布,元素的化合价的数值也与原子的电子层结构特别是最外层电子数有关。
原子核外电子排布
1.金属元素原子最外层电子数一般 4,较易 电子,化合价常显_ _价,且正化合价=失电子数=最外层电子数。
2.非金属元素原子最外层电子数一般 4,通常
易 电子,化合价常显 价,且负化合价=-(得电子数)=最外层电子数-8。
小于
失去
正
大于或等于
得到
负
强化巩固
(1)电子层排布相同的是____。
(2)属于同种元素的是____。
(3)属于金属元素的是___。
(4)属于稀有气体元素的是__,稀有气体一般不参与化学反应的原因是
_____________________________________________________________
____________。
BC
AB
D
C
原子的最外电子层已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)写出D参加化学反应后所得离子的结构示意图_______。
10电子微粒
强化巩固
1.与OH-具有相同电子总数和质子总数的微粒是
A.K+ B.Na+ C.F- D.Ne
B
2.核外电子层结构相同的一组粒子是
A.Mg2+、Al3+、Cl-、Ar B.Na+、F-、S2-、Ne
C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、K+
C
延时符
课堂小结
01
02
原子核外电子排布
10电子微粒
课堂练习
C
A. B.
1.下列各原子结构示意图中所表示的核外电子排布正确的是
C. D.
课堂练习
2.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:___________。
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同的离子:______________。
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
