2023-2024学年高中化学苏教版2019必修第一册 3.1.1氯气及氯的化合物 课件(共21张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 3.1.1氯气及氯的化合物 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 12:57:24 | ||
图片预览






文档简介
(共21张PPT)
专题三第一单元
氯气及氯的化合物
01
氯气的发现与制备
自来水消毒
光导纤维
塑料
漂白粉漂白液
氯气是重要的化工原料
氯气的发现
1774年,瑞典化学家舍勒把浓盐酸与软锰矿(主要成分是MnO2)混合在一起加热,意外地发现了一种具有强烈刺激性气味的黄绿色气体。1810年,英国化学家戴维仔细研究了这种黄绿色气体,并将其命名为氯气。
瑞典
化学家
舍勒
英国
化学家
戴维
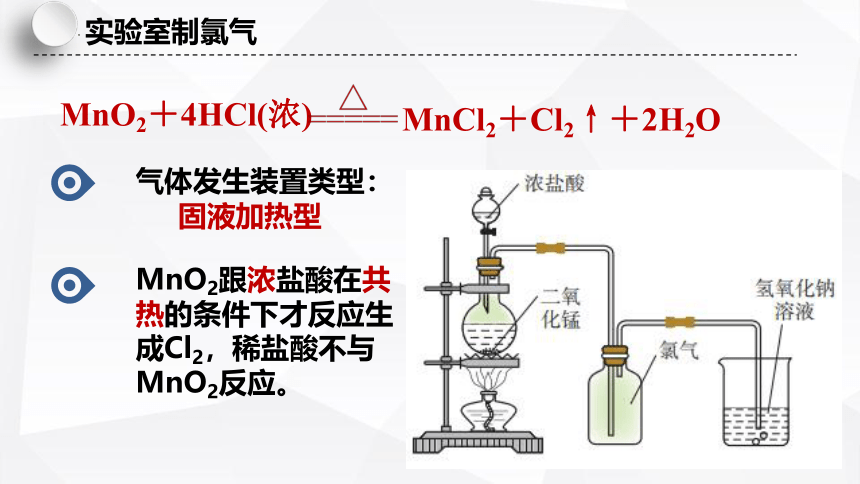
实验室制氯气
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
气体发生装置类型:
固液加热型
MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
实验室制氯气
收集方法: 向上排空气法
NaOH溶液作用:
氯气与空气不反应且密度比空气的大
吸收过量的氯气,防止污染环境
实验室制氯气
实验室制氯气
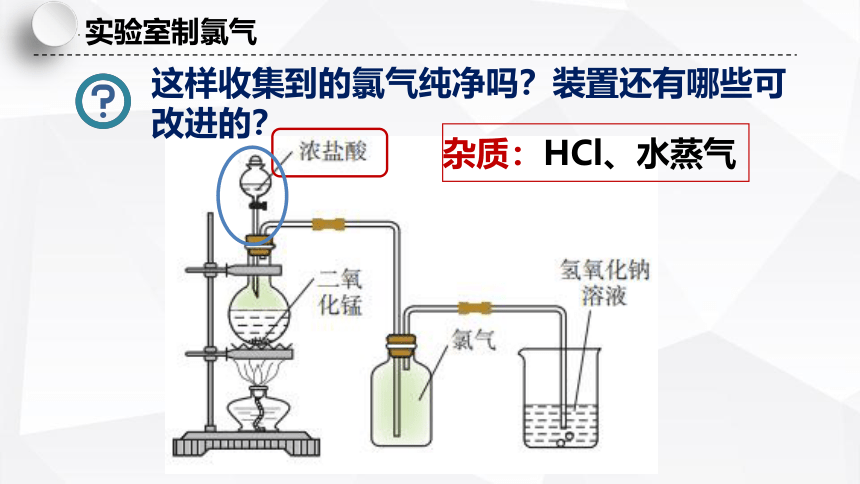
这样收集到的氯气纯净吗?装置还有哪些可改进的?
杂质:HCl、水蒸气
实验室制氯气
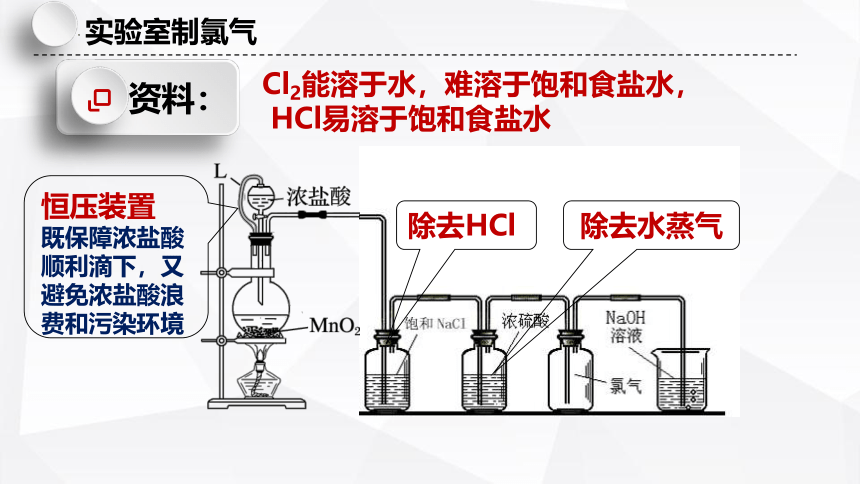
Cl2能溶于水,难溶于饱和食盐水,
HCl易溶于饱和食盐水
资料:
除去HCl
除去水蒸气
恒压装置
既保障浓盐酸顺利滴下,又避免浓盐酸浪费和污染环境
实验室制氯气
1
用分液漏斗装浓盐酸,让浓盐酸缓慢地注入,不能一次将浓盐酸注入烧瓶里。
注意事项:
用分液漏斗可以控制液体的用量,避免生成的氯气过多。
缓慢注入可提高浓盐酸利用率。
实验室制氯气
2
用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热。
注意事项:
浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量的杂质;另一方面,又降低了HCl的利用率。
实验室制氯气
若MnO2过量,待充分反应后,溶液中仍有盐酸剩余,为什么?
随着反应的进行,浓盐酸的浓度逐渐减小,小到一定浓度将不再与MnO2反应。
强化巩固
如果将过量的二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要的原因有
①______________________________________________________;
②___________________________。
反应中随着HCl的消耗,盐酸变稀,稀盐酸不能与MnO2反应
加热时有部分HCl挥发而损失
使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低。
工业制氯气
工业上对氯气的需求量很大。大量生产氯气不仅要求原料易得,而且价格也是必须考虑的重要因素。
工业制氯气
海水中蕴含丰富的氯元素,它主要以氯化钠、氯化镁等氯化物的形式存在。
氯气性质活泼,氯元素在自然界没有游离态,只以化合态形式存在。
单质
化合物
工业制氯气
工业制氯气
无色气体,靠近火焰有爆鸣声
黄绿色气体,能使湿润的淀粉碘化钾试纸变蓝
溶液加入酚酞变红色
NaOH溶液
H2
Cl2
工业制取氯气的反应原理:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
氯碱工业:
以电解饱和食盐水为基础制取氯气等产品的工业。
工业制氯气
延时符
课堂小结
01
02
氯气的实验室制备
氯气的工业制取
课堂练习
1.如图表示在没有通风橱时制取纯净的氯气设计
的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是___________,其作用
是_____________,水槽中盛放的液体是__________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应____________;当氯气纯度合乎要求时,应_____________;当氯气收集完毕时,应__________________。
NaOH溶液
吸收多余的Cl2
饱和食盐水
打开B夹,
关闭A夹
打开A夹,关闭B夹
打开B夹,关闭A夹
课堂练习
2.某实验兴趣小组利用如图所示装置进行电解饱和
食盐水并检验其生成物的实验,当图中开关K闭合
片刻后,请回答下列问题:
(1)电解饱和食盐水的化学方程式为___
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
_________________________。
(2)a为电源的___(填“正”或“负”)极;D中收集的气体是______。
(3)C试管盛放______ _溶液。溶液中A电极附近的现象为___________________。
负
氢气(或H2)
淀粉碘化钾(或淀粉碘化钠等
有气泡产生,溶液由无色变为红色
专题三第一单元
氯气及氯的化合物
01
氯气的发现与制备
自来水消毒
光导纤维
塑料
漂白粉漂白液
氯气是重要的化工原料
氯气的发现
1774年,瑞典化学家舍勒把浓盐酸与软锰矿(主要成分是MnO2)混合在一起加热,意外地发现了一种具有强烈刺激性气味的黄绿色气体。1810年,英国化学家戴维仔细研究了这种黄绿色气体,并将其命名为氯气。
瑞典
化学家
舍勒
英国
化学家
戴维
实验室制氯气
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
气体发生装置类型:
固液加热型
MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
实验室制氯气
收集方法: 向上排空气法
NaOH溶液作用:
氯气与空气不反应且密度比空气的大
吸收过量的氯气,防止污染环境
实验室制氯气
实验室制氯气
这样收集到的氯气纯净吗?装置还有哪些可改进的?
杂质:HCl、水蒸气
实验室制氯气
Cl2能溶于水,难溶于饱和食盐水,
HCl易溶于饱和食盐水
资料:
除去HCl
除去水蒸气
恒压装置
既保障浓盐酸顺利滴下,又避免浓盐酸浪费和污染环境
实验室制氯气
1
用分液漏斗装浓盐酸,让浓盐酸缓慢地注入,不能一次将浓盐酸注入烧瓶里。
注意事项:
用分液漏斗可以控制液体的用量,避免生成的氯气过多。
缓慢注入可提高浓盐酸利用率。
实验室制氯气
2
用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热。
注意事项:
浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量的杂质;另一方面,又降低了HCl的利用率。
实验室制氯气
若MnO2过量,待充分反应后,溶液中仍有盐酸剩余,为什么?
随着反应的进行,浓盐酸的浓度逐渐减小,小到一定浓度将不再与MnO2反应。
强化巩固
如果将过量的二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要的原因有
①______________________________________________________;
②___________________________。
反应中随着HCl的消耗,盐酸变稀,稀盐酸不能与MnO2反应
加热时有部分HCl挥发而损失
使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低。
工业制氯气
工业上对氯气的需求量很大。大量生产氯气不仅要求原料易得,而且价格也是必须考虑的重要因素。
工业制氯气
海水中蕴含丰富的氯元素,它主要以氯化钠、氯化镁等氯化物的形式存在。
氯气性质活泼,氯元素在自然界没有游离态,只以化合态形式存在。
单质
化合物
工业制氯气
工业制氯气
无色气体,靠近火焰有爆鸣声
黄绿色气体,能使湿润的淀粉碘化钾试纸变蓝
溶液加入酚酞变红色
NaOH溶液
H2
Cl2
工业制取氯气的反应原理:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
氯碱工业:
以电解饱和食盐水为基础制取氯气等产品的工业。
工业制氯气
延时符
课堂小结
01
02
氯气的实验室制备
氯气的工业制取
课堂练习
1.如图表示在没有通风橱时制取纯净的氯气设计
的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是___________,其作用
是_____________,水槽中盛放的液体是__________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应____________;当氯气纯度合乎要求时,应_____________;当氯气收集完毕时,应__________________。
NaOH溶液
吸收多余的Cl2
饱和食盐水
打开B夹,
关闭A夹
打开A夹,关闭B夹
打开B夹,关闭A夹
课堂练习
2.某实验兴趣小组利用如图所示装置进行电解饱和
食盐水并检验其生成物的实验,当图中开关K闭合
片刻后,请回答下列问题:
(1)电解饱和食盐水的化学方程式为___
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
_________________________。
(2)a为电源的___(填“正”或“负”)极;D中收集的气体是______。
(3)C试管盛放______ _溶液。溶液中A电极附近的现象为___________________。
负
氢气(或H2)
淀粉碘化钾(或淀粉碘化钠等
有气泡产生,溶液由无色变为红色
