2023-2024学年高中化学苏教版2019必修第一册 3.1.3 氧化还原反应 课件(共22张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 3.1.3 氧化还原反应 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 12:59:11 | ||
图片预览





文档简介
(共22张PPT)
专题三第一单元
氯气及氯的化合物
03
氧化还原反应
举例说明什么是氧化反应,什么是还原反应?
物质得氧的反应
氧化反应
物质失氧的反应
还原反应
C+O2 CO2
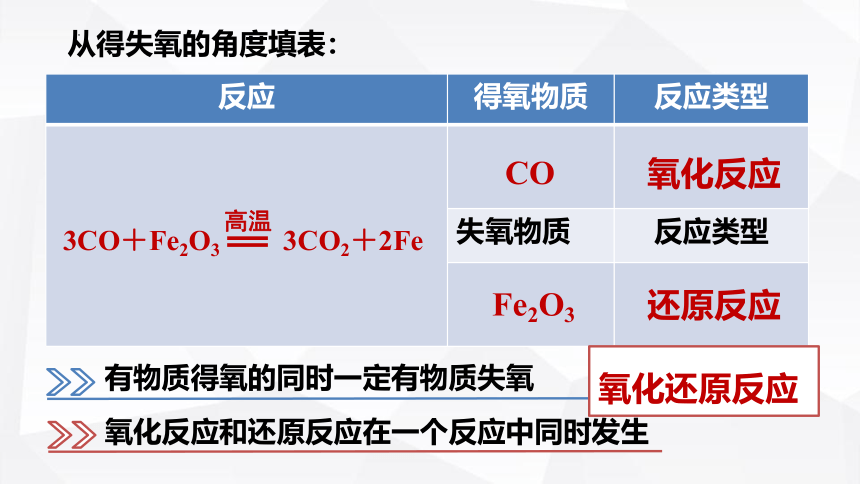
3CO+Fe2O3 3CO2+2Fe
高温
反应 得氧物质 反应类型
失氧物质 反应类型
3CO+Fe2O3 3CO2+2Fe
高温
还原反应
CO
Fe2O3
氧化反应
从得失氧的角度填表:
有物质得氧的同时一定有物质失氧
氧化反应和还原反应在一个反应中同时发生
氧化还原反应
氧化还原反应
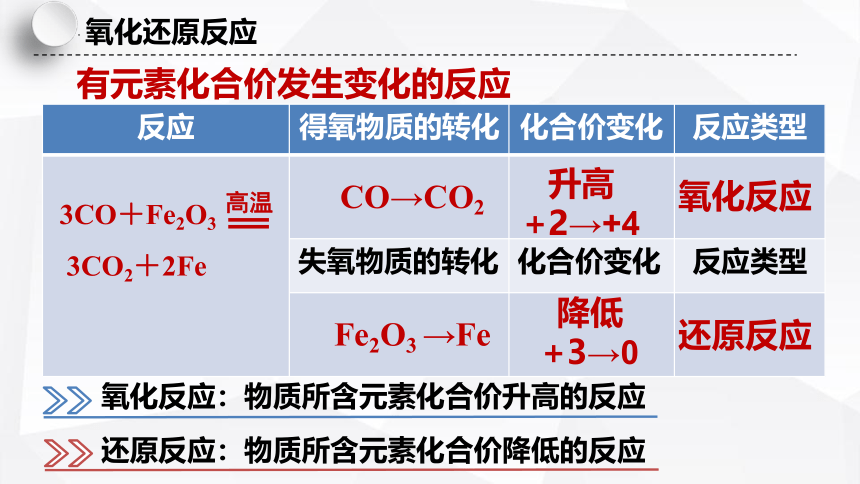
有元素化合价发生变化的反应
反应 得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
3CO+Fe2O3
3CO2+2Fe
高温
还原反应
CO→CO2
Fe2O3 →Fe
氧化反应
升高
+2→+4
降低
+3→0
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
强化巩固
判断下列过程是氧化反应还是还原反应:
(1)Cu→CuO ( )
(2)Cu→CuCl2 ( )
(3)N2→NH3 ( )
(4)FeCl2→FeCl3 ( )
氧化反应
还原反应
氧化反应
氧化反应
氧化还原反应
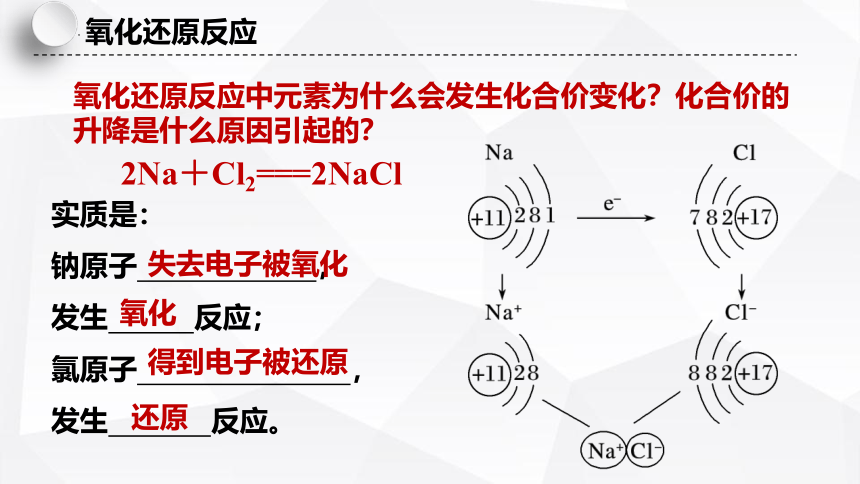
氧化还原反应中元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
2Na+Cl2===2NaCl
实质是:
钠原子 ,
发生 反应;
氯原子 ,
发生 反应。
失去电子被氧化
氧化
得到电子被还原
还原
氧化还原反应
氧化还原反应中元素化合价发生变化的实质
电子发生转移
氧化还原反应得失电子的表示方法
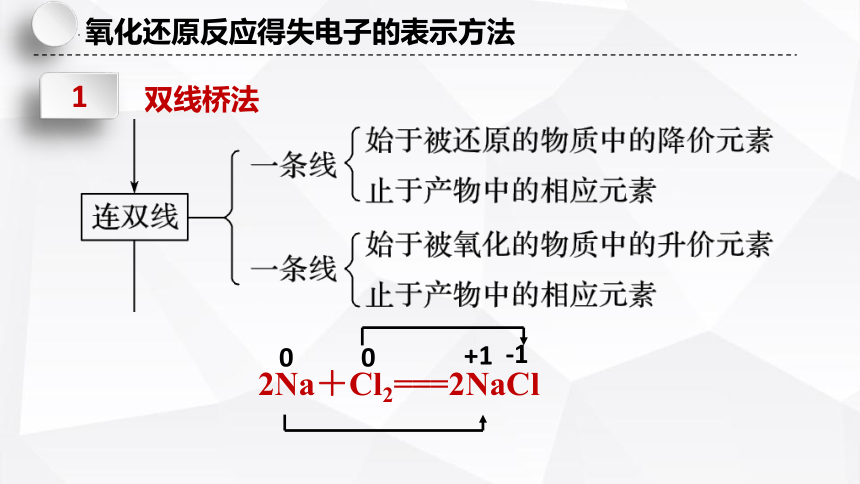
表示同种元素的原子在反应前后转移电子的情况。
1
双线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
1
双线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
1
双线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
反应中每个Na原子失去1个电子,一共有2个Na原子失电子,表示为失去2×e-
反应中每个Cl原子得到1个电子,一共有2个Cl原子得电子,表示为得到2×e-
得到 2 ×e-
失去 2 ×e-
氧化还原反应得失电子的表示方法
1
双线桥法
得失电子要用m×ne-的形式进行表示,其中
m代表发生电子得失的原子个数,
n代表每个原子得失的电子数(当m或n为1时要省略)
-1
+1
0
2Na+Cl2===2NaCl
0
得到 2 ×e-
失去 2 ×e-
反应中失去电子的总数等于得到电子的总数
强化巩固
3CO+Fe2O3 3CO2+2Fe
高温
用双线桥法表示下列反应的电子转移情况
2Al+3H2SO4=Al2(SO4)3 +3H2↑
氧化还原反应得失电子的表示方法
3CO+Fe2O3 3CO2+2Fe
高温
+2
+3
+4
0
得到 2 ×3e-
失去 3 ×2e-
2Al+3H2SO4=Al2(SO4)3 +3H2↑
0 +1 +3 0
失去2 ×3e-
得到3 ×2e-
氧化还原反应得失电子的表示方法
表示不同种元素的原子在反应前后转移电子的情况。
2
单线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
2
单线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
2
单线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
2e-
箭头已标明电子转移的方向,因此不需再标明“得”或“失”,只标明电子转移数目。
氧化还原反应得失电子的表示方法
3CO+Fe2O3 3CO2+2Fe
高温
+2
+3
+4
0
6e-
2Al+3H2SO4=Al2(SO4)3 +3H2↑
0 +1 +3 0
6e-
用单线桥法表示下列反应的电子转移情况
强化巩固
用单线桥法表示下列反应的电子转移情况
强化巩固
延时符
课堂小结
01
02
氧化还原反应
氧化反应
还原反应
得失电子的表示方法
双线桥法
单线桥法
课堂练习
1.下列反应中,氯元素失去电子的是( )
C
课堂练习
2.下列化学反应中电子转移的表示方法正确的是( )
C
专题三第一单元
氯气及氯的化合物
03
氧化还原反应
举例说明什么是氧化反应,什么是还原反应?
物质得氧的反应
氧化反应
物质失氧的反应
还原反应
C+O2 CO2
3CO+Fe2O3 3CO2+2Fe
高温
反应 得氧物质 反应类型
失氧物质 反应类型
3CO+Fe2O3 3CO2+2Fe
高温
还原反应
CO
Fe2O3
氧化反应
从得失氧的角度填表:
有物质得氧的同时一定有物质失氧
氧化反应和还原反应在一个反应中同时发生
氧化还原反应
氧化还原反应
有元素化合价发生变化的反应
反应 得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
3CO+Fe2O3
3CO2+2Fe
高温
还原反应
CO→CO2
Fe2O3 →Fe
氧化反应
升高
+2→+4
降低
+3→0
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
强化巩固
判断下列过程是氧化反应还是还原反应:
(1)Cu→CuO ( )
(2)Cu→CuCl2 ( )
(3)N2→NH3 ( )
(4)FeCl2→FeCl3 ( )
氧化反应
还原反应
氧化反应
氧化反应
氧化还原反应
氧化还原反应中元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
2Na+Cl2===2NaCl
实质是:
钠原子 ,
发生 反应;
氯原子 ,
发生 反应。
失去电子被氧化
氧化
得到电子被还原
还原
氧化还原反应
氧化还原反应中元素化合价发生变化的实质
电子发生转移
氧化还原反应得失电子的表示方法
表示同种元素的原子在反应前后转移电子的情况。
1
双线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
1
双线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
1
双线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
反应中每个Na原子失去1个电子,一共有2个Na原子失电子,表示为失去2×e-
反应中每个Cl原子得到1个电子,一共有2个Cl原子得电子,表示为得到2×e-
得到 2 ×e-
失去 2 ×e-
氧化还原反应得失电子的表示方法
1
双线桥法
得失电子要用m×ne-的形式进行表示,其中
m代表发生电子得失的原子个数,
n代表每个原子得失的电子数(当m或n为1时要省略)
-1
+1
0
2Na+Cl2===2NaCl
0
得到 2 ×e-
失去 2 ×e-
反应中失去电子的总数等于得到电子的总数
强化巩固
3CO+Fe2O3 3CO2+2Fe
高温
用双线桥法表示下列反应的电子转移情况
2Al+3H2SO4=Al2(SO4)3 +3H2↑
氧化还原反应得失电子的表示方法
3CO+Fe2O3 3CO2+2Fe
高温
+2
+3
+4
0
得到 2 ×3e-
失去 3 ×2e-
2Al+3H2SO4=Al2(SO4)3 +3H2↑
0 +1 +3 0
失去2 ×3e-
得到3 ×2e-
氧化还原反应得失电子的表示方法
表示不同种元素的原子在反应前后转移电子的情况。
2
单线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
2
单线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
氧化还原反应得失电子的表示方法
2
单线桥法
-1
+1
0
2Na+Cl2===2NaCl
0
2e-
箭头已标明电子转移的方向,因此不需再标明“得”或“失”,只标明电子转移数目。
氧化还原反应得失电子的表示方法
3CO+Fe2O3 3CO2+2Fe
高温
+2
+3
+4
0
6e-
2Al+3H2SO4=Al2(SO4)3 +3H2↑
0 +1 +3 0
6e-
用单线桥法表示下列反应的电子转移情况
强化巩固
用单线桥法表示下列反应的电子转移情况
强化巩固
延时符
课堂小结
01
02
氧化还原反应
氧化反应
还原反应
得失电子的表示方法
双线桥法
单线桥法
课堂练习
1.下列反应中,氯元素失去电子的是( )
C
课堂练习
2.下列化学反应中电子转移的表示方法正确的是( )
C
