2023-2024学年高中化学苏教版2019必修第一册 3.1.4 氧化剂还原剂 课件(共21张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 3.1.4 氧化剂还原剂 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 938.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 13:00:20 | ||
图片预览








文档简介
(共21张PPT)
专题三第一单元
氯气及氯的化合物
04
氧化剂 还原剂
氧化剂 还原剂
氧化剂:所含元素得到电子(化合价降低)的反应物。
还原剂:所含元素失去电子(化合价升高)的反应物。
氧化剂
还原剂
口诀:氧价降
氧化剂 还原剂
①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②.氧化剂本身被还原,化合价降低,发生还原反应
③.还原剂本身被氧化,化合价升高,发生氧化反应
注意
2Na+Cl2===2NaCl
氧化剂
还原剂
-1
+1
0
0
强化巩固
氧化剂是_____,还原剂是_____;
发生氧化反应的是_____,发生还原反应的是_____。
Cl2
Cl2
Fe
Fe
-1
+3
0
0
氧化剂 还原剂
①活泼性较强的非金属单质:如 、O2等。
②变价元素的高价态化合物:如 、 、 等。
③过氧化物:如 、 等。
④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
Cl2
KMnO4
FeCl3
HNO3
Na2O2
H2O2
常见的氧化剂
氧化剂 还原剂
常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如 、 、 等。
③含有较低价态元素的化合物:如 、 等。
④其他:如浓盐酸、NH3等。
H2
S
C
CO
SO2
-1
+1
0
氧化产物 还原产物
以下反应的氧化剂和还原剂是什么?
Cl2 + H2O = HCl + HClO
在反应中,氧化剂和还原剂可以是同一物质
氧化剂
还原剂
氧化产物 还原产物
氧化产物:还原剂失去电子被氧化的产物
还原产物:氧化剂得到电子被还原的产物
2HCl+Fe =FeCl2+H2↑
氧化剂
还原剂
氧化产物
还原产物
(元素化合价升高)生成物
(元素化合价降低)生成物
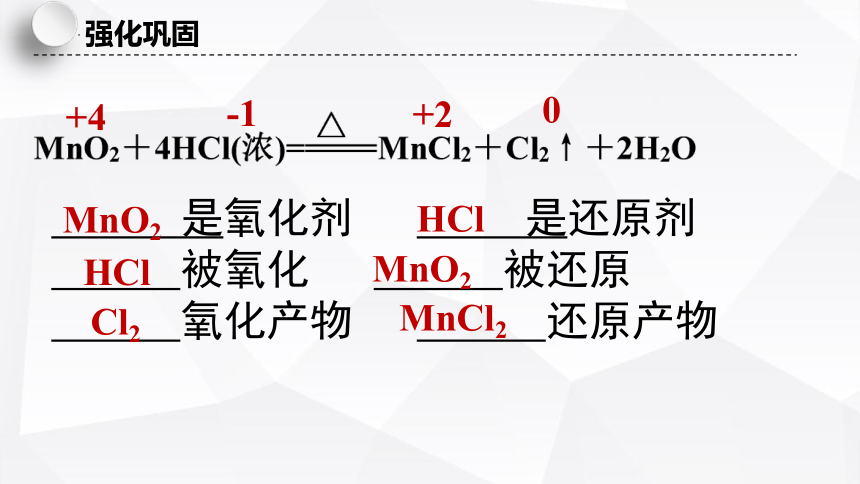
强化巩固
是氧化剂 是还原剂
被氧化 被还原
氧化产物 还原产物
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
0
2Na+Cl2===2NaCl
氧化剂
还原剂
-1
+1
0
0
氧化产物 还原产物
以下反应的氧化产物和还原产物是什么?
在反应中,氧化产物和还原产物可以是同一物质
氧化产物
还原产物
氧化还原反应
氧化剂+还原剂=氧化产物+还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化,发生氧化反应
降得还原氧化剂 升失氧化还原剂
口诀
氧化还原反应
判断以下反应的氧化剂、还原剂、氧化产物和还原产物
2KMnO4 K2MnO4+MnO2+O2↑
氧化剂
还原剂
氧化产物
还原产物
反应中某些物质没有“身份”
氧化剂
还原剂
0
+2
-1
+4
0
+6
+7
-2
+4
氧化产物
还原产物
还原产物
反应中某些物质“身份”相同
氧化性 还原性
氧化剂具有氧化性
氧化性:物质得电子的性质或能力
还原性:物质失电子的性质或能力
即化合价降低的能力
即化合价升高的能力
还原剂具有还原性
物质的氧化性及还原性与核心元素化合价的关系
氧化性
氧化性
还原性
还原性
核心元素化合价 实例 性质
最高价 只有_______
中间价 既有_______
又有_______
最低价 只有_______
氧化性 还原性
氧化性 还原性
还原性:还原剂 还原产物;
氧化性:氧化剂 氧化产物。
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
强弱规律
>
>
即“强制弱”或“前强后弱”
金属还原性:Fe Cu
>
氧化性 还原性
Fe+CuSO4===FeSO4+Cu
氧化剂
还原剂
氧化产物
还原产物
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数。
元素化合价降低的总数=元素化合价升高的总数。
应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
氧化还原反应规律及应用
守恒规律
8
3
2
3
4
1
5
3
3
3
3
____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+__H2O
____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
氧化还原反应规律及应用
配平以下方程式
延时符
课堂小结
01
02
氧化剂
还原剂
氧化产物
还原产物
03
氧化性
还原性
课堂练习
B
1.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.3NO2+H2O===2HNO3+NO
C.2F2+2H2O===4HF+O2
D.2Na+2H2O===2NaOH+H2↑
课堂练习
2、下列变化过程一定需要加入还原剂的是
A.KClO3―→ KCl
B.KCl―→ AgCl
C.H+―→ H2
D.C―→ CO2
C
专题三第一单元
氯气及氯的化合物
04
氧化剂 还原剂
氧化剂 还原剂
氧化剂:所含元素得到电子(化合价降低)的反应物。
还原剂:所含元素失去电子(化合价升高)的反应物。
氧化剂
还原剂
口诀:氧价降
氧化剂 还原剂
①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②.氧化剂本身被还原,化合价降低,发生还原反应
③.还原剂本身被氧化,化合价升高,发生氧化反应
注意
2Na+Cl2===2NaCl
氧化剂
还原剂
-1
+1
0
0
强化巩固
氧化剂是_____,还原剂是_____;
发生氧化反应的是_____,发生还原反应的是_____。
Cl2
Cl2
Fe
Fe
-1
+3
0
0
氧化剂 还原剂
①活泼性较强的非金属单质:如 、O2等。
②变价元素的高价态化合物:如 、 、 等。
③过氧化物:如 、 等。
④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
Cl2
KMnO4
FeCl3
HNO3
Na2O2
H2O2
常见的氧化剂
氧化剂 还原剂
常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如 、 、 等。
③含有较低价态元素的化合物:如 、 等。
④其他:如浓盐酸、NH3等。
H2
S
C
CO
SO2
-1
+1
0
氧化产物 还原产物
以下反应的氧化剂和还原剂是什么?
Cl2 + H2O = HCl + HClO
在反应中,氧化剂和还原剂可以是同一物质
氧化剂
还原剂
氧化产物 还原产物
氧化产物:还原剂失去电子被氧化的产物
还原产物:氧化剂得到电子被还原的产物
2HCl+Fe =FeCl2+H2↑
氧化剂
还原剂
氧化产物
还原产物
(元素化合价升高)生成物
(元素化合价降低)生成物
强化巩固
是氧化剂 是还原剂
被氧化 被还原
氧化产物 还原产物
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
0
2Na+Cl2===2NaCl
氧化剂
还原剂
-1
+1
0
0
氧化产物 还原产物
以下反应的氧化产物和还原产物是什么?
在反应中,氧化产物和还原产物可以是同一物质
氧化产物
还原产物
氧化还原反应
氧化剂+还原剂=氧化产物+还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化,发生氧化反应
降得还原氧化剂 升失氧化还原剂
口诀
氧化还原反应
判断以下反应的氧化剂、还原剂、氧化产物和还原产物
2KMnO4 K2MnO4+MnO2+O2↑
氧化剂
还原剂
氧化产物
还原产物
反应中某些物质没有“身份”
氧化剂
还原剂
0
+2
-1
+4
0
+6
+7
-2
+4
氧化产物
还原产物
还原产物
反应中某些物质“身份”相同
氧化性 还原性
氧化剂具有氧化性
氧化性:物质得电子的性质或能力
还原性:物质失电子的性质或能力
即化合价降低的能力
即化合价升高的能力
还原剂具有还原性
物质的氧化性及还原性与核心元素化合价的关系
氧化性
氧化性
还原性
还原性
核心元素化合价 实例 性质
最高价 只有_______
中间价 既有_______
又有_______
最低价 只有_______
氧化性 还原性
氧化性 还原性
还原性:还原剂 还原产物;
氧化性:氧化剂 氧化产物。
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
强弱规律
>
>
即“强制弱”或“前强后弱”
金属还原性:Fe Cu
>
氧化性 还原性
Fe+CuSO4===FeSO4+Cu
氧化剂
还原剂
氧化产物
还原产物
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数。
元素化合价降低的总数=元素化合价升高的总数。
应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
氧化还原反应规律及应用
守恒规律
8
3
2
3
4
1
5
3
3
3
3
____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+__H2O
____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
氧化还原反应规律及应用
配平以下方程式
延时符
课堂小结
01
02
氧化剂
还原剂
氧化产物
还原产物
03
氧化性
还原性
课堂练习
B
1.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O===H2SO4
B.3NO2+H2O===2HNO3+NO
C.2F2+2H2O===4HF+O2
D.2Na+2H2O===2NaOH+H2↑
课堂练习
2、下列变化过程一定需要加入还原剂的是
A.KClO3―→ KCl
B.KCl―→ AgCl
C.H+―→ H2
D.C―→ CO2
C
