2023-2024学年高中化学苏教版2019必修第一册 3.2.2金属钠及钠的化合物-碳酸钠 碳酸氢钠 课件(共22张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 3.2.2金属钠及钠的化合物-碳酸钠 碳酸氢钠 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 48.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 13:04:07 | ||
图片预览







文档简介
(共22张PPT)
专题三第二单元
金属钠及钠的化合物
02
碳酸钠 碳酸氢钠
食用纯碱的用途
食用小苏打的用途
碳酸钠 碳酸氢钠
Na2CO3
NaHCO3
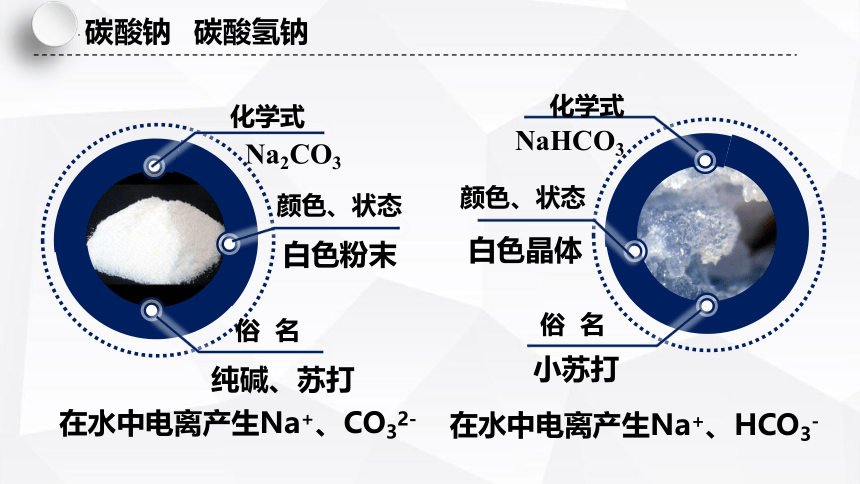
碳酸钠 碳酸氢钠
化学式
Na2CO3
俗 名
纯碱、苏打
颜色、状态
白色粉末
化学式
NaHCO3
俗 名
小苏打
颜色、状态
白色晶体
在水中电离产生Na+、CO32-
在水中电离产生Na+、HCO3-
碳酸钠 碳酸氢钠
探究实验
1、溶解性比较
操作:
分别取1g Na2CO3和NaHCO3于两支试管中,加5mL水,观察溶解情况。
碳酸钠 碳酸氢钠
探究实验
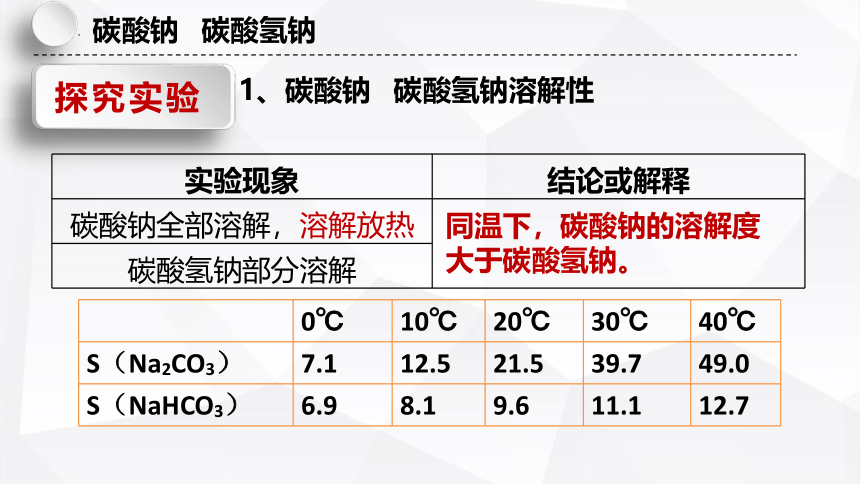
1、碳酸钠 碳酸氢钠溶解性
实验现象 结论或解释
碳酸钠全部溶解,溶解放热
碳酸氢钠部分溶解
同温下,碳酸钠的溶解度大于碳酸氢钠。
0℃ 10℃ 20℃ 30℃ 40℃
S(Na2CO3) 7.1 12.5 21.5 39.7 49.0
S(NaHCO3) 6.9 8.1 9.6 11.1 12.7
碳酸钠 碳酸氢钠
探究实验
2、水溶液碱性比较
操作:分别蘸取碳酸钠溶液和碳酸氢钠溶液,滴在酚酞试纸上,观察变色情况。
碳酸钠 碳酸氢钠
探究实验
2、水溶液碱性比较
实验现象 结论或解释
滴有碳酸钠溶液的酚酞试纸颜色比碳酸氢钠溶液深
等浓度时,碳酸钠的碱性强于碳酸氢钠。
碳酸钠 碳酸氢钠
探究实验
3、与石灰水
操作:在两支洁净的试管中加入澄清石灰水,然后分别向试管内滴加碳酸钠和碳酸氢钠溶液, 观察现象。
现象:
结论及原理:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
氢氧化钙少量时:2NaHCO3+Ca(OH) 2 =Na2CO3+CaCO3↓+2H2O
氢氧化钙过量时:NaHCO3+Ca(OH) 2 =NaOH+CaCO3↓+H2O
两支试管中均有白色沉淀生成
碳酸钠 碳酸氢钠
探究实验
4、与盐酸
操作:在两支洁净的试管中分别加入碳酸钠和碳酸氢钠溶液, 然后向试管内滴加盐酸,观察现象。
碳酸钠 碳酸氢钠
探究实验
4、与盐酸
现象:
结论及原理:
缓慢滴加盐酸,碳酸钠先没有明显现象,后出现气泡。碳酸氢钠则会立即产生气泡。
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+CO2↑+H2O
碳酸钠 碳酸氢钠
探究实验
5、热稳定性比较
操作:在两支洁净的试管中分别加入碳酸钠和碳酸氢钠, 分别加热,观察现象。
Na2CO3固体
NaHCO3固体
2NaHCO3 Na2CO3+H2O+CO2↑
△
碳酸钠 碳酸氢钠
探究实验
5、热稳定性比较
现象:
结论及原理:
NaHCO3受热产生能使澄清石灰水变浑浊的气体,而Na2CO3不能
热稳定性:Na2CO3>NaHCO3
碳酸钠和碳酸氢钠的鉴别方法
Na2CO3和NaHCO3的鉴别
分组讨论
比较同浓度Na2CO3和NaHCO3溶液的碱性,碱性强的为Na2CO3,弱的为NaHCO3
比较碱性法
2NaHCO3 Na2CO3+H2O+CO2↑
热分解法
△
与同浓度的酸反应NaHCO3比Na2CO3更剧烈
气体法
碳酸钠和碳酸氢钠如何相关转化?
分组讨论
Na2CO3 NaHCO3
①加热
①加 HCl
②加CO2+H2O
②加OH-
日常生活中,用热的纯碱溶液去除物品表面的油污。工业上,是一种重要的化工原料,广泛应用于食品、纺织、造纸、制皂、玻璃生产等。除此之外,也是医疗常用药物。
Na2CO3的用途
1、焙制糕点所用的发酵粉主要成分之一
2、用作食用碱
3、制干粉灭火剂
4、在医疗上,是治疗胃酸过多的一种药剂
NaHCO3的用途
科学史话
化学巨擘 永世楷模——侯德榜
侯氏制碱法
我国化学家侯德榜发现了氨碱法生产的不足之处,并于1943年提出了著名的侯氏制碱法(又称联合制碱法),即将二氧化碳通入氨化的氯化钠饱和溶液中,使溶解度小的碳酸氢钠从溶液中析出,过滤得到的碳酸氢钠晶体受热分解后生成碳酸钠。
NaCl+NH3+H2O+CO2==NaHCO3↓+NH4Cl
课堂小结
Na2CO3和NaHCO3比较
名称 碳酸钠(纯碱或苏打) 碳酸氢钠(小苏打)
溶解性
水溶液的酸碱性
与酸反应
与碱反应
热稳定性
易溶
易溶,同温下溶解度比Na2CO3小
碱性较强
碱性较弱,等浓度时,Na2CO3溶液的碱性强于NaHCO3溶液
能反应,有气体产生
剧烈反应,有气体产生
能与Ca(OH)2、Ba(OH)2溶液反应,生成白色沉淀
能与Ca(OH)2、Ba(OH)2溶液反应,生成白色沉淀
稳定,受热不易分解
不稳定,受热易分解
课堂练习
B
1、在等体积、等物质的量浓度的碳酸钠、碳酸氢钠溶液中,分别逐滴滴加相同浓度的盐酸至不再有二氧化碳气体放出,下列说法中正确的是( )
A.反应现象完全相同
B.产生二氧化碳的质量相同
C.碳酸钠产生的二氧化碳质量大
D.消耗盐酸的体积相同
课堂练习
1、按右图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3
和 NaHCO3同时倒入试管中。观察到的实验现象是_______________________________________________________________。
(2)实验结论:_________________________________________。
①两个气球均膨胀;②碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气球膨胀得快且大
碳酸氢钠与盐酸反应产生气体比等质量的碳酸钠与盐酸反应产生气体多且剧烈
专题三第二单元
金属钠及钠的化合物
02
碳酸钠 碳酸氢钠
食用纯碱的用途
食用小苏打的用途
碳酸钠 碳酸氢钠
Na2CO3
NaHCO3
碳酸钠 碳酸氢钠
化学式
Na2CO3
俗 名
纯碱、苏打
颜色、状态
白色粉末
化学式
NaHCO3
俗 名
小苏打
颜色、状态
白色晶体
在水中电离产生Na+、CO32-
在水中电离产生Na+、HCO3-
碳酸钠 碳酸氢钠
探究实验
1、溶解性比较
操作:
分别取1g Na2CO3和NaHCO3于两支试管中,加5mL水,观察溶解情况。
碳酸钠 碳酸氢钠
探究实验
1、碳酸钠 碳酸氢钠溶解性
实验现象 结论或解释
碳酸钠全部溶解,溶解放热
碳酸氢钠部分溶解
同温下,碳酸钠的溶解度大于碳酸氢钠。
0℃ 10℃ 20℃ 30℃ 40℃
S(Na2CO3) 7.1 12.5 21.5 39.7 49.0
S(NaHCO3) 6.9 8.1 9.6 11.1 12.7
碳酸钠 碳酸氢钠
探究实验
2、水溶液碱性比较
操作:分别蘸取碳酸钠溶液和碳酸氢钠溶液,滴在酚酞试纸上,观察变色情况。
碳酸钠 碳酸氢钠
探究实验
2、水溶液碱性比较
实验现象 结论或解释
滴有碳酸钠溶液的酚酞试纸颜色比碳酸氢钠溶液深
等浓度时,碳酸钠的碱性强于碳酸氢钠。
碳酸钠 碳酸氢钠
探究实验
3、与石灰水
操作:在两支洁净的试管中加入澄清石灰水,然后分别向试管内滴加碳酸钠和碳酸氢钠溶液, 观察现象。
现象:
结论及原理:
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
氢氧化钙少量时:2NaHCO3+Ca(OH) 2 =Na2CO3+CaCO3↓+2H2O
氢氧化钙过量时:NaHCO3+Ca(OH) 2 =NaOH+CaCO3↓+H2O
两支试管中均有白色沉淀生成
碳酸钠 碳酸氢钠
探究实验
4、与盐酸
操作:在两支洁净的试管中分别加入碳酸钠和碳酸氢钠溶液, 然后向试管内滴加盐酸,观察现象。
碳酸钠 碳酸氢钠
探究实验
4、与盐酸
现象:
结论及原理:
缓慢滴加盐酸,碳酸钠先没有明显现象,后出现气泡。碳酸氢钠则会立即产生气泡。
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+CO2↑+H2O
碳酸钠 碳酸氢钠
探究实验
5、热稳定性比较
操作:在两支洁净的试管中分别加入碳酸钠和碳酸氢钠, 分别加热,观察现象。
Na2CO3固体
NaHCO3固体
2NaHCO3 Na2CO3+H2O+CO2↑
△
碳酸钠 碳酸氢钠
探究实验
5、热稳定性比较
现象:
结论及原理:
NaHCO3受热产生能使澄清石灰水变浑浊的气体,而Na2CO3不能
热稳定性:Na2CO3>NaHCO3
碳酸钠和碳酸氢钠的鉴别方法
Na2CO3和NaHCO3的鉴别
分组讨论
比较同浓度Na2CO3和NaHCO3溶液的碱性,碱性强的为Na2CO3,弱的为NaHCO3
比较碱性法
2NaHCO3 Na2CO3+H2O+CO2↑
热分解法
△
与同浓度的酸反应NaHCO3比Na2CO3更剧烈
气体法
碳酸钠和碳酸氢钠如何相关转化?
分组讨论
Na2CO3 NaHCO3
①加热
①加 HCl
②加CO2+H2O
②加OH-
日常生活中,用热的纯碱溶液去除物品表面的油污。工业上,是一种重要的化工原料,广泛应用于食品、纺织、造纸、制皂、玻璃生产等。除此之外,也是医疗常用药物。
Na2CO3的用途
1、焙制糕点所用的发酵粉主要成分之一
2、用作食用碱
3、制干粉灭火剂
4、在医疗上,是治疗胃酸过多的一种药剂
NaHCO3的用途
科学史话
化学巨擘 永世楷模——侯德榜
侯氏制碱法
我国化学家侯德榜发现了氨碱法生产的不足之处,并于1943年提出了著名的侯氏制碱法(又称联合制碱法),即将二氧化碳通入氨化的氯化钠饱和溶液中,使溶解度小的碳酸氢钠从溶液中析出,过滤得到的碳酸氢钠晶体受热分解后生成碳酸钠。
NaCl+NH3+H2O+CO2==NaHCO3↓+NH4Cl
课堂小结
Na2CO3和NaHCO3比较
名称 碳酸钠(纯碱或苏打) 碳酸氢钠(小苏打)
溶解性
水溶液的酸碱性
与酸反应
与碱反应
热稳定性
易溶
易溶,同温下溶解度比Na2CO3小
碱性较强
碱性较弱,等浓度时,Na2CO3溶液的碱性强于NaHCO3溶液
能反应,有气体产生
剧烈反应,有气体产生
能与Ca(OH)2、Ba(OH)2溶液反应,生成白色沉淀
能与Ca(OH)2、Ba(OH)2溶液反应,生成白色沉淀
稳定,受热不易分解
不稳定,受热易分解
课堂练习
B
1、在等体积、等物质的量浓度的碳酸钠、碳酸氢钠溶液中,分别逐滴滴加相同浓度的盐酸至不再有二氧化碳气体放出,下列说法中正确的是( )
A.反应现象完全相同
B.产生二氧化碳的质量相同
C.碳酸钠产生的二氧化碳质量大
D.消耗盐酸的体积相同
课堂练习
1、按右图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3
和 NaHCO3同时倒入试管中。观察到的实验现象是_______________________________________________________________。
(2)实验结论:_________________________________________。
①两个气球均膨胀;②碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气球膨胀得快且大
碳酸氢钠与盐酸反应产生气体比等质量的碳酸钠与盐酸反应产生气体多且剧烈
