2023-2024学年高中化学苏教版2019必修第一册 3.2.3金属钠及钠的化合物-离子反应 课件(共21张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 3.2.3金属钠及钠的化合物-离子反应 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 13:05:25 | ||
图片预览






文档简介
(共21张PPT)
专题三第二单元
金属钠及钠的化合物
03
离子反应
物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
H+
液 面
Cl-
H+
Cl-
H+
Cl-
Cl-
H2O
H+
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
Cl-
H+
盐酸
H2O
H2O
H2O
H2O
H2O
液 面
CH3COOH
CH3COOH
CH3COOH
H2O
CH3COOH
CH3COOH
CH3COOH
醋酸溶液
H2O
H2O
H2O
H2O
H2O
CH3COO-
CH3COOH
CH3COOH
CH3COOH
H+
物质的量浓度相同时,导电能力:盐酸强于醋酸
HCl== H+ + Cl-
CH3COOH CH3COO- + H+
完全电离
不完全电离
Na+
液 面
OH-
Na+
OH-
Na+
OH-
OH-
H2O
Na+
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
OH-
Na+
氢氧化钠溶液
H2O
H2O
H2O
H2O
H2O
液 面
NH3·H2O
NH3·H2O
NH3·H2O
H2O
NH3·H2O
NH3·H2O
NH3·H2O
氨水
H2O
H2O
H2O
H2O
H2O
NH4+
NH3·H2O
NH3·H2O
NH3·H2O
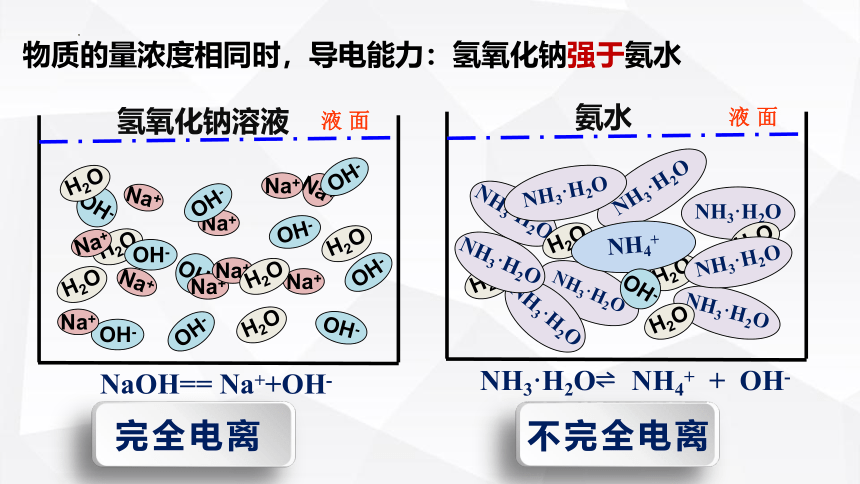
物质的量浓度相同时,导电能力:氢氧化钠强于氨水
NaOH== Na++OH-
NH3·H2O NH4+ + OH-
完全电离
不完全电离
OH-
强电解质 弱电解质
在水溶液中能完全电离的电解质
①强酸:H2SO4、HCl、HNO3等。
②强碱:NaOH、KOH等。
③绝大多数盐,包括难溶性的盐。
①H2SO4: 。
②KOH: 。
③CaCl2: 。
电离方程式
常见的强电解质
概念
强电解质
KOH===K++OH-
CaCl2===Ca2++2Cl-
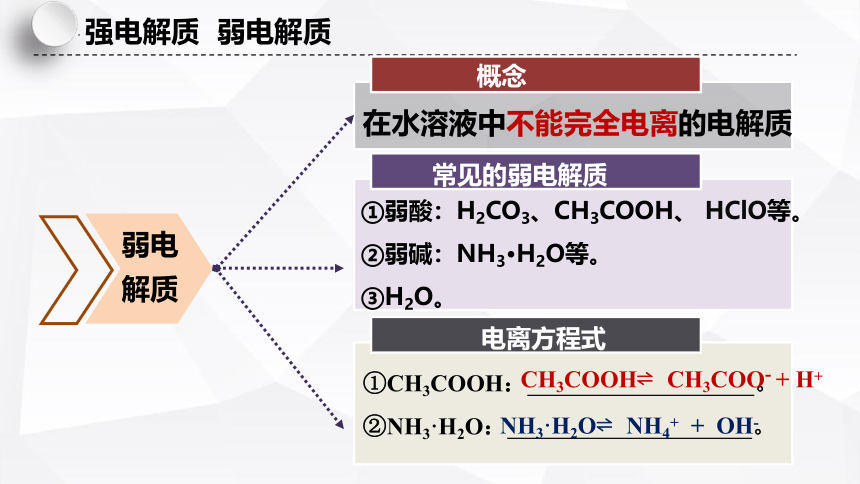
强电解质 弱电解质
在水溶液中不能完全电离的电解质
①弱酸:H2CO3、CH3COOH、 HClO等。
②弱碱:NH3·H2O等。
③H2O。
①CH3COOH: 。
②NH3·H2O: 。
电离方程式
常见的弱电解质
概念
弱电解质
CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
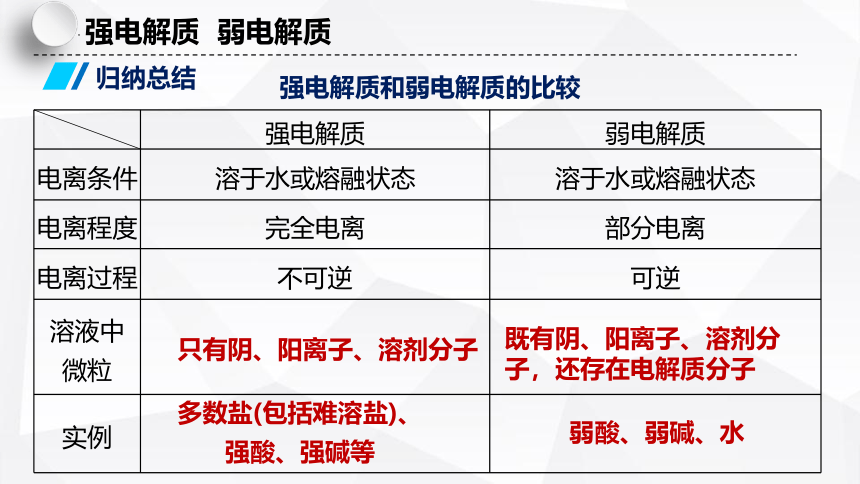
强电解质 弱电解质
强电解质 弱电解质
电离条件 溶于水或熔融状态 溶于水或熔融状态
电离程度 完全电离 部分电离
电离过程 不可逆 可逆
溶液中 微粒
实例
强电解质和弱电解质的比较
归纳总结
多数盐(包括难溶盐)、强酸、强碱等
弱酸、弱碱、水
只有阴、阳离子、溶剂分子
既有阴、阳离子、溶剂分子,还存在电解质分子
Na2CO3溶液分别与澄清石灰水、CaCl2溶液反应,都有白色的CaCO3沉淀生成,这两个反应的实质是否相同?
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
CO32-
CO32-
Ca2+
Cl-
Cl-
Ca2+
Cl-
Cl-
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
Cl-
Cl-
Cl-
Cl-
CaCO3
CaCO3
CO32-
CO32-
Ca2+
Ca2+
CaCO3
CaCO3
混合后数目减少的离子
混合后数目不变的离子
反应实质
Na+、OH-
Ca2+、CO32-
Ca2+、CO32-结合成CaCO3沉淀
Na+、Cl-
Ca2+、CO32-
离子反应
本质
有离子参加的化学反应称为离子反应
从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是电解质在溶液中相互交换离子的反应。
离子反应使溶液中某些离子的浓度减小。
离子反应
离子反应发生的条件
生成难溶物质(如:沉淀)
生成挥发性物质(如:气体)
生成难电离物质(如:弱电解质)
Na2CO3溶液与澄清石灰水
Na2CO3溶液与CaCl2溶液
Na2CO3 + CaCl2 =2 NaCl + CaCO3↓
Na2CO3+Ca(OH)2=2NaOH +CaCO3↓
离子反应
CO3 2- + Ca2+ =CaCO3↓
CO3 2- + Ca2+=CaCO3↓
离子方程式
离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
1. 写:写出反应的化学方程式。
Na2CO3 + 2HCl ═2 NaCl + CO2↑+H2O
2.拆: 把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。
2Na++CO32- + 2H++2Cl- ═2 Na+ +2Cl- + CO2↑+H2O
离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
3.删: 删去化学方程式两边不参加反应的离子。
4. 查:检查离子方程式两边各元素的原子数目和离子所带的电荷总数是否相等。
CO32- + 2H+ ═ CO2↑+ H2O
离子反应
离子反应中“拆”的标准:
溶于水且完全电离的物质
需要用化学式表示的物质
难溶物质:
BaSO4 、 BaCO3、CaCO3、AgCl等
Al(OH)3 、Mg(OH)2 、 Fe(OH)3等
气体:
O2、CO2、H2等
单质:
Fe、Cu等
难电离物质:
弱酸(CH3COOH 、 HClO 、 HF等)
弱碱(NH3.H2O)、 水
氧化物:
MgO、CuO等
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 _________________________ __________________
盐酸与氢氧化钾 _______________________ __________________
硫酸与氢氧化钠 ___________________________________ __________________
总结 离子方程式不仅可以表示 ,还可以表示_______________
HCl+NaOH===NaCl+H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4
+2H2O
某一个特定的化学反应
同一类化学反应
离子反应
强化巩固
书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
强化巩固
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
延时符
课堂小结
01
02
03
钠的性质
钠的氧化物
钠的制备及用途
课堂练习
1.下列陈述正确的是
A.NaHSO4在水溶液中的电离方程式:
B.氢氧化铁胶体的制备原理:FeCl3 +3NaOH===Fe(OH)3↓+3NaCl
C.铜片插入硝酸银溶液中:Cu+2Ag+===Cu2++2Ag
D.将Ba(OH)2溶液滴入稀H2SO4溶液:
+BaSO4↓
C
课堂练习
2.写出下列反应的离子方程式。
(1)氢氧化钠溶液与硝酸溶液:__________________。
(2)氯化钠溶液与硝酸银溶液:____________________。
(3)氢氧化钡溶液和硫酸铜溶液:_________________________________
___________。
(4)铜与硝酸银溶液反应:________________________。
(5)碳酸钠溶液与氢氧化钙溶液反应:______________________。
(6)碳酸钙与稀硝酸反应:_________________________________。
H++OH-===H2O
Cl-+Ag+===AgCl↓
+Cu(OH)2↓
Cu+2Ag+===Cu2++2Ag
CaCO3+2H+===H2O+CO2↑+Ca2+
专题三第二单元
金属钠及钠的化合物
03
离子反应
物质的量浓度相同的不同电解质溶液,其导电能力是否相同呢?
H+
液 面
Cl-
H+
Cl-
H+
Cl-
Cl-
H2O
H+
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
Cl-
H+
盐酸
H2O
H2O
H2O
H2O
H2O
液 面
CH3COOH
CH3COOH
CH3COOH
H2O
CH3COOH
CH3COOH
CH3COOH
醋酸溶液
H2O
H2O
H2O
H2O
H2O
CH3COO-
CH3COOH
CH3COOH
CH3COOH
H+
物质的量浓度相同时,导电能力:盐酸强于醋酸
HCl== H+ + Cl-
CH3COOH CH3COO- + H+
完全电离
不完全电离
Na+
液 面
OH-
Na+
OH-
Na+
OH-
OH-
H2O
Na+
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
Na+
OH-
OH-
Na+
氢氧化钠溶液
H2O
H2O
H2O
H2O
H2O
液 面
NH3·H2O
NH3·H2O
NH3·H2O
H2O
NH3·H2O
NH3·H2O
NH3·H2O
氨水
H2O
H2O
H2O
H2O
H2O
NH4+
NH3·H2O
NH3·H2O
NH3·H2O
物质的量浓度相同时,导电能力:氢氧化钠强于氨水
NaOH== Na++OH-
NH3·H2O NH4+ + OH-
完全电离
不完全电离
OH-
强电解质 弱电解质
在水溶液中能完全电离的电解质
①强酸:H2SO4、HCl、HNO3等。
②强碱:NaOH、KOH等。
③绝大多数盐,包括难溶性的盐。
①H2SO4: 。
②KOH: 。
③CaCl2: 。
电离方程式
常见的强电解质
概念
强电解质
KOH===K++OH-
CaCl2===Ca2++2Cl-
强电解质 弱电解质
在水溶液中不能完全电离的电解质
①弱酸:H2CO3、CH3COOH、 HClO等。
②弱碱:NH3·H2O等。
③H2O。
①CH3COOH: 。
②NH3·H2O: 。
电离方程式
常见的弱电解质
概念
弱电解质
CH3COOH CH3COO- + H+
NH3·H2O NH4+ + OH-
强电解质 弱电解质
强电解质 弱电解质
电离条件 溶于水或熔融状态 溶于水或熔融状态
电离程度 完全电离 部分电离
电离过程 不可逆 可逆
溶液中 微粒
实例
强电解质和弱电解质的比较
归纳总结
多数盐(包括难溶盐)、强酸、强碱等
弱酸、弱碱、水
只有阴、阳离子、溶剂分子
既有阴、阳离子、溶剂分子,还存在电解质分子
Na2CO3溶液分别与澄清石灰水、CaCl2溶液反应,都有白色的CaCO3沉淀生成,这两个反应的实质是否相同?
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
CO32-
CO32-
Ca2+
Cl-
Cl-
Ca2+
Cl-
Cl-
液 面
Na+
Na+
Na2CO3溶液
澄清石灰水
Na+
Na+
CO32-
CO32-
Ca2+
OH-
OH-
Ca2+
OH-
OH-
液 面
Na+
Na+
Na2CO3溶液
CaCl2溶液
Na+
Na+
Cl-
Cl-
Cl-
Cl-
CaCO3
CaCO3
CO32-
CO32-
Ca2+
Ca2+
CaCO3
CaCO3
混合后数目减少的离子
混合后数目不变的离子
反应实质
Na+、OH-
Ca2+、CO32-
Ca2+、CO32-结合成CaCO3沉淀
Na+、Cl-
Ca2+、CO32-
离子反应
本质
有离子参加的化学反应称为离子反应
从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是电解质在溶液中相互交换离子的反应。
离子反应使溶液中某些离子的浓度减小。
离子反应
离子反应发生的条件
生成难溶物质(如:沉淀)
生成挥发性物质(如:气体)
生成难电离物质(如:弱电解质)
Na2CO3溶液与澄清石灰水
Na2CO3溶液与CaCl2溶液
Na2CO3 + CaCl2 =2 NaCl + CaCO3↓
Na2CO3+Ca(OH)2=2NaOH +CaCO3↓
离子反应
CO3 2- + Ca2+ =CaCO3↓
CO3 2- + Ca2+=CaCO3↓
离子方程式
离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
1. 写:写出反应的化学方程式。
Na2CO3 + 2HCl ═2 NaCl + CO2↑+H2O
2.拆: 把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。
2Na++CO32- + 2H++2Cl- ═2 Na+ +2Cl- + CO2↑+H2O
离子反应
离子方程式的书写
(以碳酸钠与盐酸的反应为例)
3.删: 删去化学方程式两边不参加反应的离子。
4. 查:检查离子方程式两边各元素的原子数目和离子所带的电荷总数是否相等。
CO32- + 2H+ ═ CO2↑+ H2O
离子反应
离子反应中“拆”的标准:
溶于水且完全电离的物质
需要用化学式表示的物质
难溶物质:
BaSO4 、 BaCO3、CaCO3、AgCl等
Al(OH)3 、Mg(OH)2 、 Fe(OH)3等
气体:
O2、CO2、H2等
单质:
Fe、Cu等
难电离物质:
弱酸(CH3COOH 、 HClO 、 HF等)
弱碱(NH3.H2O)、 水
氧化物:
MgO、CuO等
溶液中反应物 化学方程式 离子方程式
盐酸与氢氧化钠 _________________________ __________________
盐酸与氢氧化钾 _______________________ __________________
硫酸与氢氧化钠 ___________________________________ __________________
总结 离子方程式不仅可以表示 ,还可以表示_______________
HCl+NaOH===NaCl+H2O
HCl+KOH===KCl+H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
H2SO4+2NaOH===Na2SO4
+2H2O
某一个特定的化学反应
同一类化学反应
离子反应
强化巩固
书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
强化巩固
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
延时符
课堂小结
01
02
03
钠的性质
钠的氧化物
钠的制备及用途
课堂练习
1.下列陈述正确的是
A.NaHSO4在水溶液中的电离方程式:
B.氢氧化铁胶体的制备原理:FeCl3 +3NaOH===Fe(OH)3↓+3NaCl
C.铜片插入硝酸银溶液中:Cu+2Ag+===Cu2++2Ag
D.将Ba(OH)2溶液滴入稀H2SO4溶液:
+BaSO4↓
C
课堂练习
2.写出下列反应的离子方程式。
(1)氢氧化钠溶液与硝酸溶液:__________________。
(2)氯化钠溶液与硝酸银溶液:____________________。
(3)氢氧化钡溶液和硫酸铜溶液:_________________________________
___________。
(4)铜与硝酸银溶液反应:________________________。
(5)碳酸钠溶液与氢氧化钙溶液反应:______________________。
(6)碳酸钙与稀硝酸反应:_________________________________。
H++OH-===H2O
Cl-+Ag+===AgCl↓
+Cu(OH)2↓
Cu+2Ag+===Cu2++2Ag
CaCO3+2H+===H2O+CO2↑+Ca2+
