2023-2024学年高中化学苏教版2019必修第一册 4.2.2 氧化还原反应方程式的配平 课件(共23张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 4.2.2 氧化还原反应方程式的配平 课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 13:13:48 | ||
图片预览






文档简介
(共23张PPT)
专题四第二单元
硫及其化合物之间的相互转化
02
氧化还原反应方程式的配平
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
2
5
5
3
2
8
以下那种配平是正确的?
思考
1
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
2
3
1
3
2
4
1
?
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
2
5
5
3
2
8
以下那种配平是正确的?
思考
1
+7
-1
+2
0
Mn
降5
+2
+7
O
升1
0
-1
×2
×2
×5
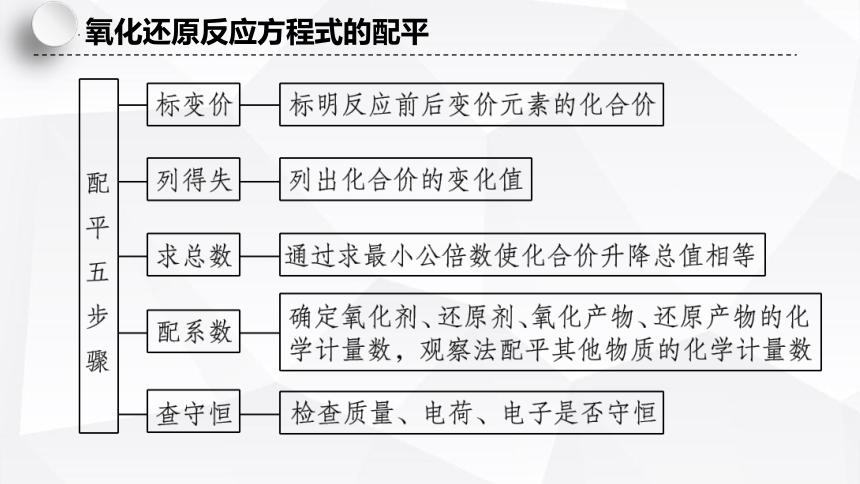
氧化还原反应方程式的配平
配平原则
电子守恒
氧化剂和还原剂得失电子总数相等,
化合价升高总数=化合价降低总数;
原子守恒
反应前后原子的种类和个数不变;
电荷守恒
离子反应前后,所带电荷总数相等。
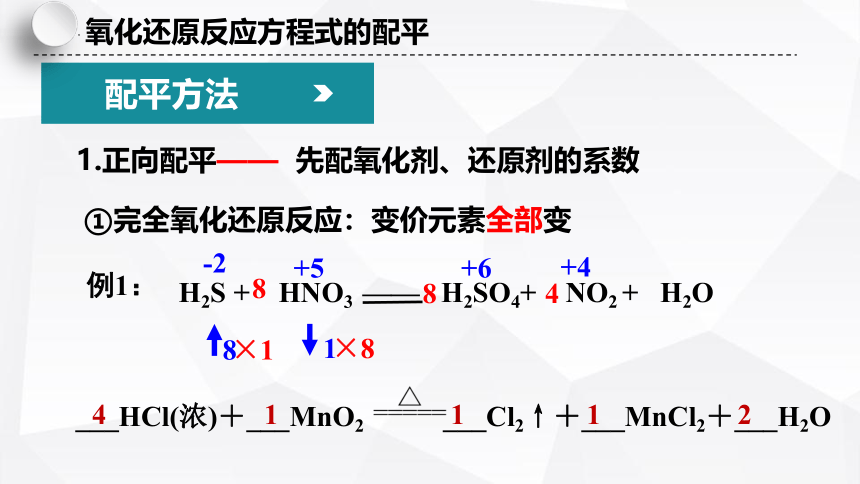
氧化还原反应方程式的配平
1.正向配平—— 先配氧化剂、还原剂的系数
①完全氧化还原反应:变价元素全部变
H2S + HNO3 —— H2SO4+ NO2 + H2O
×1
-2
8
1
×8
8
+5
+6
+4
8
4
例1:
配平方法
氧化还原反应方程式的配平
___HCl(浓)+___MnO2 ___Cl2↑+___MnCl2+___H2O
4 1 1 1 2
H2S + SO2 —— S ↓ + H2O
②归中反应:同一元素的高价与低价反应生成该元素的某
中间价态的反应
-2
2
×2
×1
2
+4
0
4
3
2
例2:
配平方法
氧化还原反应方程式的配平
1.正向配平—— 先配氧化剂、还原剂的系数
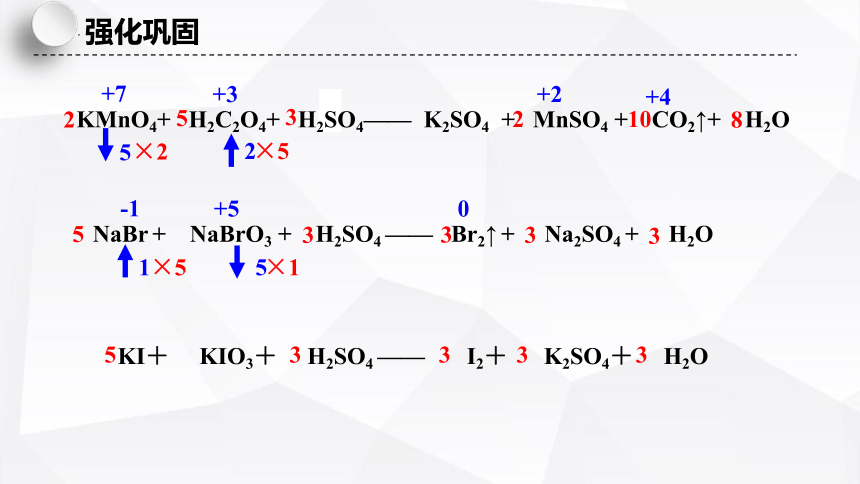
NaBr + NaBrO3 + H2SO4 —— Br2↑ + Na2SO4 + H2O
5
KMnO4+ H2C2O4+ H2SO4—— K2SO4 + MnSO4 + CO2↑+ H2O
2
KI+ KIO3+ H2SO4 —— I2+ K2SO4+ H2O
5 3 3 3 3
+7
+3
+2
+4
×2
5
2
×5
×5
1
5
×1
-1
+5
0
5
3
2
10
8
3
3
3
3
强化巩固
2. 逆向配平法——先配氧化产物、还原产物的系数
① 部分氧化还原反应:变价元素部分被氧化或部分被还原
Cu + HNO3(稀)— Cu(NO3)2+ NO↑ + H2O
0
+5
+2
+2
×3
×2
2
3
3
2
3
8
4
例3:
氧化还原反应方程式的配平
配平方法
②歧化反应:同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应
S+ KOH —— K2SO3 + K2S + H2O
0
-2
+4
6
3
3
2
×1
×2
4
2
例4:
2. 逆向配平法——先配氧化产物、还原产物的系数
氧化还原反应方程式的配平
____Cl2+____KOH===____KCl+____KClO3+____H2O
3 6 5 1 3
某温度下,将 Cl2 通入 NaOH 溶液中,反应得到H2O、 NaCl、NaClO、NaClO3 的混合液,经测定,ClO-与ClO3-的浓度之比为1:3,写出该反应的化学反应方程式:
10Cl2+20NaOH=16NaCl+NaClO+3NaClO3+10H2O
强化巩固
3 .整体配平法
FeS2+ O2 —— Fe2O3 + SO2
高温
+2
-1
+3
0
+4
1
10
11
×11
4
×4
4
11
2
8
-2
-2
某物质所含元素化合价同时升高或降低,或有升有降时,将该物质当作一个整体来计算化合价的变化数
例5:
氧化还原反应方程式的配平
Cu2S + HNO3 — Cu(NO3)2+ NO ↑+ H2SO4 + H2O
+1
-2
+2
+6
+5
+2
2
8
10
×3
3
×10
3
10
6
3
22
8
3 .整体配平法
氧化还原反应方程式的配平
将锌投入到一定浓度的稀硝酸中,锌溶解,产生Zn(NO3)2、H2O、NO和NO2气体(不考虑其它还原产物),且在相同状况下NO和NO2气体的体积比为1:2,写出该反应的化学反应方程式
。
5Zn+16HNO3(稀)=5Zn(NO3)2+2NO ↑ +4NO2 ↑ +8H2O
Cu2S+ HNO3 —— Cu(NO3)2+ NO ↑ + S + H2O
3 16 6 4 3 8
强化巩固
4、离子反应型方程式的配平
-1
+7
+2
0
例6: H2O2+ MnO4-+ H+ — Mn2++ O2↑+ H2O
×5
2
5
5
5
2
6
8
×2
2
先配电子得失守恒,再配电荷守恒,最后配质量守恒。
氧化还原反应方程式的配平
ClO- + Fe2+ + H+ — Cl- + Fe3+ + H2O
2 2 2
2 16 10 2 5 8
MnO4- + H+ + Cl- — Mn2+ + Cl2↑ + H2O
S2O52- + I2+ H2O —— SO42- + I-+ H+
2 3 2 4 6
强化巩固
缺项是指某些反应物或生成物没有写出来,一般为水、酸或碱。
5. 缺项配平
氧化还原反应方程式的配平
(1)先根据化合价变化找出氧化剂、还原剂及还原产物、氧化产物;
(2)再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子),若反应物缺正电荷,一般加H+,生成物加水;若反应物缺负电荷,一般加OH-,生成物加水。
(3)最后观察配平其他物质系数。
ClO3-+ Fe2+ + = + Fe3+ + .
6
工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
H+
H2O
Cl-
例7:
6
3
6
___Mn2++___ClO3-+___H2O===___MnO2↓+___Cl2+____
5. 缺项配平
氧化还原反应方程式的配平
5 2 4 5 1 8H+
氧化还原反应方程式的配平
新情景下氧化还原反应方程式的书写
由新情景信息,据反应体系中物质书写反应方程式
解题步骤 解题注意事项
第一步:分析物质的氧化性及还原性 根据化合价把元素化合价高的微粒及元素化合价低的微粒分成两类,并比较氧化性微粒的氧化性强弱及还原性微粒的还原性强弱
第二步:书写反应的主体反应物及产物 依据“两强生两弱原理”,把氧化性强的微粒与还原性强的微粒作为反应物,把氧化性弱的微粒与还原性弱的微粒作为生成物
第三步:配平反应主体物质的系数 根据得失电子守恒配平主体物质的系数
第四步:配平其他物质的化学计量数 根据原子守恒、电荷守恒配平其他物质的化学计量数
氧化还原反应方程式的配平
新情景下氧化还原反应方程式的书写
强化巩固
1.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_____________________________。
2.NO被H2O2氧化为 的离子方程式
是__________________________。
3.在H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式为____________________________________。
2NaHSO3===
Na2S2O5+H2O
2NO+3H2O2
2ClO2+10I-+8H+===2Cl-+5I2+4H2O
延时符
课堂小结
01
02
氧化还原反应方程式的配平原则
氧化还原反应方程式的配平方法
课堂练习
1.配平以下氧化还原反应方程式。
(1)正向配平
①____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
②____ +____H++____Cl-===____Mn2++____Cl2↑+___H2O
(2)逆向配平
①____S+____KOH===____K2S+____K2SO3+____H2O
②____P4+____KOH+____H2O===____K3PO4+____PH3
(3)缺项配平
①____ClO-+____Fe(OH)3+____===___Cl-+____ +____H2O
②__Mn2++____ +___H2O===____MnO2↓+___Cl2↑+_____
5 1 3 3 3 3
2 16 10 2 5 8
3 6 2 1 3
2 9 3 3 5
3 2 4OH- 3 2 5
5 2 4 5 1 8H+
专题四第二单元
硫及其化合物之间的相互转化
02
氧化还原反应方程式的配平
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
2
5
5
3
2
8
以下那种配平是正确的?
思考
1
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
2
3
1
3
2
4
1
?
KMnO4+ H2O2+ H2SO4=== MnSO4+ K2SO4+ O2↑+ H2O
2
5
5
3
2
8
以下那种配平是正确的?
思考
1
+7
-1
+2
0
Mn
降5
+2
+7
O
升1
0
-1
×2
×2
×5
氧化还原反应方程式的配平
配平原则
电子守恒
氧化剂和还原剂得失电子总数相等,
化合价升高总数=化合价降低总数;
原子守恒
反应前后原子的种类和个数不变;
电荷守恒
离子反应前后,所带电荷总数相等。
氧化还原反应方程式的配平
1.正向配平—— 先配氧化剂、还原剂的系数
①完全氧化还原反应:变价元素全部变
H2S + HNO3 —— H2SO4+ NO2 + H2O
×1
-2
8
1
×8
8
+5
+6
+4
8
4
例1:
配平方法
氧化还原反应方程式的配平
___HCl(浓)+___MnO2 ___Cl2↑+___MnCl2+___H2O
4 1 1 1 2
H2S + SO2 —— S ↓ + H2O
②归中反应:同一元素的高价与低价反应生成该元素的某
中间价态的反应
-2
2
×2
×1
2
+4
0
4
3
2
例2:
配平方法
氧化还原反应方程式的配平
1.正向配平—— 先配氧化剂、还原剂的系数
NaBr + NaBrO3 + H2SO4 —— Br2↑ + Na2SO4 + H2O
5
KMnO4+ H2C2O4+ H2SO4—— K2SO4 + MnSO4 + CO2↑+ H2O
2
KI+ KIO3+ H2SO4 —— I2+ K2SO4+ H2O
5 3 3 3 3
+7
+3
+2
+4
×2
5
2
×5
×5
1
5
×1
-1
+5
0
5
3
2
10
8
3
3
3
3
强化巩固
2. 逆向配平法——先配氧化产物、还原产物的系数
① 部分氧化还原反应:变价元素部分被氧化或部分被还原
Cu + HNO3(稀)— Cu(NO3)2+ NO↑ + H2O
0
+5
+2
+2
×3
×2
2
3
3
2
3
8
4
例3:
氧化还原反应方程式的配平
配平方法
②歧化反应:同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应
S+ KOH —— K2SO3 + K2S + H2O
0
-2
+4
6
3
3
2
×1
×2
4
2
例4:
2. 逆向配平法——先配氧化产物、还原产物的系数
氧化还原反应方程式的配平
____Cl2+____KOH===____KCl+____KClO3+____H2O
3 6 5 1 3
某温度下,将 Cl2 通入 NaOH 溶液中,反应得到H2O、 NaCl、NaClO、NaClO3 的混合液,经测定,ClO-与ClO3-的浓度之比为1:3,写出该反应的化学反应方程式:
10Cl2+20NaOH=16NaCl+NaClO+3NaClO3+10H2O
强化巩固
3 .整体配平法
FeS2+ O2 —— Fe2O3 + SO2
高温
+2
-1
+3
0
+4
1
10
11
×11
4
×4
4
11
2
8
-2
-2
某物质所含元素化合价同时升高或降低,或有升有降时,将该物质当作一个整体来计算化合价的变化数
例5:
氧化还原反应方程式的配平
Cu2S + HNO3 — Cu(NO3)2+ NO ↑+ H2SO4 + H2O
+1
-2
+2
+6
+5
+2
2
8
10
×3
3
×10
3
10
6
3
22
8
3 .整体配平法
氧化还原反应方程式的配平
将锌投入到一定浓度的稀硝酸中,锌溶解,产生Zn(NO3)2、H2O、NO和NO2气体(不考虑其它还原产物),且在相同状况下NO和NO2气体的体积比为1:2,写出该反应的化学反应方程式
。
5Zn+16HNO3(稀)=5Zn(NO3)2+2NO ↑ +4NO2 ↑ +8H2O
Cu2S+ HNO3 —— Cu(NO3)2+ NO ↑ + S + H2O
3 16 6 4 3 8
强化巩固
4、离子反应型方程式的配平
-1
+7
+2
0
例6: H2O2+ MnO4-+ H+ — Mn2++ O2↑+ H2O
×5
2
5
5
5
2
6
8
×2
2
先配电子得失守恒,再配电荷守恒,最后配质量守恒。
氧化还原反应方程式的配平
ClO- + Fe2+ + H+ — Cl- + Fe3+ + H2O
2 2 2
2 16 10 2 5 8
MnO4- + H+ + Cl- — Mn2+ + Cl2↑ + H2O
S2O52- + I2+ H2O —— SO42- + I-+ H+
2 3 2 4 6
强化巩固
缺项是指某些反应物或生成物没有写出来,一般为水、酸或碱。
5. 缺项配平
氧化还原反应方程式的配平
(1)先根据化合价变化找出氧化剂、还原剂及还原产物、氧化产物;
(2)再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子),若反应物缺正电荷,一般加H+,生成物加水;若反应物缺负电荷,一般加OH-,生成物加水。
(3)最后观察配平其他物质系数。
ClO3-+ Fe2+ + = + Fe3+ + .
6
工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
H+
H2O
Cl-
例7:
6
3
6
___Mn2++___ClO3-+___H2O===___MnO2↓+___Cl2+____
5. 缺项配平
氧化还原反应方程式的配平
5 2 4 5 1 8H+
氧化还原反应方程式的配平
新情景下氧化还原反应方程式的书写
由新情景信息,据反应体系中物质书写反应方程式
解题步骤 解题注意事项
第一步:分析物质的氧化性及还原性 根据化合价把元素化合价高的微粒及元素化合价低的微粒分成两类,并比较氧化性微粒的氧化性强弱及还原性微粒的还原性强弱
第二步:书写反应的主体反应物及产物 依据“两强生两弱原理”,把氧化性强的微粒与还原性强的微粒作为反应物,把氧化性弱的微粒与还原性弱的微粒作为生成物
第三步:配平反应主体物质的系数 根据得失电子守恒配平主体物质的系数
第四步:配平其他物质的化学计量数 根据原子守恒、电荷守恒配平其他物质的化学计量数
氧化还原反应方程式的配平
新情景下氧化还原反应方程式的书写
强化巩固
1.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_____________________________。
2.NO被H2O2氧化为 的离子方程式
是__________________________。
3.在H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式为____________________________________。
2NaHSO3===
Na2S2O5+H2O
2NO+3H2O2
2ClO2+10I-+8H+===2Cl-+5I2+4H2O
延时符
课堂小结
01
02
氧化还原反应方程式的配平原则
氧化还原反应方程式的配平方法
课堂练习
1.配平以下氧化还原反应方程式。
(1)正向配平
①____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
②____ +____H++____Cl-===____Mn2++____Cl2↑+___H2O
(2)逆向配平
①____S+____KOH===____K2S+____K2SO3+____H2O
②____P4+____KOH+____H2O===____K3PO4+____PH3
(3)缺项配平
①____ClO-+____Fe(OH)3+____===___Cl-+____ +____H2O
②__Mn2++____ +___H2O===____MnO2↓+___Cl2↑+_____
5 1 3 3 3 3
2 16 10 2 5 8
3 6 2 1 3
2 9 3 3 5
3 2 4OH- 3 2 5
5 2 4 5 1 8H+
