2023-2024学年高中化学苏教版2019必修第一册 4.3防治二氧化硫对环境的污染 课件(共24张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 4.3防治二氧化硫对环境的污染 课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 51.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 13:14:36 | ||
图片预览






文档简介
(共24张PPT)
专题四第三单元
防治二氧化硫对环境的污染
01
防治二氧化硫对环境的污染
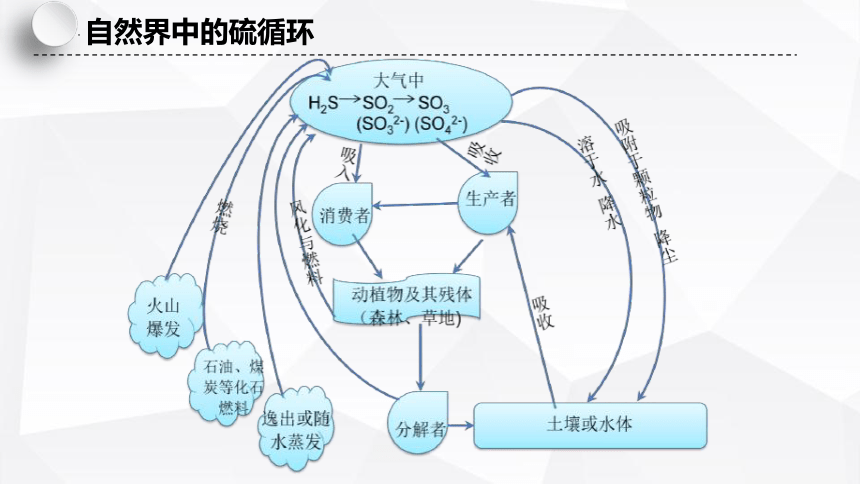
自然界中的硫循环
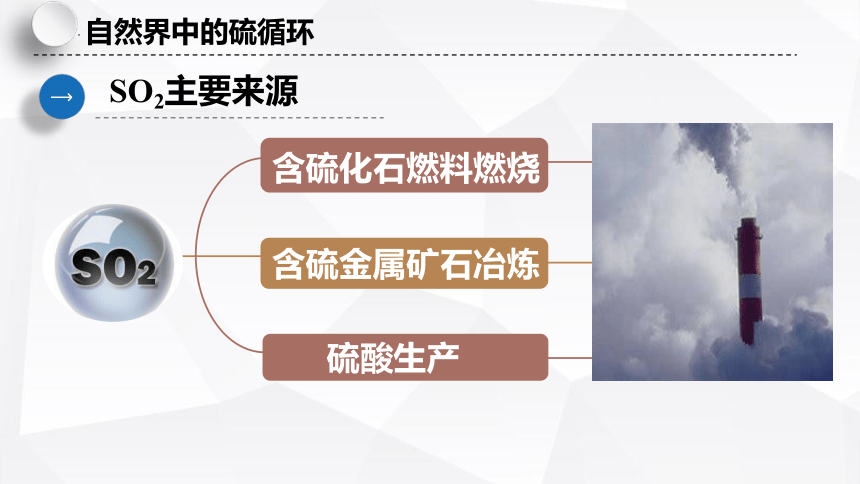
硫酸生产
含硫化石燃料燃烧
含硫金属矿石冶炼
自然界中的硫循环
SO2主要来源
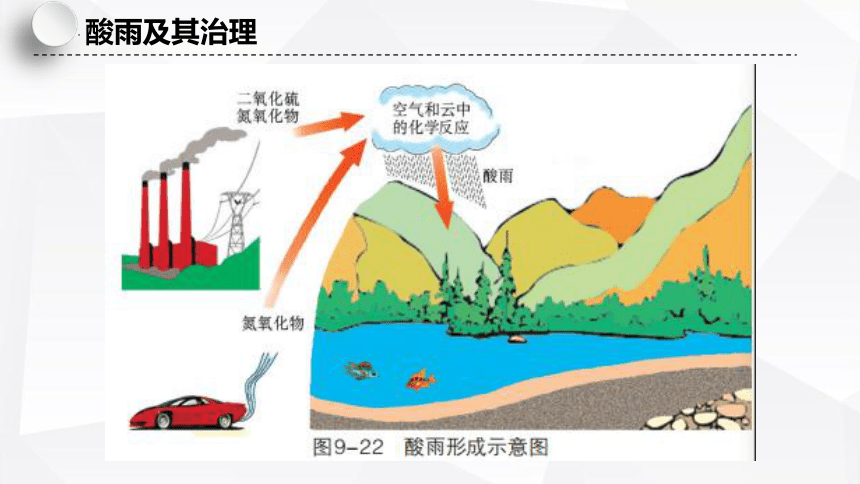
酸雨及其治理
正常雨水:pH大小为5.6—6.0,略显酸性,
酸雨及其治理
原因:CO2+H2O=H2CO3
酸雨: pH <5.6的雨水
SO2 →硫酸型酸雨
NOx →硝酸型酸雨
酸雨及其治理
影响水生生物的生长和繁殖
使土壤酸化,损害农作物和林木生长
腐蚀建筑物、工厂设备和文化古迹
危害人类健康
酸雨的危害
酸雨及其治理
酸雨及其治理
酸雨的形成
酸雨及其治理
相关反应原理:
①_____________________。
②___________________。
③___________________。
④_____________________。
2SO2+O2 === === 2SO3
SO2+H2O === H2SO3
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
酸雨及其治理
酸雨的防治
对SO2废气进行处理或回收利用。
消除污染源,研究开发新能源(如太阳能、核能、氢能等)。
对含硫燃料进行脱硫处理。
1
2
3
酸雨及其治理
SO2的处理回收
烧碱溶液
熟石灰
实验室中
工业上
SO2+2NaOH==
Na2SO3+H2O
SO2+Ca(OH)2===CaSO3+H2O
生石灰
SO2+CaO===CaSO3
海水吸收
工艺简单,节约资源,
但对海洋环境的影响尚需进一步评估
酸雨及其治理
SO2的处理回收-烟气脱硫
该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂泵入吸收塔,与烟气充分接触混合并氧化,最终生成石膏(CaSO4·2H2O)。脱硫后的烟气经过除雾器除去雾滴,再经过换热器加热升温后,由烟囱排入大气。
石灰石-石膏法
CaCO3 + SO2=CaSO3 + CO2
2CaSO3 + O2=2CaSO4
酸雨及其治理
SO2的处理回收-烟气脱硫
氨脱硫法是一个酸碱中和反应和氧化还原反应相结合的过
程,在脱硫塔内气、液、固多组分混合。
氨脱硫法
2NH3 + H2O + SO2=(NH4)2SO3
2(NH4)2SO3 + O2=2(NH4)2SO4
空气质量评价
空气质量指数(AQI)
空气质量指数越小,空气质量越好,对人体健康的危害就越小。
空气质量指数是根据空气中的细颗粒物(PM2.5)、可吸入颗粒物(PM10)、二氧化硫、二氧化氮、臭氧和一氧化碳的浓度计算出来的数值。
空气质量评价
空气质量指数(AQI)确定方法
空气质量监测人员测出空气质量指数中这六大污染物的浓度,再换算成它们的质量指数,其中指数最大的污染物会被确定为首要污染物,首要污染物的质量指数即为该地区的空气质量指数。
首要污染物
空气质量评价
大量极细微的颗粒物均匀地悬浮在空中,这些颗粒物容易吸附空气中的水蒸气形成雾滴,使空气水平能见度小于10_km,我们把这种空气混浊现象叫作雾霾。
雾霾
颗粒物分类依据
颗粒物直径的大小
空气质量评价
雾霾
颗粒物分类
细颗粒物(PM2.5,直径小于2.5 μm)
可吸入颗粒物(PM10,直径小于10 μm)
空气中的SO2在一定条件下形成CaSO4,硫酸盐在PM2.5中所占比例较大。
空气质量评价
雾霾
空气质量评价
大气污染的防治
提高污染排放标准
改变能源结构
控制SO2等有害
气体的排放
延时符
课堂小结
01
02
自然界中的硫循环
酸雨及其治理
03
空气质量评价
课堂练习
形成酸雨的原理之一可简示为
回答下列问题:
(1)A物质的化学式为_____,B物质的化学式为____。
(2)洗涤含SO2的烟气,以下物质可作洗涤剂的是___ (填字母)
a.Ca(OH)2 b.Na2CO3
c.CaCl2 d.NaHSO3
SO2
SO3
ab
课堂练习
(3)利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是__________________。
(4)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出有关反应的两个化学方程式:_________________________________________________________。
SO2
SO2+Ca(OH)2===CaSO3+H2O,2CaSO3+O2+2H2O
===2CaSO4·2H2O
专题四第三单元
防治二氧化硫对环境的污染
01
防治二氧化硫对环境的污染
自然界中的硫循环
硫酸生产
含硫化石燃料燃烧
含硫金属矿石冶炼
自然界中的硫循环
SO2主要来源
酸雨及其治理
正常雨水:pH大小为5.6—6.0,略显酸性,
酸雨及其治理
原因:CO2+H2O=H2CO3
酸雨: pH <5.6的雨水
SO2 →硫酸型酸雨
NOx →硝酸型酸雨
酸雨及其治理
影响水生生物的生长和繁殖
使土壤酸化,损害农作物和林木生长
腐蚀建筑物、工厂设备和文化古迹
危害人类健康
酸雨的危害
酸雨及其治理
酸雨及其治理
酸雨的形成
酸雨及其治理
相关反应原理:
①_____________________。
②___________________。
③___________________。
④_____________________。
2SO2+O2 === === 2SO3
SO2+H2O === H2SO3
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
酸雨及其治理
酸雨的防治
对SO2废气进行处理或回收利用。
消除污染源,研究开发新能源(如太阳能、核能、氢能等)。
对含硫燃料进行脱硫处理。
1
2
3
酸雨及其治理
SO2的处理回收
烧碱溶液
熟石灰
实验室中
工业上
SO2+2NaOH==
Na2SO3+H2O
SO2+Ca(OH)2===CaSO3+H2O
生石灰
SO2+CaO===CaSO3
海水吸收
工艺简单,节约资源,
但对海洋环境的影响尚需进一步评估
酸雨及其治理
SO2的处理回收-烟气脱硫
该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂泵入吸收塔,与烟气充分接触混合并氧化,最终生成石膏(CaSO4·2H2O)。脱硫后的烟气经过除雾器除去雾滴,再经过换热器加热升温后,由烟囱排入大气。
石灰石-石膏法
CaCO3 + SO2=CaSO3 + CO2
2CaSO3 + O2=2CaSO4
酸雨及其治理
SO2的处理回收-烟气脱硫
氨脱硫法是一个酸碱中和反应和氧化还原反应相结合的过
程,在脱硫塔内气、液、固多组分混合。
氨脱硫法
2NH3 + H2O + SO2=(NH4)2SO3
2(NH4)2SO3 + O2=2(NH4)2SO4
空气质量评价
空气质量指数(AQI)
空气质量指数越小,空气质量越好,对人体健康的危害就越小。
空气质量指数是根据空气中的细颗粒物(PM2.5)、可吸入颗粒物(PM10)、二氧化硫、二氧化氮、臭氧和一氧化碳的浓度计算出来的数值。
空气质量评价
空气质量指数(AQI)确定方法
空气质量监测人员测出空气质量指数中这六大污染物的浓度,再换算成它们的质量指数,其中指数最大的污染物会被确定为首要污染物,首要污染物的质量指数即为该地区的空气质量指数。
首要污染物
空气质量评价
大量极细微的颗粒物均匀地悬浮在空中,这些颗粒物容易吸附空气中的水蒸气形成雾滴,使空气水平能见度小于10_km,我们把这种空气混浊现象叫作雾霾。
雾霾
颗粒物分类依据
颗粒物直径的大小
空气质量评价
雾霾
颗粒物分类
细颗粒物(PM2.5,直径小于2.5 μm)
可吸入颗粒物(PM10,直径小于10 μm)
空气中的SO2在一定条件下形成CaSO4,硫酸盐在PM2.5中所占比例较大。
空气质量评价
雾霾
空气质量评价
大气污染的防治
提高污染排放标准
改变能源结构
控制SO2等有害
气体的排放
延时符
课堂小结
01
02
自然界中的硫循环
酸雨及其治理
03
空气质量评价
课堂练习
形成酸雨的原理之一可简示为
回答下列问题:
(1)A物质的化学式为_____,B物质的化学式为____。
(2)洗涤含SO2的烟气,以下物质可作洗涤剂的是___ (填字母)
a.Ca(OH)2 b.Na2CO3
c.CaCl2 d.NaHSO3
SO2
SO3
ab
课堂练习
(3)利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是__________________。
(4)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出有关反应的两个化学方程式:_________________________________________________________。
SO2
SO2+Ca(OH)2===CaSO3+H2O,2CaSO3+O2+2H2O
===2CaSO4·2H2O
