2023-2024学年高中化学苏教版2019必修第一册 5-1-2元素周期律和元素周期表(第2课时 元素周期表) 课件(37张)
文档属性
| 名称 | 2023-2024学年高中化学苏教版2019必修第一册 5-1-2元素周期律和元素周期表(第2课时 元素周期表) 课件(37张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 52.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 13:14:36 | ||
图片预览






文档简介
(共37张PPT)
专题五第一单元
元素周期律和元素周期表
02
元素周期表
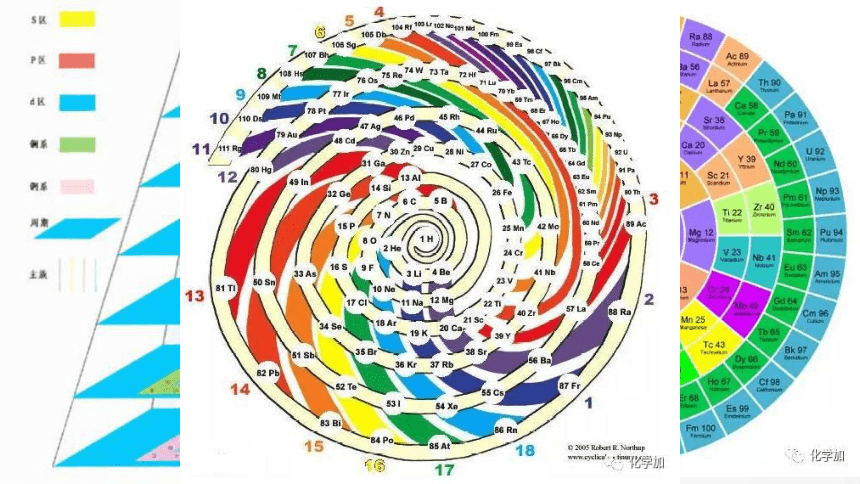
百变星君——元素周期表
祖师级 元素周期表
NIST(美国国家标准与技术研究院) 标准版元素周期表
IUPAC(国际纯粹与应用化学联合会)版 元素周期表
立体版 元素周期表
图标版 元素周期表
原子轨道版
元素周期表
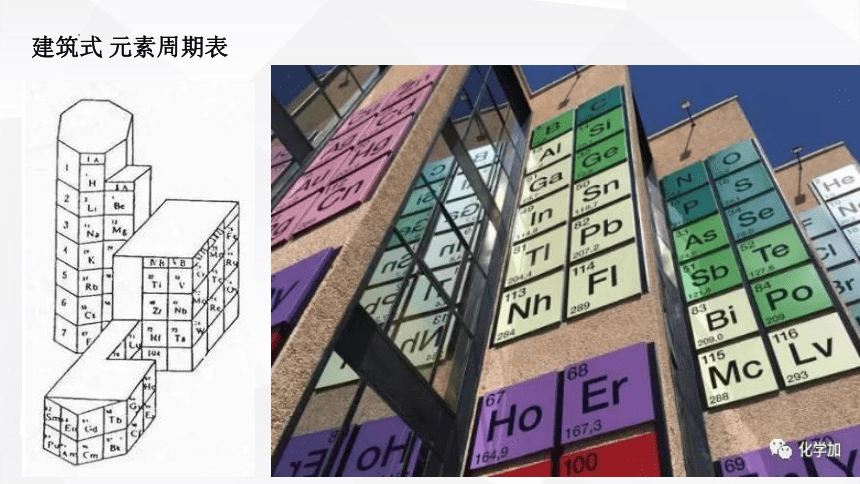
建筑式 元素周期表
沈阳街头的 元素周期表
默写版 元素周期表
元素周期表
长周期
周期
每一周期中元素的电子层数相同,即周期序数=电子层数。
短周期
元素周期表
短周期 长周期
电子层数 1 2 3 4 5 6 7
周期序数 __ __ __ __ __ __ __
元素种数 __ __ __ ___ ___ ___ ___
起止原子序数 __ ↓ __ __ ↓ ___ ___ ↓ ___ ___ ↓ ___ ___ ↓ ___ ___ ↓ ___ ___
↓
___
1
2
3
4
5
6
7
2
8
8
18
18
32
32
1
2
3
10
11
18
19
36
37
54
55
86
87
118
元素周期表
元素周期表
族
列序号 1 2 13 14 15 16 17
最外层电子数 __ __ __ __ __ __ __
族序数 ____ ____ _____ ____ _____ ____ _____
主族:共7个,用A表示。
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
主族的序数=最外层电子数
元素周期表
元素周期表
族
副族:共7个,用B表示。
完全由长周期元素构成。
3
4
5
6
7
11
12
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
列序号 __ __ __ __ __ __ __
族序数 ____ ____ ____ ____ ____ ____ ____
元素周期表
Ⅷ族
0族
为什么我们将稀有气体元素称为0族元素?
思考
稀有气体很稳定,它们的化合价通常情况下为0。
七主、七副、零八族
元素周期表结构口诀:
元素周期表
碱金属
卤素
碱金属元素
碱金属
Li
Na
K
Rb
Cs
相似性:最外层均有1个电子
递变性:
从Li到Cs随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
碱金属元素
2R+2H2O===2ROH+H2↑
2R+2H+===2R++H2↑
碱金属化学性质:
②碱金属的最高价氧化物(R2O)对应的水化物(ROH),一般都具有强碱性。
碱金属元素
碱金属 Li Na K Rb Cs
与水反应的现象 反应较为缓和,锂浮在水面,并以稳定、适中的速度释放出气体 反应迅速并放热,钠融化成小球 反应迅速,伴有燃烧,轻微爆炸 剧烈反应,发生爆炸 剧烈反应,发生剧烈爆炸
碱金属元素
剧烈
易
强
强
剧烈
增强
卤族元素
卤素
F2
Cl2
Br2
I2
卤族元素
F
Cl
Br
I
相似性:最外层均有7个电子
递变性:
从F到I随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
卤族元素化学性质:
卤族元素
卤族元素
卤族元素
2Br-+Cl2===2Cl-+Br2
2I-+Cl2===2Cl-+I2
2I-+Br2===2Br-+I2
结论:Cl2、Br2、I2单质的氧化性由强到弱的顺序是 ,相应阴离子的还原性由强到弱的顺序是 。
Cl2>Br2>I2
I->Br->Cl-
元素周期表应用
元素周期表
1.同主族元素的原子结构与性质的关系
2.同周期元素的原子结构与性质的关系
延时符
课堂小结
01
02
元素周期表
碱金属元素
03
卤族元素
课堂练习
请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:
(1)标出族序数。
(2)填入1~20元素的元素符号。
(3)填入稀有气体元素的原子序数以及每周期的元素种类。
(4)画出主族与副族边界线。
课堂练习
专题五第一单元
元素周期律和元素周期表
02
元素周期表
百变星君——元素周期表
祖师级 元素周期表
NIST(美国国家标准与技术研究院) 标准版元素周期表
IUPAC(国际纯粹与应用化学联合会)版 元素周期表
立体版 元素周期表
图标版 元素周期表
原子轨道版
元素周期表
建筑式 元素周期表
沈阳街头的 元素周期表
默写版 元素周期表
元素周期表
长周期
周期
每一周期中元素的电子层数相同,即周期序数=电子层数。
短周期
元素周期表
短周期 长周期
电子层数 1 2 3 4 5 6 7
周期序数 __ __ __ __ __ __ __
元素种数 __ __ __ ___ ___ ___ ___
起止原子序数 __ ↓ __ __ ↓ ___ ___ ↓ ___ ___ ↓ ___ ___ ↓ ___ ___ ↓ ___ ___
↓
___
1
2
3
4
5
6
7
2
8
8
18
18
32
32
1
2
3
10
11
18
19
36
37
54
55
86
87
118
元素周期表
元素周期表
族
列序号 1 2 13 14 15 16 17
最外层电子数 __ __ __ __ __ __ __
族序数 ____ ____ _____ ____ _____ ____ _____
主族:共7个,用A表示。
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
主族的序数=最外层电子数
元素周期表
元素周期表
族
副族:共7个,用B表示。
完全由长周期元素构成。
3
4
5
6
7
11
12
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
列序号 __ __ __ __ __ __ __
族序数 ____ ____ ____ ____ ____ ____ ____
元素周期表
Ⅷ族
0族
为什么我们将稀有气体元素称为0族元素?
思考
稀有气体很稳定,它们的化合价通常情况下为0。
七主、七副、零八族
元素周期表结构口诀:
元素周期表
碱金属
卤素
碱金属元素
碱金属
Li
Na
K
Rb
Cs
相似性:最外层均有1个电子
递变性:
从Li到Cs随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
碱金属元素
2R+2H2O===2ROH+H2↑
2R+2H+===2R++H2↑
碱金属化学性质:
②碱金属的最高价氧化物(R2O)对应的水化物(ROH),一般都具有强碱性。
碱金属元素
碱金属 Li Na K Rb Cs
与水反应的现象 反应较为缓和,锂浮在水面,并以稳定、适中的速度释放出气体 反应迅速并放热,钠融化成小球 反应迅速,伴有燃烧,轻微爆炸 剧烈反应,发生爆炸 剧烈反应,发生剧烈爆炸
碱金属元素
剧烈
易
强
强
剧烈
增强
卤族元素
卤素
F2
Cl2
Br2
I2
卤族元素
F
Cl
Br
I
相似性:最外层均有7个电子
递变性:
从F到I随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
卤族元素化学性质:
卤族元素
卤族元素
卤族元素
2Br-+Cl2===2Cl-+Br2
2I-+Cl2===2Cl-+I2
2I-+Br2===2Br-+I2
结论:Cl2、Br2、I2单质的氧化性由强到弱的顺序是 ,相应阴离子的还原性由强到弱的顺序是 。
Cl2>Br2>I2
I->Br->Cl-
元素周期表应用
元素周期表
1.同主族元素的原子结构与性质的关系
2.同周期元素的原子结构与性质的关系
延时符
课堂小结
01
02
元素周期表
碱金属元素
03
卤族元素
课堂练习
请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:
(1)标出族序数。
(2)填入1~20元素的元素符号。
(3)填入稀有气体元素的原子序数以及每周期的元素种类。
(4)画出主族与副族边界线。
课堂练习
