专题6金属及其化合物(含解析) ——2022-2023年四川省中考化学试题分类
文档属性
| 名称 | 专题6金属及其化合物(含解析) ——2022-2023年四川省中考化学试题分类 |  | |
| 格式 | doc | ||
| 文件大小 | 348.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 12:25:03 | ||
图片预览




文档简介
专题6金属及其化合物——2022-2023年四川省中考化学试题分类
一.选择题(共15小题)
1.(2022 甘孜州)在下列条件下,铁钉最容易生锈的是( )
A.在干燥的空气中 B.浸没在蒸馏水中
C.浸没在植物油中 D.在潮湿的空气中
2.(2023 眉山)中华传统文化博大精深,很多成语、诗词和谚语中蕴含着丰富的科学道理。下列说法错误的是( )
A.“木已成舟”与“铁杵成针”都属于化学变化
B.“遥知不是雪,为有暗香来”体现了分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“冰,水为之,而寒于水”体现了物质的状态不同,物理性质不同
3.(2022 眉山)空气是一种宝贵的自然资源。下列有关空气的说法正确的是( )
A.氮气约占空气体积的21%
B.空气污染指数越高,空气质量越好
C.铁在潮湿的空气中易生锈而铝不易生锈,说明铁的金属活动性比铝强
D.食品在空气中因与氧气发生缓慢氧化而变质
4.(2022 攀枝花)推理是化学学习中重要的思维方法。下列推理合理的是( )
A.熔点:铅>锡,则焊锡(锡铅合金)的熔点在铅与锡之间
B.金属活动性:Al>Fe,则在空气中铝比铁更容易被腐蚀
C.沸点:液氧>液氮,则将液态空气升温,氮气先蒸发出来
D.导电性:Ag>Cu,则应该用银替代铜广泛用作输电导线
5.(2022 雅安)下列物品所使用的主要材料属于金属材料的是( )
A.陶瓷餐具 B.纯棉衬衫 C.塑料水杯 D.不锈钢炊具
6.(2023 宜宾)将一定量的锌粉加入盛有AgNO3溶液的烧杯中,不断搅拌,充分反应后过滤,得到滤渣和滤液,向滤渣中加入足量稀盐酸,搅拌,滤渣部分溶解,有气泡产生,下列说法错误的是( )
A.滤渣中有Zn和Ag
B.金属活动性:Zn>Ag
C.滤液中含Zn(NO3)2和AgNO3
D.上述过程中只发生置换反应
7.(2023 凉山州)以下能正确表示对应叙述的图像是( )
A.电解水时生成H2和O2的质量与时间的关系
B.两份相同的H2O2溶液在有无MnO2的条件下分解
C.充分高温煅烧一定质量的木炭和氧化铜的混合物
D.分别向等质量的铁粉和锌粉中逐滴加入相同浓度的稀盐酸至过量
8.(2023 内江)金属材料在人类活动中有着广泛的应用。下列有关说法正确的是( )
A.合金中只含金属元素
B.金能压成很薄的片,说明金的熔点高
C.在铁锅表面涂油,可减缓钢铁的锈蚀
D.铁能从ZnSO4、CuSO4的溶液中置换出锌和铜
9.(2023 自贡)现有体积大小相同的三种金属X、Y、Z,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,Y、Z反应生成氢气的质量与反应时间的关系如图所示。X、Y、Z的金属活动性顺序正确的是( )
A.X>Y>Z B.X>Z>Y C.Y>Z>X D.Z>Y>X
10.(2023 泸州)下表为某核心期刊刊文中氢气制备对比实验的数据(将锌粒压成薄锌片增大了表面积)。下列不能由实验得出的结论是( )
编号 20mL硫酸的质量分数 1g锌的形状 0~3min产生氢气体积(mL)
① 20% 锌粒 31.7
② 20% 薄锌片 50.9
③ 30% 锌粒 61.7
④ 30% 薄锌片 79.9
A.Zn是金属活动顺序表中氢前金属
B.锌粒产生氢气的体积总是比薄锌片少
C.增大硫酸的质量分数能加快产生氢气
D.增大锌与酸的接触面积能加快产生氢气
11.(2022 自贡)现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )
A.Cu>X>Y B.X>Cu>Y C.X>Y>Cu D.Y>X>Cu
12.(2022 绵阳)现有质量和形状均相同的X、Y、Z三种金属,将X、Y分别放入CuSO4溶液中,只有Y的表面产生红色固体;又将Y、Z分别放入等浓度的稀盐酸中,后者产生气泡比前者快。由此判断,几种金属的活动性顺序为( )
A.Z>Y>Cu>X B.Z>Cu>Y>X C.Y>Z>X>Cu D.Y>Z>Cu>X
13.(2022 内江)向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是( )
A.滤液中一定含有Cu(NO3)2
B.滤液呈无色
C.滤渣只含有Ag
D.向滤渣中滴加稀硫酸有气泡产生
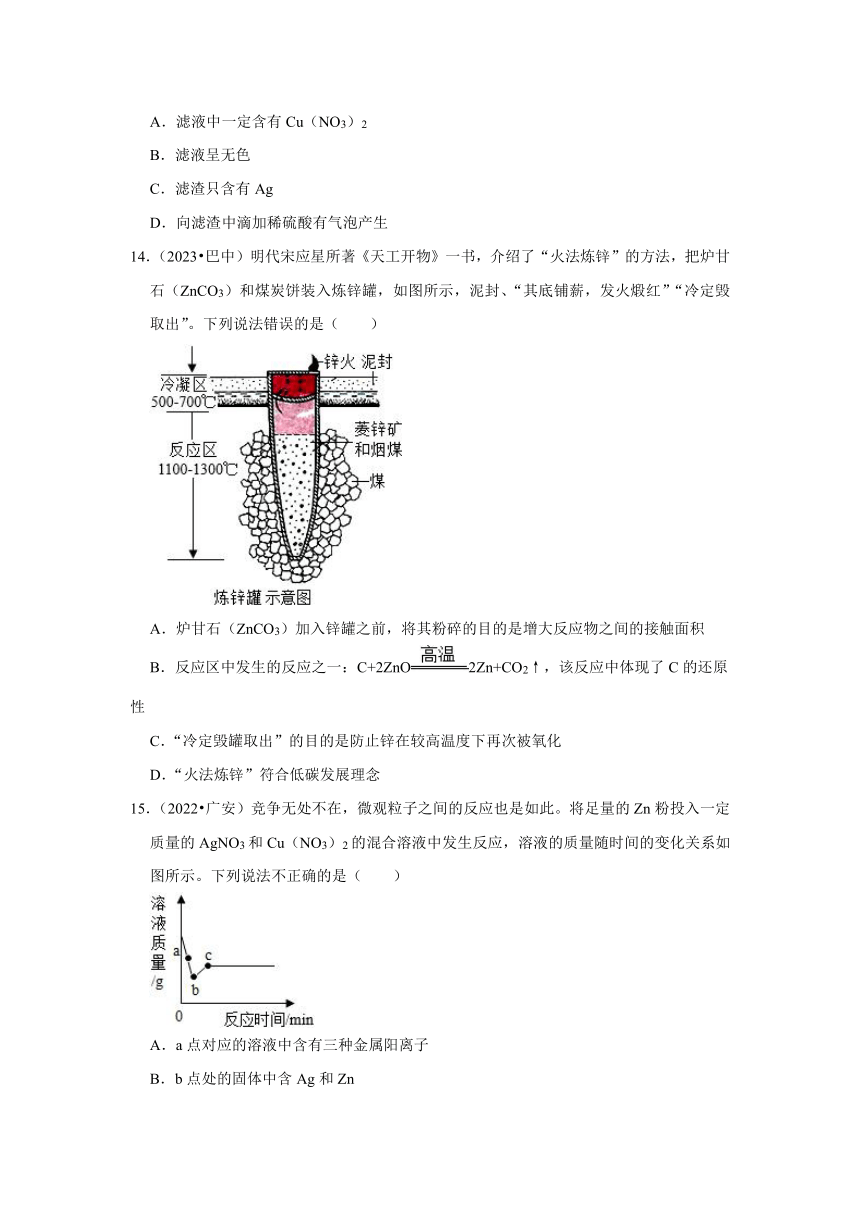
14.(2023 巴中)明代宋应星所著《天工开物》一书,介绍了“火法炼锌”的方法,把炉甘石(ZnCO3)和煤炭饼装入炼锌罐,如图所示,泥封、“其底铺薪,发火煅红”“冷定毁取出”。下列说法错误的是( )
A.炉甘石(ZnCO3)加入锌罐之前,将其粉碎的目的是增大反应物之间的接触面积
B.反应区中发生的反应之一:C+2ZnO2Zn+CO2↑,该反应中体现了C的还原性
C.“冷定毁罐取出”的目的是防止锌在较高温度下再次被氧化
D.“火法炼锌”符合低碳发展理念
15.(2022 广安)竞争无处不在,微观粒子之间的反应也是如此。将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中发生反应,溶液的质量随时间的变化关系如图所示。下列说法不正确的是( )
A.a点对应的溶液中含有三种金属阳离子
B.b点处的固体中含Ag和Zn
C.取少量b点处的溶液于试管中,滴加稀盐酸会有沉淀出现
D.溶液先不变色,一段时间后由蓝色逐渐变为无色
二.填空题(共6小题)
16.(2023 广安)化学在保证人类生存并不断提高生活质量方面起着重要的作用。利用化学综合应用自然资源和保护环境,使人类生活变得更加美好。
(1)煤和石油是目前使用较多的两种能源,下列有关它们的说法不正确的是 (填字母序号)。
A.煤和石油都是混合物
B.煤和石油综合利用的产品都有医药、炸药等
C.煤和石油都是不可再生能源
D.煤和石油的燃烧对环境都有害,应禁止使用
(2)新能源汽车是未来汽车的发展方向。制造新能源汽车所用到的材料有:钢、塑料、铝合金、合成橡胶等,其中钢和铝合金属于 材料,相对于传统的燃油汽车,新能源汽车的优点是 (任答一点即可)。
(3)“可燃冰”外观像“冰”,是尚未大量开发的新能源,主要含甲烷水合物(CH4 xH2O)。某甲烷水合物充分燃烧的化学方程式为CH4 xH2O+2O2CO2+10H2O,则CH4 xH2O中x的值为 。
17.(2023 南充)金属是重要的资源,在人类文明的发展中起着重要作用,回答下列问题:
(1)铜丝常用作导线,利用了铜具有良好的 性。
(2)生活中为了防止铁制品生锈,采取的措施有① (写一条即可),写出实验室用稀硫酸除铁锈的化学方程式② 。
(3)将一定质量的锌片和铜片加入到硝酸银溶液中,充分反应后过滤,得到滤渣和滤液,若滤液呈蓝色,则滤液中一定含有的溶质是 (填化学式)。
18.(2022 甘孜州)如图是工业炼铁的流程图,回答下列问题:
(1)炼铁高炉中产生的CO与赤铁矿(主要成分是Fe2O3 )反应的化学方程式为 。
(2)高炉烟气的主要成分是烟尘、CO、 、 (填化学式)。
(3)生铁和钢是两种含碳量不同的铁合金,其中含碳量更低的是 。
19.(2022 内江)如图所示,某兴趣小组用三枚洁净无锈铁钉探究铁生锈的条件。
(1)四天后, (填字母序号)试管中铁钉有明显锈迹。
(2)由此实验可以得出铁生锈的条件是 。
20.(2022 广安)(1)氢气由于热值大、来源广、燃烧产物无污染,得到人们积极的开发和利用。请写出氢气在空气中燃烧的化学方程式 。
(2)碳元素可形成多种单质,如金刚石、石墨、C60,焦炭和活性炎的主要成分也是碳的单质。制糖工业的脱色制白糖、防毒面具里的滤毒罐等都使用了活性炭,这是利用了活性炭有较强的 性。
(3)铁合金有广泛的用途,碳元素含量越高,铁合金硬度就越大,则钢和生铁中硬度较大的是 。
(4)焦炭、CO是冶金工业重要的还原剂,请写出用赤铁矿(主要成分Fe2O3)和CO反应炼铁的化学方程式 。
(5)生活中有许多小窍门能让人们避开危险,减少损失,如炒菜时油锅中的油不慎着火,请举一种灭火的方法 。
21.(2022 眉山)大文豪苏轼是眉山人的骄傲,他作词“明月几时有?把酒问青天”,并幻想“我欲乘风归去”,而如今我国载人航天飞船已实现多次天地往返,飞天揽月早已不再是梦想。回答下列问题:
(1)“酒”的主要成分是 。
(2)液氢常用作航天飞船的燃料,液氢是氢气加压制得。用分子的观点解释能“加压”是因为 。氢气作为能源有很多优点,任写出其中一条 。
(3)载人航天飞船常使用合金材料,下列关于合金的说法正确的是 。
A.合金中只含金属元素
B.青铜的硬度比纯铜大
C.钛合金属于有机合成材料
D.钢的含碳量比生铁的高
三.实验题(共2小题)
22.(2023 成都)利用如图实验探究金属的化学性质。
(1)实验一:水的作用是 。实验中,观察到发出白光后铁丝并未燃烧,原因是 。
(2)实验二:两个反应均生成了 (填物质名称)。比较铁和铝的金属活动性强弱,从试剂角度需考虑:①加入同样大小的铁片和铝片;② 。
(3)实验三:反应的化学方程式为 。再补充一个实验可得出Cu、Fe、Ag的金属活动性顺序。设计并进行实验,补全下表。
实验步骤(可用图示) 实验现象 实验结论
23.(2022 成都)我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”如图1,该方法的生产过程可用图2表示。
资料:①潮泥灰主要成分是石灰石。②铁的熔点是1535℃。
根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和 (写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为 。
(4)撒入潮泥灰主要作用是 。不断翻炒液态生铁,是为了降低 元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁 ,易于加工。
四.计算题(共2小题)
24.(2023 凉山州)2022年12月,西昌至成都的城际动车组列车正式运行。高铁钢轨的制造需要大量铁矿石炼铁。现有含Fe3O4为80%的磁铁矿石2900t,求理论上可炼制纯铁的质量为多少?(提示:化学方程式为Fe3O4+4CO3Fe+4CO2)
25.(2023 眉山)磁铁矿石(主要成分为Fe3O4)是常用的炼铁原料,工业上可通过如下反应:Fe3O4+4CO3Fe+4CO2将其中的Fe3O4转化为Fe。
(1)Fe3O4中铁、氧的微观粒子数目之比为 ;
(2)假设炼铁过程中铁没有损耗,用含348吨Fe3O4的磁铁矿石理论上可以炼出含铁96%的生铁的质量是多少(写出计算过程)?
五.解答题(共4小题)
26.(2022 泸州)同学们观看央视《发现》《走进科学》节目后,对节目中介绍人类使用金属材料的年代及其背后的科学原理产生了兴趣,于是查阅Al、Cu、Fe、Ag四种金属元素的信息形成下表资料。
元素编号 ① ② ③ ④
金属材料使用的大致年代 公元前7000年 公元前4000年 公元前2200年 公元1827年
在地壳中的含量/% 0.007 0.00001 4.75 7.73
请回答相关问题。
(1)我们的祖先很早就掌握了炼铜的工艺,最初他们将 (填化学式)和孔雀石[主要成分是Cu2(OH)2CO3]混合后加热就得到了红色的金属铜。
(2)Al元素的单质是在电发现之后,通过电解Al2O3才工业化生产的,则Al在表中的编号是 。
(3)大家发现金属材料使用年代的先后规律一般是:金属越活泼使用年代越迟。但上表中某元素因含量过低而出现了例外。综合分析,①、②、③元素依次是 。
27.(2022 泸州)2018年世界权威期刊《自然》,连刊两文报道石墨烯超导重大发现,论文的第一作者是四川成都籍中科大年轻博士曹原。下面让我们一起重走“超导材料”发现的神奇之路。请回答相关问题。
(1)1911年荷兰物理学家海克 卡莫林 昂内斯经过无数次实验确认;汞在温度接近﹣273℃时几乎处于“零电阻状态”,称之为“超导电性”。汞属于 元素(填“金属”或“非金属”),其导电的原因是含有自由移动的 。
(2)1980年有人发现了铜氧化合物的“超导电性”,将温度提高到约为﹣140℃。YBa2Cu3O5为其代表之一,其中Cu为+1价,О为﹣2价,则Y为 价。
(3)2017年曹原团队发现了石墨烯中的非规“超导电性”,石墨烯是一层碳原子(如图,黑球代表碳原子)。
①曹原推测,当两层石墨烯叠在一起,若彼此之间发生轻微偏移时,有可能产生超导现象,经过不懈努力,困扰世界107年的常温超导难题,终于被曹原团队突破!石墨烯属于 (填“单质”或“化合物”),两层石墨烯叠在一起轻微偏移时发生的是 变化(填“物理”或“化学”)。
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银。该实验是否产生了氢气? (填“是”或“否”),原因是 。我们坚信未来的中国,必定有十个、百个乃至成千上万个“曹原”,用自己的科技之梦去推动中华民族的伟大复兴。
28.(2022 南充)日常生活用品很多是由金属材料制成的。
(1)三星堆出土的文物使用了贴金技艺,贴金技艺利用了金具有良好的 性,将黄金锤成极薄的薄片。
(2)铝的化学性质很活泼,通常铝制品却很耐腐蚀,原因是 (用化学方程式表示)。
(3)春秋战国时期,我国就开始生产和使用铁器。古法炼铁的原理包含一氧化碳与氧化铁在高温下反应,反应的化学方程式是 。
(4)将一定质量的锌粒投入到含有CuSO4和FeSO4的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则滤渣中一定含有 。
29.(2022 达州)钢铁是应用最普遍的金属材料,也是最容易发生锈蚀的金属材料之一。人类为金属的锈蚀付出了巨大的代价,所以金属的防腐和废旧金属的回收有着十分重要的意义。
(1)工业上用赤铁矿(主要成分Fe2O3)炼铁的原理: (用化学方程式表示)。
(2)钢铁生锈是铁与空气中 发生化学反应的结果。
(3)处理某废旧金属后的溶液中含有Cu(NO3)2和AgNO3两种溶质,为回收其中的金属,向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生。则滤液中一定含有的金属离子是 ;滤渣中可能含有 。
六.工艺流程题(共1小题)
30.(2022 攀枝花)废旧手机的电路板中主要含有铜,还含有少量铝、铁、金等金属。某学习小组为回收其中的铜、金,进行了如下实验。
已知:Cu+H2O2+H2SO4═CuSO4+2H2O;本实验条件下,金不发生反应。
回答下列问题:
(1)滤液A中的溶质除H2SO4外,还含有的溶质化学式分别是 、 。
(2)小组同学在步骤Ⅱ中发现:部分H2O2分解导致实际消耗的H2O2用量明显大于理论用量。导致部分H2O2分解的原因可能是 。
(3)固体D的成分是 。
(4)向滤液G中加入过量NaOH溶液,反应生成沉淀的化学方程式是 。
七.科普阅读题(共1小题)
31.(2022 攀枝花)阅读短文,回答下列问题。
锂(Li)是最轻的金属,化学性质较为活泼,能与氢、氧、氮、硫及氯的单质反应,可用于除去氦、氩中的氮气,能与水反应生成氢氧化锂和氢气。
锂几乎能与所有金属熔合,形成各种性能优异的合金,如:铜中添加少量锂,机械性能更好,且不降低导电性能;锂铍合金超轻(密度仅为1~1.5g/cm3),硬度大且耐腐蚀;锂是冶炼有色金属合金的不可替代的脱氧剂。氢氧化锂(LiOH)可做二氧化碳吸收剂。
工业上常用无水氯化锂为原料,熔融后电解制得金属锂。
(1)锂铍合金的硬度 (选填“大于”或“小于”)锂。
(2)锂着火时 (选填“能”或“不能”)用水灭火。
(3)“天和”核心舱中用氢氧化锂吸收二氧化碳,反应的化学方程式是 。
(4)电解制得的液态锂冷却时,下列气体可以作为保护气的是 (填选项编号)。
A.氢气
B.氮气
C.氧气
D.氩气
参考答案与试题解析
一.选择题(共15小题)
1.【解答】解;A、干燥的空气中缺少水,铁钉不容易生锈,故A错误;
B、浸没在蒸馏水中缺少氧气,铁钉不容易生锈,故B错误;
C、浸没在植物油中的铁钉,与水和氧气隔绝,不容易生锈,故C错误;
D、在潮湿的空气中,铁钉与水和氧气同时接触,容易生锈,故D正确;
故选:D。
2.【解答】解:A、“木已成舟”与“铁杵成针”都只是物质形状的改变,都没有生成新物质,均属于物理变化,说法错误;
B、“遥知不是雪,为有暗香来”体现了分子在不断地运动,说法正确;
C、“真金不怕火炼”说明黄金的化学性质非常稳定,说法正确;
D、“冰,水为之,而寒于水”体现了物质的状态不同,物理性质不同,说法正确。
故选:A。
3.【解答】解:A、氮气约占空气体积的78%,氧气约占空气体积的21%,故A错误;
B、空气污染指数越高,空气质量越差,故B错误;
C、铝比铁活泼,铝制品不易生锈的原因是常温下,铝易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止内部的铝进一步被氧化,故C错误;
D、氧气具有氧化性,食品在空气中因与氧气发生缓慢氧化而变质,故D正确。
故选:D。
4.【解答】解:A、一般合金的熔点低于其组成中纯金属的硬度,因此焊锡(锡铅合金)的熔点低于铅与锡的熔点,推理错误;
B、铝的化学性质活泼,在常温下易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止内部的铝进一步氧化,推理错误;
C、液氮的沸点低于液氧的沸点,因此将液态空气升温,氮气先蒸发出来,推理正确;
D、导电性:Ag>Cu,但银的价格较强,不能用银替代铜广泛用作输电导线,推理错误。
故选:C。
5.【解答】解:A、陶瓷是一种无机非金属材料,不合题意;
B、纯棉衬衫是由棉花制成的,棉花属于天然材料,不合题意;
C、塑料是一种有机合成材料,不合题意;
D、不锈钢是一种铁合金,属于金属材料,符合题意。
故选:D。
6.【解答】解:A、将一定量的锌粉加入盛有AgNO3溶液的烧杯中,不断搅拌,锌与硝酸银反应生成硝酸锌和银,不断搅拌,充分反应后过滤,得到滤渣和滤液,向滤渣中加入足量稀盐酸,搅拌,滤渣部分溶解,有气泡产生,由于银不与稀盐酸反应,说明滤渣中含有锌,说明加入的锌是过量的,则滤渣中有Zn和Ag,故选项说法正确。
B、锌能与硝酸银溶液反应,说明金属活动性:Zn>Ag,故选项说法正确。
C、由于锌是过量的,则滤液中含Zn(NO3)2,不可能含有AgNO3,故选项说法错误。
D、上述过程中只发生了锌和硝酸银反应生成硝酸锌和银、锌和稀盐酸反应生成氯化锌和氢气,均属于置换反应,故选项说法正确。
故选:C。
7.【解答】解:A、电解水时生成氢气与氧气的体积比为2:1,而不是质量比,图示错误;
B、两份相同的H2O2溶液在有无MnO2的条件下分解,加入二氧化锰的反应速率更快,但最终生成氧气的质量相等,图示错误;
C、在高温的条件下,碳与氧化铜反应生成铜和二氧化碳,随着反应的进行,固体质量减少,但固体不会变成零,当反应结束时,固体质量不再改变,图示错误;
D、分别向等质量的锌粉和铁粉中加入同浓度的稀盐酸,反应开始时,金属都有剩余,酸相同且不足量,所以产生氢气的质量相等,两条线一致,不断加入酸,金属完全反应后,铁生成氢气的质量更大,图示正确。
故选:D。
8.【解答】解:A、合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金中不是只含金属元素,还可能含有非金属元素,故选项说法错误。
B、金能压成很薄的片,说明金具有良好的延展性,故选项说法错误。
C、铁生锈实际上是铁与氧气、水等发生化学反应的过程,在铁锅表面涂油,隔绝氧气和水,可减缓钢铁的锈蚀,故选项说法正确。
D、锌、铁、铜三种金属活动性:锌>铁>铜,铁能置换出CuSO4的溶液中的铜,不能置换出ZnSO4的溶液中锌,故选项说法错误。
故选:C。
9.【解答】解:现有体积大小相同的三种金属X、Y、Z,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,说明X的位置排在氢的后面。
Y、Z能与稀硫酸反应,则说明Y、Z的位置排在氢的前面。
由Y、Z反应生成氢气的质量与反应时间的关系图,至完全反应,Z所需时间短,则Z的金属活动性比Y强。
故X、Y、Z的金属活动性顺序是Z>Y>X。
故选:D。
10.【解答】解:A、Zn是金属活动顺序表中氢前金属,故选项说法正确。
B、由实验②③对比可知,锌粒产生氢气的体积不是总是比薄锌片少,故选项说法错误。
C、增大硫酸的质量分数,反应物的浓度增大,能加快产生氢气,故选项说法正确。
D、增大锌与酸的接触面积,能加快产生氢气,故选项说法正确。
故选:B。
11.【解答】解:现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应,说明X的位置排在氢的前面,Y的位置排在氢的后面,即X>H>Y;
如果把Y放入到硝酸铜溶液中,无任何现象,说明Y的金属活动性比铜弱,即铜>Y。
X的位置排在氢的前面,则X、Y、Cu的金属活动性强弱顺序是X>Cu>Y。
故选:B。
12.【解答】解:将X、Y分别放入CuSO4溶液中,只有Y的表面产生红色固体,说明Y能与硫酸铜反应,Y比铜活泼,X与硫酸铜不反应,说明铜比X活泼;又将Y、Z分别放入等浓度的稀盐酸中,后者产生气泡比前者快,说明在金属活动性顺序里,Y、Z排在氢前,且Z比Y活泼,故几种金属的活动性顺序为:Z>Y>Cu>X。
故选:A。
13.【解答】解:A、铜的金属活动性比银强,过量铜粉的能与硝酸银反应生成硝酸铜和银,则滤液中一定含有Cu(NO3)2,故选项说法正确。
B、铜的金属活动性比银强,过量铜粉能与硝酸银反应生成硝酸铜和银,滤液是Cu(NO3)2溶液,滤液呈蓝色,故选项说法错误。
C、铜的金属活动性比银强,过量铜粉能与硝酸银反应生成硝酸铜和银,滤渣是银、铜的混合物,故选项说法错误。
D、滤渣是银、铜的混合物,向滤渣中滴加稀硫酸,均不反应,无明显现象,故选项说法错误。
故选:A。
14.【解答】解:A、炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的目的是增大反应物接触面积,反应更快、更充分,故正确。
B、C+2ZnO2Zn+CO2↑,该反应中C得到氧,体现还原性,故正确。
C、锌能与氧气在高温下反应会生成氧化锌,故“冷定”后方能“毁罐”取锌,其原因是防止生成的锌在较高温度下又被氧化成氧化锌,故正确。
D、“火法炼锌”过程中生成大量二氧化碳,不符合低碳发展理念,故错误。
故选:D。
15.【解答】解:将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中,锌会先与硝酸银反应,溶液质量减小,再与硝酸铜反应,质量增大。
A、a点对应的溶液质量没有减小到最小,所以硝酸银没有完全反应,含有锌、铜、银三种金属阳离子,故A正确;
B、b点处的溶液质量减小到最小,所以固体中含Ag和Zn,故B正确;
C、取少量b点处的溶液于试管中,滴加稀盐酸不会有沉淀出现,故C错误;
D、溶液先不变色,一段时间后由蓝色逐渐变为无色,故D正确。
故选:C。
二.填空题(共6小题)
16.【解答】解:(1)A.煤和石油都是由多种成分组成的物质,均属于混合物,故正确;
B.煤和石油综合利用的产品都有医药、炸药等,故正确;
C.煤和石油需要经历较长的时间才能形成,都是不可再生能源,故正确;
D.煤和石油的燃烧会产生对环境有危害的物质,但是人类的生产、生活都离不开,只能合理使用,不能禁止使用,故错误;
故选:D;
(2)钢和铝合金属于金属材料,相对于传统的燃油汽车,新能源汽车的优点是不污染环境等;
(3)根据质量守恒定律可知,反应前后原子的数目保持不变,根据化学方程式CH4 xH2O+2O2CO2+10H2O可知,氧原子守恒:x+4=2+10,x=8,即CH4 xH2O中x的值为8。
故答案为:
(1)D;
(2)金属;不污染环境(合理即可);
(3)8。
17.【解答】解:(1)铜丝常用作导线,利用了铜具有良好的导电性。
(2)为了防止钢铁的锈蚀,人们常采用在其表面刷漆、涂油或镀上其它金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水。
铁锈的主要成分是氧化铁,与硫酸反应生成硫酸铁和水,反应的化学方程式是:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O。
(3)锌、铜的金属活动性比银强,且锌的金属活动性比铜强,将一定质量的锌片和铜片加入到硝酸银溶液中,锌先与AgNO3溶液反应生成硝酸锌溶液和银,锌粉反应完,若还有AgNO3溶液,铜才能与AgNO3溶液反应生成硝酸铜溶液和银。充分反应后过滤,得到滤渣和滤液,若滤液呈蓝色,说明发生了铜和硝酸银溶液的反应,则滤液中一定含有的溶质是Zn(NO3)2、Cu(NO3)2,可能含有AgNO3。
故答案为:
(1)导电;
(2)刷漆;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)Zn(NO3)2、Cu(NO3)2。
18.【解答】解:(1)炼铁高炉中产生的CO与赤铁矿(主要成分是Fe2O3 )高温下反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O32Fe+3CO2;
(2)高炉炼铁的反应中,有二氧化碳气体产生,且空气中的氮气没有参加反应,因此高炉烟气的主要成分是烟尘、CO、CO2、N2;
(3)生铁含碳量为2%﹣4.3%,钢含碳量为0.03%﹣2%,因此含碳量更低的是钢;
故答案为:
(1)3CO+Fe2O32Fe+3CO2;
(2)CO2;N2;
(3)钢。
19.【解答】解:(1)a试管中的铁钉能与氧气、水充分接触;b试管中的铁钉只能与干燥的空气接触;c试管的铁钉只能与水接触;四天后,a试管中的铁钉生锈,另外两支试管的铁钉没有生锈。
(2)a试管中的铁钉能与氧气、水充分接触;b试管中的铁钉只能与干燥的空气接触;c试管的铁钉只能与水接触;四天后,a试管中的铁钉生锈,另外两支试管的铁钉没有生锈,由此实验可以得出铁生锈的条件是与氧气、水充分接触。
故答案为:
(1)a;
(2)与氧气、水充分接触。
20.【解答】解:(1)氢气和氧气在点燃的条件下生成水,化学方程式为:2H2+O22H2O;
(2)活性炭具有吸附性,能吸附色素和异味,制糖工业的脱色制白糖、防毒面具里的滤毒罐等都使用了活性炭,这是利用了活性炭有较强的吸附性;
(3)碳元素含量越高,铁合金硬度越大,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,生铁含碳量高,所以钢和生铁中硬度较大的是生铁;
(4)Fe2O3和CO在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO2Fe+3CO2;
(5)灭火的原理有三点:移除可燃物、隔绝氧气、降温至可燃物的着火点以下。炒菜时油锅中的油不慎着火,可以用锅盖盖灭,原理是隔绝氧气;
故答案为:
(1)2H2+O22H2O;
(2)吸附;
(3)生铁;
(4)Fe2O3+3CO2Fe+3CO2;
(5)用锅盖盖灭。
21.【解答】解:(1)“酒”是乙醇的水溶液,其主要成分是乙醇或酒精;故答案为:乙醇或酒精;
(2)液氢常用作航天飞船的燃料,液氢是氢气加压制得。用分子的观点解释能“加压”是因为氢气分子间有间隔,加压时分子间隔变小,氢气液化。氢气作为能源有很多优点,如燃烧产物只有水,无污染;制备氢气的原料来源广;热值高等;故答案为:氢气分子间有间隔,加压时分子间隔变小,氢气液化;无污染(或制备氢气的原料来源广或热值高);
(3)A.合金是在某种金属中加热熔合某些其它金属(或非金属),而形成的具有金属特性的物质,因此合金中不是只含金属元素,说法错误;
B.一般合金的硬度大于其组成的纯金属的硬度,因此青铜的硬度比纯铜大,说法正确;
C.钛合金属于金属材料,说法错误;
D.钢的含碳量比生铁的低,钢的含碳量为0.03%~2%,生铁的含碳量为2%~4.3%,说法错误;
故答案为:B。
三.实验题(共2小题)
22.【解答】解:(1)实验一:水的作用是防止生成物熔化溅落下来使瓶底炸裂。
实验中,观察到发出白光后铁丝并未燃烧,原因是火柴燃烧消耗了较多的氧气,使氧气不足。
(2)铁和稀盐酸反应生成氯化亚铁和氢气,铝和稀盐酸反应生成氯化铝和氢气,实验二:两个反应均生成了氢气。
除探究要素不同之外,其它条件都应该是相同的,比较铁和铝的金属活动性强弱,从试剂角度需考虑:①加入同样大小的铁片和铝片;②加入等体积等浓度的稀盐酸。
(3)实验三中铜和硝酸银反应生成硝酸铜和银,反应的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag。
再补充一个实验可得出Cu、Fe、Ag的金属活动性顺序,还需证明铁的金属活动性比铜强。可取少量硫酸亚铁溶液于试管中,伸入铜丝,无明显变化,说明铁的金属活动性比铜强,图示为(合理即可)。
故答案为:
(1)防止生成物熔化溅落下来使瓶底炸裂;火柴燃烧消耗了较多的氧气,使氧气不足;
(2)氢气;加入等体积等浓度的稀盐酸;
(3)Cu+2AgNO3=Cu(NO3)2+2Ag; (合理即可)。
23.【解答】解:(1)常见的铁矿石有赤铁矿和磁铁矿或菱铁矿(合理即可);
(2)不断鼓入空气的目的是使碳与氧气反应,放热,提高炉温;
(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:Fe2O3+3CO2Fe+3CO2。高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:Fe3O4+4CO3Fe+4CO2;
(4)撒入潮泥灰主要作用是将铁矿石中的二氧化硅转化为炉渣而除去,生铁和钢的区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量得到钢。
(5)合金的熔点低于组成它的纯金属,钢的熔点比纯铁低,易于加工。
故答案为:(1)磁铁矿(合理即可);
(2)提高炉温;
(3)Fe2O3+3CO2Fe+3CO2或Fe3O4+4CO3Fe+4CO2;
(4)将铁矿石中的二氧化硅转化为炉渣而除去;碳或C;
(5)低。
四.计算题(共2小题)
24.【解答】解:设理论上可炼制纯铁的质量为x。
Fe3O4+4CO3Fe+4CO2
232 168
2900t×80% x
x=1680t
答:理论上可炼制纯铁的质量为1680t。
25.【解答】解:(1)由化学式可知,Fe3O4中铁、氧的微观粒子数目之比为3:4。
故答案为:3:4。
(2)设理论上可以炼出含铁96%的生铁的质量为x。
Fe3O4+4CO3Fe+4CO2
232 168
348t 96%x
x=262.5t
答:理论上可以炼出含铁96%的生铁的质量为262.5t。
五.解答题(共4小题)
26.【解答】解:(1)木炭具有还原性,我们的祖先很早就掌握了炼铜的工艺,最初他们将C和孔雀石[主要成分是Cu2(OH)2CO3]混合后加热就得到了红色的金属铜;
(2)铝是地壳中含量最多的金属元素,所以Al元素的单质是在电发现之后,通过电解Al2O3才工业化生产的,所以Al在表中的编号是④;
(3)大家发现金属材料使用年代的先后规律一般是:金属越活泼使用年代越迟。但上表中某元素因含量过低而出现了例外。综合分析,①、②、③元素依次是:铜、银、铁。
故答案为:(1)C;
(2)④;
(3)铜、银、铁。
27.【解答】解:(1)汞属于金属元素;其导电的原因是含有自由移动的电子;
(2)YBa2Cu3O5为其代表之一,其中Cu为+1价,О为﹣2价,钡元素显+2价,是由Y为+3价;
(3)①石墨烯是由同种元素组成的纯净物,属于单质;两层石墨烯叠在一起轻微偏移时没有新物质生成,发生的是物理变化;
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银,硝酸具有强氧化性,硝酸和银反应生成硝酸银、一氧化氮或二氧化氮和水,该实验不产生了氢气;原因是:银的金属活动性排在氢的后面。
故答案为:(1)金属;电子;
(2)+3;
(3)①单质;物理;
②否;银的金属活动性排在氢的后面。
28.【解答】解:(1)将黄金锤成极薄的薄片,是因为金具有良好的延展性;
(2)铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,反应的化学方程式为:4Al+3O2═2Al2O3;
(3)在高温下,一氧化碳可以把氧化铁还原成铁,同时有二氧化碳气体生成,化学反应式是:Fe2O3+3CO2Fe+3CO2;
(4)将一定质量的锌粒投入到含有CuSO4和FeSO4的混合溶液中,锌先和硫酸铜反应,当硫酸铜完全反应后,锌再和硫酸亚铁反应,充分反应后过滤,若滤液中只含有一种溶质,则溶质是硫酸锌,说明硫酸铜、硫酸亚铁和锌完全反应,则滤渣中一定含有铜和铁,可能含有锌。
故答案为:(1)延展;
(2)4Al+3O2═2Al2O3;
(3)Fe2O3+3CO2Fe+3CO2;
(4)Fe、Cu (或铁、铜)。
29.【解答】解:(1)赤铁矿的主要成分是氧化铁,工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO2Fe+3CO2。
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气、水蒸气共同作用的结果。
(3)铁的金属活动性比银、铜强,在硝酸银、硝酸铜的混合溶液中加入一定量铁粉,铁先与硝酸银溶液反应生成硝酸亚铁溶液和银,硝酸银反应完,若还有铁粉,铁才能与硝酸铜溶液反应生成硝酸亚铁溶液和铜。向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生,说明滤渣中不含铁,一定含有银,可能含有铜,则滤液中一定含有的金属离子是亚铁离子。
故答案为:
(1)Fe2O3+3CO2Fe+3CO2;
(2)氧气、水蒸气;
(3)亚铁离子;铜。
六.工艺流程题(共1小题)
30.【解答】解:(1)结合电路板成分分析,铝与稀硫酸反应生成硫酸铝和氢气,铁与稀硫酸反应生成硫酸亚铁和氢气,因此滤液A中的溶质除硫酸外,还含有硫酸铝、硫酸亚铁。
(2)硫酸铜可加快过氧化氢分解速率,步骤II中铜与过氧化氢、硫酸反应生成的硫酸铜溶液加快了过氧化氢分解,且反应放热使溶液温度升高也能加快过氧化氢的分解。
(3)滤渣B为金、铜混合物,根据已知中的反应分析,可知步骤II中铜全部反应,过滤所得固体D为金。
(4)滤液C为硫酸铜溶液,步骤Ⅲ加入过量铁粉后,铁与硫酸铜反应生成硫酸亚铁和铜,滤渣F为铁,铜混合物,加入过量稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,滤液G为硫酸亚铁和过量稀硫酸的混合溶液,加入过量氢氧化钠溶液,生成沉淀的反应为硫酸亚铁与氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,据此写出反应的化学方程式为FeSO4+2NaOH=Na2SO4+Fe (OH) 2↓。
故答案为:(1)Al2(SO4)3;FeSO4;
(2)硫酸铜对过氧化氢的分解起到了催化作用(合理即可);
(3)金(或Au);
(4)FeSO4+2NaOH=Na2SO4+Fe (OH) 2↓。
七.科普阅读题(共1小题)
31.【解答】解:(1)一般合金的硬度大于其组成中纯金属的硬度,因此锂铍合金的硬度大于锂;故答案为:大于;
(2)锂能与水反应生成氢氧化锂和氢气,氢气具有可燃性,因此锂着火时不能用水灭火,以防发生爆炸;故答案为:不能;
(3)氢氧化锂吸收二氧化碳生成碳酸锂和水,化学方程式为2LiOH+CO2═Li2CO3+H2O;故答案为:2LiOH+CO2═Li2CO3+H2O;
(4)A.氢气化学性质活泼,不能用作保护气;
B.氮气可以与液态锂发生反应,不能用作保护气;
C.氧气化学性质活泼,不能用作保护气;
D.氩气化学性质稳定,可用作保护气;
故答案为:D。
一.选择题(共15小题)
1.(2022 甘孜州)在下列条件下,铁钉最容易生锈的是( )
A.在干燥的空气中 B.浸没在蒸馏水中
C.浸没在植物油中 D.在潮湿的空气中
2.(2023 眉山)中华传统文化博大精深,很多成语、诗词和谚语中蕴含着丰富的科学道理。下列说法错误的是( )
A.“木已成舟”与“铁杵成针”都属于化学变化
B.“遥知不是雪,为有暗香来”体现了分子在不断地运动
C.“真金不怕火炼”说明黄金的化学性质非常稳定
D.“冰,水为之,而寒于水”体现了物质的状态不同,物理性质不同
3.(2022 眉山)空气是一种宝贵的自然资源。下列有关空气的说法正确的是( )
A.氮气约占空气体积的21%
B.空气污染指数越高,空气质量越好
C.铁在潮湿的空气中易生锈而铝不易生锈,说明铁的金属活动性比铝强
D.食品在空气中因与氧气发生缓慢氧化而变质
4.(2022 攀枝花)推理是化学学习中重要的思维方法。下列推理合理的是( )
A.熔点:铅>锡,则焊锡(锡铅合金)的熔点在铅与锡之间
B.金属活动性:Al>Fe,则在空气中铝比铁更容易被腐蚀
C.沸点:液氧>液氮,则将液态空气升温,氮气先蒸发出来
D.导电性:Ag>Cu,则应该用银替代铜广泛用作输电导线
5.(2022 雅安)下列物品所使用的主要材料属于金属材料的是( )
A.陶瓷餐具 B.纯棉衬衫 C.塑料水杯 D.不锈钢炊具
6.(2023 宜宾)将一定量的锌粉加入盛有AgNO3溶液的烧杯中,不断搅拌,充分反应后过滤,得到滤渣和滤液,向滤渣中加入足量稀盐酸,搅拌,滤渣部分溶解,有气泡产生,下列说法错误的是( )
A.滤渣中有Zn和Ag
B.金属活动性:Zn>Ag
C.滤液中含Zn(NO3)2和AgNO3
D.上述过程中只发生置换反应
7.(2023 凉山州)以下能正确表示对应叙述的图像是( )
A.电解水时生成H2和O2的质量与时间的关系
B.两份相同的H2O2溶液在有无MnO2的条件下分解
C.充分高温煅烧一定质量的木炭和氧化铜的混合物
D.分别向等质量的铁粉和锌粉中逐滴加入相同浓度的稀盐酸至过量
8.(2023 内江)金属材料在人类活动中有着广泛的应用。下列有关说法正确的是( )
A.合金中只含金属元素
B.金能压成很薄的片,说明金的熔点高
C.在铁锅表面涂油,可减缓钢铁的锈蚀
D.铁能从ZnSO4、CuSO4的溶液中置换出锌和铜
9.(2023 自贡)现有体积大小相同的三种金属X、Y、Z,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,Y、Z反应生成氢气的质量与反应时间的关系如图所示。X、Y、Z的金属活动性顺序正确的是( )
A.X>Y>Z B.X>Z>Y C.Y>Z>X D.Z>Y>X
10.(2023 泸州)下表为某核心期刊刊文中氢气制备对比实验的数据(将锌粒压成薄锌片增大了表面积)。下列不能由实验得出的结论是( )
编号 20mL硫酸的质量分数 1g锌的形状 0~3min产生氢气体积(mL)
① 20% 锌粒 31.7
② 20% 薄锌片 50.9
③ 30% 锌粒 61.7
④ 30% 薄锌片 79.9
A.Zn是金属活动顺序表中氢前金属
B.锌粒产生氢气的体积总是比薄锌片少
C.增大硫酸的质量分数能加快产生氢气
D.增大锌与酸的接触面积能加快产生氢气
11.(2022 自贡)现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应;如果把Y放入到硝酸铜溶液中,无任何现象,则X、Y、Cu的金属活动性强弱顺序是( )
A.Cu>X>Y B.X>Cu>Y C.X>Y>Cu D.Y>X>Cu
12.(2022 绵阳)现有质量和形状均相同的X、Y、Z三种金属,将X、Y分别放入CuSO4溶液中,只有Y的表面产生红色固体;又将Y、Z分别放入等浓度的稀盐酸中,后者产生气泡比前者快。由此判断,几种金属的活动性顺序为( )
A.Z>Y>Cu>X B.Z>Cu>Y>X C.Y>Z>X>Cu D.Y>Z>Cu>X
13.(2022 内江)向AgNO3溶液中加入过量铜粉,充分反应后过滤,得滤渣和滤液。下列说法正确的是( )
A.滤液中一定含有Cu(NO3)2
B.滤液呈无色
C.滤渣只含有Ag
D.向滤渣中滴加稀硫酸有气泡产生
14.(2023 巴中)明代宋应星所著《天工开物》一书,介绍了“火法炼锌”的方法,把炉甘石(ZnCO3)和煤炭饼装入炼锌罐,如图所示,泥封、“其底铺薪,发火煅红”“冷定毁取出”。下列说法错误的是( )
A.炉甘石(ZnCO3)加入锌罐之前,将其粉碎的目的是增大反应物之间的接触面积
B.反应区中发生的反应之一:C+2ZnO2Zn+CO2↑,该反应中体现了C的还原性
C.“冷定毁罐取出”的目的是防止锌在较高温度下再次被氧化
D.“火法炼锌”符合低碳发展理念
15.(2022 广安)竞争无处不在,微观粒子之间的反应也是如此。将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中发生反应,溶液的质量随时间的变化关系如图所示。下列说法不正确的是( )
A.a点对应的溶液中含有三种金属阳离子
B.b点处的固体中含Ag和Zn
C.取少量b点处的溶液于试管中,滴加稀盐酸会有沉淀出现
D.溶液先不变色,一段时间后由蓝色逐渐变为无色
二.填空题(共6小题)
16.(2023 广安)化学在保证人类生存并不断提高生活质量方面起着重要的作用。利用化学综合应用自然资源和保护环境,使人类生活变得更加美好。
(1)煤和石油是目前使用较多的两种能源,下列有关它们的说法不正确的是 (填字母序号)。
A.煤和石油都是混合物
B.煤和石油综合利用的产品都有医药、炸药等
C.煤和石油都是不可再生能源
D.煤和石油的燃烧对环境都有害,应禁止使用
(2)新能源汽车是未来汽车的发展方向。制造新能源汽车所用到的材料有:钢、塑料、铝合金、合成橡胶等,其中钢和铝合金属于 材料,相对于传统的燃油汽车,新能源汽车的优点是 (任答一点即可)。
(3)“可燃冰”外观像“冰”,是尚未大量开发的新能源,主要含甲烷水合物(CH4 xH2O)。某甲烷水合物充分燃烧的化学方程式为CH4 xH2O+2O2CO2+10H2O,则CH4 xH2O中x的值为 。
17.(2023 南充)金属是重要的资源,在人类文明的发展中起着重要作用,回答下列问题:
(1)铜丝常用作导线,利用了铜具有良好的 性。
(2)生活中为了防止铁制品生锈,采取的措施有① (写一条即可),写出实验室用稀硫酸除铁锈的化学方程式② 。
(3)将一定质量的锌片和铜片加入到硝酸银溶液中,充分反应后过滤,得到滤渣和滤液,若滤液呈蓝色,则滤液中一定含有的溶质是 (填化学式)。
18.(2022 甘孜州)如图是工业炼铁的流程图,回答下列问题:
(1)炼铁高炉中产生的CO与赤铁矿(主要成分是Fe2O3 )反应的化学方程式为 。
(2)高炉烟气的主要成分是烟尘、CO、 、 (填化学式)。
(3)生铁和钢是两种含碳量不同的铁合金,其中含碳量更低的是 。
19.(2022 内江)如图所示,某兴趣小组用三枚洁净无锈铁钉探究铁生锈的条件。
(1)四天后, (填字母序号)试管中铁钉有明显锈迹。
(2)由此实验可以得出铁生锈的条件是 。
20.(2022 广安)(1)氢气由于热值大、来源广、燃烧产物无污染,得到人们积极的开发和利用。请写出氢气在空气中燃烧的化学方程式 。
(2)碳元素可形成多种单质,如金刚石、石墨、C60,焦炭和活性炎的主要成分也是碳的单质。制糖工业的脱色制白糖、防毒面具里的滤毒罐等都使用了活性炭,这是利用了活性炭有较强的 性。
(3)铁合金有广泛的用途,碳元素含量越高,铁合金硬度就越大,则钢和生铁中硬度较大的是 。
(4)焦炭、CO是冶金工业重要的还原剂,请写出用赤铁矿(主要成分Fe2O3)和CO反应炼铁的化学方程式 。
(5)生活中有许多小窍门能让人们避开危险,减少损失,如炒菜时油锅中的油不慎着火,请举一种灭火的方法 。
21.(2022 眉山)大文豪苏轼是眉山人的骄傲,他作词“明月几时有?把酒问青天”,并幻想“我欲乘风归去”,而如今我国载人航天飞船已实现多次天地往返,飞天揽月早已不再是梦想。回答下列问题:
(1)“酒”的主要成分是 。
(2)液氢常用作航天飞船的燃料,液氢是氢气加压制得。用分子的观点解释能“加压”是因为 。氢气作为能源有很多优点,任写出其中一条 。
(3)载人航天飞船常使用合金材料,下列关于合金的说法正确的是 。
A.合金中只含金属元素
B.青铜的硬度比纯铜大
C.钛合金属于有机合成材料
D.钢的含碳量比生铁的高
三.实验题(共2小题)
22.(2023 成都)利用如图实验探究金属的化学性质。
(1)实验一:水的作用是 。实验中,观察到发出白光后铁丝并未燃烧,原因是 。
(2)实验二:两个反应均生成了 (填物质名称)。比较铁和铝的金属活动性强弱,从试剂角度需考虑:①加入同样大小的铁片和铝片;② 。
(3)实验三:反应的化学方程式为 。再补充一个实验可得出Cu、Fe、Ag的金属活动性顺序。设计并进行实验,补全下表。
实验步骤(可用图示) 实验现象 实验结论
23.(2022 成都)我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”如图1,该方法的生产过程可用图2表示。
资料:①潮泥灰主要成分是石灰石。②铁的熔点是1535℃。
根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和 (写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为 。
(4)撒入潮泥灰主要作用是 。不断翻炒液态生铁,是为了降低 元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁 ,易于加工。
四.计算题(共2小题)
24.(2023 凉山州)2022年12月,西昌至成都的城际动车组列车正式运行。高铁钢轨的制造需要大量铁矿石炼铁。现有含Fe3O4为80%的磁铁矿石2900t,求理论上可炼制纯铁的质量为多少?(提示:化学方程式为Fe3O4+4CO3Fe+4CO2)
25.(2023 眉山)磁铁矿石(主要成分为Fe3O4)是常用的炼铁原料,工业上可通过如下反应:Fe3O4+4CO3Fe+4CO2将其中的Fe3O4转化为Fe。
(1)Fe3O4中铁、氧的微观粒子数目之比为 ;
(2)假设炼铁过程中铁没有损耗,用含348吨Fe3O4的磁铁矿石理论上可以炼出含铁96%的生铁的质量是多少(写出计算过程)?
五.解答题(共4小题)
26.(2022 泸州)同学们观看央视《发现》《走进科学》节目后,对节目中介绍人类使用金属材料的年代及其背后的科学原理产生了兴趣,于是查阅Al、Cu、Fe、Ag四种金属元素的信息形成下表资料。
元素编号 ① ② ③ ④
金属材料使用的大致年代 公元前7000年 公元前4000年 公元前2200年 公元1827年
在地壳中的含量/% 0.007 0.00001 4.75 7.73
请回答相关问题。
(1)我们的祖先很早就掌握了炼铜的工艺,最初他们将 (填化学式)和孔雀石[主要成分是Cu2(OH)2CO3]混合后加热就得到了红色的金属铜。
(2)Al元素的单质是在电发现之后,通过电解Al2O3才工业化生产的,则Al在表中的编号是 。
(3)大家发现金属材料使用年代的先后规律一般是:金属越活泼使用年代越迟。但上表中某元素因含量过低而出现了例外。综合分析,①、②、③元素依次是 。
27.(2022 泸州)2018年世界权威期刊《自然》,连刊两文报道石墨烯超导重大发现,论文的第一作者是四川成都籍中科大年轻博士曹原。下面让我们一起重走“超导材料”发现的神奇之路。请回答相关问题。
(1)1911年荷兰物理学家海克 卡莫林 昂内斯经过无数次实验确认;汞在温度接近﹣273℃时几乎处于“零电阻状态”,称之为“超导电性”。汞属于 元素(填“金属”或“非金属”),其导电的原因是含有自由移动的 。
(2)1980年有人发现了铜氧化合物的“超导电性”,将温度提高到约为﹣140℃。YBa2Cu3O5为其代表之一,其中Cu为+1价,О为﹣2价,则Y为 价。
(3)2017年曹原团队发现了石墨烯中的非规“超导电性”,石墨烯是一层碳原子(如图,黑球代表碳原子)。
①曹原推测,当两层石墨烯叠在一起,若彼此之间发生轻微偏移时,有可能产生超导现象,经过不懈努力,困扰世界107年的常温超导难题,终于被曹原团队突破!石墨烯属于 (填“单质”或“化合物”),两层石墨烯叠在一起轻微偏移时发生的是 变化(填“物理”或“化学”)。
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银。该实验是否产生了氢气? (填“是”或“否”),原因是 。我们坚信未来的中国,必定有十个、百个乃至成千上万个“曹原”,用自己的科技之梦去推动中华民族的伟大复兴。
28.(2022 南充)日常生活用品很多是由金属材料制成的。
(1)三星堆出土的文物使用了贴金技艺,贴金技艺利用了金具有良好的 性,将黄金锤成极薄的薄片。
(2)铝的化学性质很活泼,通常铝制品却很耐腐蚀,原因是 (用化学方程式表示)。
(3)春秋战国时期,我国就开始生产和使用铁器。古法炼铁的原理包含一氧化碳与氧化铁在高温下反应,反应的化学方程式是 。
(4)将一定质量的锌粒投入到含有CuSO4和FeSO4的混合溶液中,充分反应后过滤,若滤液中只含有一种溶质,则滤渣中一定含有 。
29.(2022 达州)钢铁是应用最普遍的金属材料,也是最容易发生锈蚀的金属材料之一。人类为金属的锈蚀付出了巨大的代价,所以金属的防腐和废旧金属的回收有着十分重要的意义。
(1)工业上用赤铁矿(主要成分Fe2O3)炼铁的原理: (用化学方程式表示)。
(2)钢铁生锈是铁与空气中 发生化学反应的结果。
(3)处理某废旧金属后的溶液中含有Cu(NO3)2和AgNO3两种溶质,为回收其中的金属,向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生。则滤液中一定含有的金属离子是 ;滤渣中可能含有 。
六.工艺流程题(共1小题)
30.(2022 攀枝花)废旧手机的电路板中主要含有铜,还含有少量铝、铁、金等金属。某学习小组为回收其中的铜、金,进行了如下实验。
已知:Cu+H2O2+H2SO4═CuSO4+2H2O;本实验条件下,金不发生反应。
回答下列问题:
(1)滤液A中的溶质除H2SO4外,还含有的溶质化学式分别是 、 。
(2)小组同学在步骤Ⅱ中发现:部分H2O2分解导致实际消耗的H2O2用量明显大于理论用量。导致部分H2O2分解的原因可能是 。
(3)固体D的成分是 。
(4)向滤液G中加入过量NaOH溶液,反应生成沉淀的化学方程式是 。
七.科普阅读题(共1小题)
31.(2022 攀枝花)阅读短文,回答下列问题。
锂(Li)是最轻的金属,化学性质较为活泼,能与氢、氧、氮、硫及氯的单质反应,可用于除去氦、氩中的氮气,能与水反应生成氢氧化锂和氢气。
锂几乎能与所有金属熔合,形成各种性能优异的合金,如:铜中添加少量锂,机械性能更好,且不降低导电性能;锂铍合金超轻(密度仅为1~1.5g/cm3),硬度大且耐腐蚀;锂是冶炼有色金属合金的不可替代的脱氧剂。氢氧化锂(LiOH)可做二氧化碳吸收剂。
工业上常用无水氯化锂为原料,熔融后电解制得金属锂。
(1)锂铍合金的硬度 (选填“大于”或“小于”)锂。
(2)锂着火时 (选填“能”或“不能”)用水灭火。
(3)“天和”核心舱中用氢氧化锂吸收二氧化碳,反应的化学方程式是 。
(4)电解制得的液态锂冷却时,下列气体可以作为保护气的是 (填选项编号)。
A.氢气
B.氮气
C.氧气
D.氩气
参考答案与试题解析
一.选择题(共15小题)
1.【解答】解;A、干燥的空气中缺少水,铁钉不容易生锈,故A错误;
B、浸没在蒸馏水中缺少氧气,铁钉不容易生锈,故B错误;
C、浸没在植物油中的铁钉,与水和氧气隔绝,不容易生锈,故C错误;
D、在潮湿的空气中,铁钉与水和氧气同时接触,容易生锈,故D正确;
故选:D。
2.【解答】解:A、“木已成舟”与“铁杵成针”都只是物质形状的改变,都没有生成新物质,均属于物理变化,说法错误;
B、“遥知不是雪,为有暗香来”体现了分子在不断地运动,说法正确;
C、“真金不怕火炼”说明黄金的化学性质非常稳定,说法正确;
D、“冰,水为之,而寒于水”体现了物质的状态不同,物理性质不同,说法正确。
故选:A。
3.【解答】解:A、氮气约占空气体积的78%,氧气约占空气体积的21%,故A错误;
B、空气污染指数越高,空气质量越差,故B错误;
C、铝比铁活泼,铝制品不易生锈的原因是常温下,铝易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止内部的铝进一步被氧化,故C错误;
D、氧气具有氧化性,食品在空气中因与氧气发生缓慢氧化而变质,故D正确。
故选:D。
4.【解答】解:A、一般合金的熔点低于其组成中纯金属的硬度,因此焊锡(锡铅合金)的熔点低于铅与锡的熔点,推理错误;
B、铝的化学性质活泼,在常温下易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止内部的铝进一步氧化,推理错误;
C、液氮的沸点低于液氧的沸点,因此将液态空气升温,氮气先蒸发出来,推理正确;
D、导电性:Ag>Cu,但银的价格较强,不能用银替代铜广泛用作输电导线,推理错误。
故选:C。
5.【解答】解:A、陶瓷是一种无机非金属材料,不合题意;
B、纯棉衬衫是由棉花制成的,棉花属于天然材料,不合题意;
C、塑料是一种有机合成材料,不合题意;
D、不锈钢是一种铁合金,属于金属材料,符合题意。
故选:D。
6.【解答】解:A、将一定量的锌粉加入盛有AgNO3溶液的烧杯中,不断搅拌,锌与硝酸银反应生成硝酸锌和银,不断搅拌,充分反应后过滤,得到滤渣和滤液,向滤渣中加入足量稀盐酸,搅拌,滤渣部分溶解,有气泡产生,由于银不与稀盐酸反应,说明滤渣中含有锌,说明加入的锌是过量的,则滤渣中有Zn和Ag,故选项说法正确。
B、锌能与硝酸银溶液反应,说明金属活动性:Zn>Ag,故选项说法正确。
C、由于锌是过量的,则滤液中含Zn(NO3)2,不可能含有AgNO3,故选项说法错误。
D、上述过程中只发生了锌和硝酸银反应生成硝酸锌和银、锌和稀盐酸反应生成氯化锌和氢气,均属于置换反应,故选项说法正确。
故选:C。
7.【解答】解:A、电解水时生成氢气与氧气的体积比为2:1,而不是质量比,图示错误;
B、两份相同的H2O2溶液在有无MnO2的条件下分解,加入二氧化锰的反应速率更快,但最终生成氧气的质量相等,图示错误;
C、在高温的条件下,碳与氧化铜反应生成铜和二氧化碳,随着反应的进行,固体质量减少,但固体不会变成零,当反应结束时,固体质量不再改变,图示错误;
D、分别向等质量的锌粉和铁粉中加入同浓度的稀盐酸,反应开始时,金属都有剩余,酸相同且不足量,所以产生氢气的质量相等,两条线一致,不断加入酸,金属完全反应后,铁生成氢气的质量更大,图示正确。
故选:D。
8.【解答】解:A、合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,合金中不是只含金属元素,还可能含有非金属元素,故选项说法错误。
B、金能压成很薄的片,说明金具有良好的延展性,故选项说法错误。
C、铁生锈实际上是铁与氧气、水等发生化学反应的过程,在铁锅表面涂油,隔绝氧气和水,可减缓钢铁的锈蚀,故选项说法正确。
D、锌、铁、铜三种金属活动性:锌>铁>铜,铁能置换出CuSO4的溶液中的铜,不能置换出ZnSO4的溶液中锌,故选项说法错误。
故选:C。
9.【解答】解:现有体积大小相同的三种金属X、Y、Z,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,说明X的位置排在氢的后面。
Y、Z能与稀硫酸反应,则说明Y、Z的位置排在氢的前面。
由Y、Z反应生成氢气的质量与反应时间的关系图,至完全反应,Z所需时间短,则Z的金属活动性比Y强。
故X、Y、Z的金属活动性顺序是Z>Y>X。
故选:D。
10.【解答】解:A、Zn是金属活动顺序表中氢前金属,故选项说法正确。
B、由实验②③对比可知,锌粒产生氢气的体积不是总是比薄锌片少,故选项说法错误。
C、增大硫酸的质量分数,反应物的浓度增大,能加快产生氢气,故选项说法正确。
D、增大锌与酸的接触面积,能加快产生氢气,故选项说法正确。
故选:B。
11.【解答】解:现有X、Y两种金属,如果把X、Y分别放入稀盐酸中,X溶解并产生氢气,Y不反应,说明X的位置排在氢的前面,Y的位置排在氢的后面,即X>H>Y;
如果把Y放入到硝酸铜溶液中,无任何现象,说明Y的金属活动性比铜弱,即铜>Y。
X的位置排在氢的前面,则X、Y、Cu的金属活动性强弱顺序是X>Cu>Y。
故选:B。
12.【解答】解:将X、Y分别放入CuSO4溶液中,只有Y的表面产生红色固体,说明Y能与硫酸铜反应,Y比铜活泼,X与硫酸铜不反应,说明铜比X活泼;又将Y、Z分别放入等浓度的稀盐酸中,后者产生气泡比前者快,说明在金属活动性顺序里,Y、Z排在氢前,且Z比Y活泼,故几种金属的活动性顺序为:Z>Y>Cu>X。
故选:A。
13.【解答】解:A、铜的金属活动性比银强,过量铜粉的能与硝酸银反应生成硝酸铜和银,则滤液中一定含有Cu(NO3)2,故选项说法正确。
B、铜的金属活动性比银强,过量铜粉能与硝酸银反应生成硝酸铜和银,滤液是Cu(NO3)2溶液,滤液呈蓝色,故选项说法错误。
C、铜的金属活动性比银强,过量铜粉能与硝酸银反应生成硝酸铜和银,滤渣是银、铜的混合物,故选项说法错误。
D、滤渣是银、铜的混合物,向滤渣中滴加稀硫酸,均不反应,无明显现象,故选项说法错误。
故选:A。
14.【解答】解:A、炉甘石(ZnCO3)加入锌罐之前,先将其粉碎的目的是增大反应物接触面积,反应更快、更充分,故正确。
B、C+2ZnO2Zn+CO2↑,该反应中C得到氧,体现还原性,故正确。
C、锌能与氧气在高温下反应会生成氧化锌,故“冷定”后方能“毁罐”取锌,其原因是防止生成的锌在较高温度下又被氧化成氧化锌,故正确。
D、“火法炼锌”过程中生成大量二氧化碳,不符合低碳发展理念,故错误。
故选:D。
15.【解答】解:将足量的Zn粉投入一定质量的AgNO3和Cu(NO3)2的混合溶液中,锌会先与硝酸银反应,溶液质量减小,再与硝酸铜反应,质量增大。
A、a点对应的溶液质量没有减小到最小,所以硝酸银没有完全反应,含有锌、铜、银三种金属阳离子,故A正确;
B、b点处的溶液质量减小到最小,所以固体中含Ag和Zn,故B正确;
C、取少量b点处的溶液于试管中,滴加稀盐酸不会有沉淀出现,故C错误;
D、溶液先不变色,一段时间后由蓝色逐渐变为无色,故D正确。
故选:C。
二.填空题(共6小题)
16.【解答】解:(1)A.煤和石油都是由多种成分组成的物质,均属于混合物,故正确;
B.煤和石油综合利用的产品都有医药、炸药等,故正确;
C.煤和石油需要经历较长的时间才能形成,都是不可再生能源,故正确;
D.煤和石油的燃烧会产生对环境有危害的物质,但是人类的生产、生活都离不开,只能合理使用,不能禁止使用,故错误;
故选:D;
(2)钢和铝合金属于金属材料,相对于传统的燃油汽车,新能源汽车的优点是不污染环境等;
(3)根据质量守恒定律可知,反应前后原子的数目保持不变,根据化学方程式CH4 xH2O+2O2CO2+10H2O可知,氧原子守恒:x+4=2+10,x=8,即CH4 xH2O中x的值为8。
故答案为:
(1)D;
(2)金属;不污染环境(合理即可);
(3)8。
17.【解答】解:(1)铜丝常用作导线,利用了铜具有良好的导电性。
(2)为了防止钢铁的锈蚀,人们常采用在其表面刷漆、涂油或镀上其它金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水。
铁锈的主要成分是氧化铁,与硫酸反应生成硫酸铁和水,反应的化学方程式是:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O。
(3)锌、铜的金属活动性比银强,且锌的金属活动性比铜强,将一定质量的锌片和铜片加入到硝酸银溶液中,锌先与AgNO3溶液反应生成硝酸锌溶液和银,锌粉反应完,若还有AgNO3溶液,铜才能与AgNO3溶液反应生成硝酸铜溶液和银。充分反应后过滤,得到滤渣和滤液,若滤液呈蓝色,说明发生了铜和硝酸银溶液的反应,则滤液中一定含有的溶质是Zn(NO3)2、Cu(NO3)2,可能含有AgNO3。
故答案为:
(1)导电;
(2)刷漆;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)Zn(NO3)2、Cu(NO3)2。
18.【解答】解:(1)炼铁高炉中产生的CO与赤铁矿(主要成分是Fe2O3 )高温下反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O32Fe+3CO2;
(2)高炉炼铁的反应中,有二氧化碳气体产生,且空气中的氮气没有参加反应,因此高炉烟气的主要成分是烟尘、CO、CO2、N2;
(3)生铁含碳量为2%﹣4.3%,钢含碳量为0.03%﹣2%,因此含碳量更低的是钢;
故答案为:
(1)3CO+Fe2O32Fe+3CO2;
(2)CO2;N2;
(3)钢。
19.【解答】解:(1)a试管中的铁钉能与氧气、水充分接触;b试管中的铁钉只能与干燥的空气接触;c试管的铁钉只能与水接触;四天后,a试管中的铁钉生锈,另外两支试管的铁钉没有生锈。
(2)a试管中的铁钉能与氧气、水充分接触;b试管中的铁钉只能与干燥的空气接触;c试管的铁钉只能与水接触;四天后,a试管中的铁钉生锈,另外两支试管的铁钉没有生锈,由此实验可以得出铁生锈的条件是与氧气、水充分接触。
故答案为:
(1)a;
(2)与氧气、水充分接触。
20.【解答】解:(1)氢气和氧气在点燃的条件下生成水,化学方程式为:2H2+O22H2O;
(2)活性炭具有吸附性,能吸附色素和异味,制糖工业的脱色制白糖、防毒面具里的滤毒罐等都使用了活性炭,这是利用了活性炭有较强的吸附性;
(3)碳元素含量越高,铁合金硬度越大,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,生铁含碳量高,所以钢和生铁中硬度较大的是生铁;
(4)Fe2O3和CO在高温的条件下生成铁和二氧化碳,化学方程式为:Fe2O3+3CO2Fe+3CO2;
(5)灭火的原理有三点:移除可燃物、隔绝氧气、降温至可燃物的着火点以下。炒菜时油锅中的油不慎着火,可以用锅盖盖灭,原理是隔绝氧气;
故答案为:
(1)2H2+O22H2O;
(2)吸附;
(3)生铁;
(4)Fe2O3+3CO2Fe+3CO2;
(5)用锅盖盖灭。
21.【解答】解:(1)“酒”是乙醇的水溶液,其主要成分是乙醇或酒精;故答案为:乙醇或酒精;
(2)液氢常用作航天飞船的燃料,液氢是氢气加压制得。用分子的观点解释能“加压”是因为氢气分子间有间隔,加压时分子间隔变小,氢气液化。氢气作为能源有很多优点,如燃烧产物只有水,无污染;制备氢气的原料来源广;热值高等;故答案为:氢气分子间有间隔,加压时分子间隔变小,氢气液化;无污染(或制备氢气的原料来源广或热值高);
(3)A.合金是在某种金属中加热熔合某些其它金属(或非金属),而形成的具有金属特性的物质,因此合金中不是只含金属元素,说法错误;
B.一般合金的硬度大于其组成的纯金属的硬度,因此青铜的硬度比纯铜大,说法正确;
C.钛合金属于金属材料,说法错误;
D.钢的含碳量比生铁的低,钢的含碳量为0.03%~2%,生铁的含碳量为2%~4.3%,说法错误;
故答案为:B。
三.实验题(共2小题)
22.【解答】解:(1)实验一:水的作用是防止生成物熔化溅落下来使瓶底炸裂。
实验中,观察到发出白光后铁丝并未燃烧,原因是火柴燃烧消耗了较多的氧气,使氧气不足。
(2)铁和稀盐酸反应生成氯化亚铁和氢气,铝和稀盐酸反应生成氯化铝和氢气,实验二:两个反应均生成了氢气。
除探究要素不同之外,其它条件都应该是相同的,比较铁和铝的金属活动性强弱,从试剂角度需考虑:①加入同样大小的铁片和铝片;②加入等体积等浓度的稀盐酸。
(3)实验三中铜和硝酸银反应生成硝酸铜和银,反应的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag。
再补充一个实验可得出Cu、Fe、Ag的金属活动性顺序,还需证明铁的金属活动性比铜强。可取少量硫酸亚铁溶液于试管中,伸入铜丝,无明显变化,说明铁的金属活动性比铜强,图示为(合理即可)。
故答案为:
(1)防止生成物熔化溅落下来使瓶底炸裂;火柴燃烧消耗了较多的氧气,使氧气不足;
(2)氢气;加入等体积等浓度的稀盐酸;
(3)Cu+2AgNO3=Cu(NO3)2+2Ag; (合理即可)。
23.【解答】解:(1)常见的铁矿石有赤铁矿和磁铁矿或菱铁矿(合理即可);
(2)不断鼓入空气的目的是使碳与氧气反应,放热,提高炉温;
(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:Fe2O3+3CO2Fe+3CO2。高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:Fe3O4+4CO3Fe+4CO2;
(4)撒入潮泥灰主要作用是将铁矿石中的二氧化硅转化为炉渣而除去,生铁和钢的区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量得到钢。
(5)合金的熔点低于组成它的纯金属,钢的熔点比纯铁低,易于加工。
故答案为:(1)磁铁矿(合理即可);
(2)提高炉温;
(3)Fe2O3+3CO2Fe+3CO2或Fe3O4+4CO3Fe+4CO2;
(4)将铁矿石中的二氧化硅转化为炉渣而除去;碳或C;
(5)低。
四.计算题(共2小题)
24.【解答】解:设理论上可炼制纯铁的质量为x。
Fe3O4+4CO3Fe+4CO2
232 168
2900t×80% x
x=1680t
答:理论上可炼制纯铁的质量为1680t。
25.【解答】解:(1)由化学式可知,Fe3O4中铁、氧的微观粒子数目之比为3:4。
故答案为:3:4。
(2)设理论上可以炼出含铁96%的生铁的质量为x。
Fe3O4+4CO3Fe+4CO2
232 168
348t 96%x
x=262.5t
答:理论上可以炼出含铁96%的生铁的质量为262.5t。
五.解答题(共4小题)
26.【解答】解:(1)木炭具有还原性,我们的祖先很早就掌握了炼铜的工艺,最初他们将C和孔雀石[主要成分是Cu2(OH)2CO3]混合后加热就得到了红色的金属铜;
(2)铝是地壳中含量最多的金属元素,所以Al元素的单质是在电发现之后,通过电解Al2O3才工业化生产的,所以Al在表中的编号是④;
(3)大家发现金属材料使用年代的先后规律一般是:金属越活泼使用年代越迟。但上表中某元素因含量过低而出现了例外。综合分析,①、②、③元素依次是:铜、银、铁。
故答案为:(1)C;
(2)④;
(3)铜、银、铁。
27.【解答】解:(1)汞属于金属元素;其导电的原因是含有自由移动的电子;
(2)YBa2Cu3O5为其代表之一,其中Cu为+1价,О为﹣2价,钡元素显+2价,是由Y为+3价;
(3)①石墨烯是由同种元素组成的纯净物,属于单质;两层石墨烯叠在一起轻微偏移时没有新物质生成,发生的是物理变化;
②曹原小时候就喜欢动手研究,在家里弄了个实验室,曾经把银放入稀硝酸中,自己“合成”实验所需硝酸银,硝酸具有强氧化性,硝酸和银反应生成硝酸银、一氧化氮或二氧化氮和水,该实验不产生了氢气;原因是:银的金属活动性排在氢的后面。
故答案为:(1)金属;电子;
(2)+3;
(3)①单质;物理;
②否;银的金属活动性排在氢的后面。
28.【解答】解:(1)将黄金锤成极薄的薄片,是因为金具有良好的延展性;
(2)铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,反应的化学方程式为:4Al+3O2═2Al2O3;
(3)在高温下,一氧化碳可以把氧化铁还原成铁,同时有二氧化碳气体生成,化学反应式是:Fe2O3+3CO2Fe+3CO2;
(4)将一定质量的锌粒投入到含有CuSO4和FeSO4的混合溶液中,锌先和硫酸铜反应,当硫酸铜完全反应后,锌再和硫酸亚铁反应,充分反应后过滤,若滤液中只含有一种溶质,则溶质是硫酸锌,说明硫酸铜、硫酸亚铁和锌完全反应,则滤渣中一定含有铜和铁,可能含有锌。
故答案为:(1)延展;
(2)4Al+3O2═2Al2O3;
(3)Fe2O3+3CO2Fe+3CO2;
(4)Fe、Cu (或铁、铜)。
29.【解答】解:(1)赤铁矿的主要成分是氧化铁,工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO2Fe+3CO2。
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气、水蒸气共同作用的结果。
(3)铁的金属活动性比银、铜强,在硝酸银、硝酸铜的混合溶液中加入一定量铁粉,铁先与硝酸银溶液反应生成硝酸亚铁溶液和银,硝酸银反应完,若还有铁粉,铁才能与硝酸铜溶液反应生成硝酸亚铁溶液和铜。向该溶液中加入一定量的铁粉,充分反应后过滤,再向滤渣中加入稀盐酸,无气泡产生,说明滤渣中不含铁,一定含有银,可能含有铜,则滤液中一定含有的金属离子是亚铁离子。
故答案为:
(1)Fe2O3+3CO2Fe+3CO2;
(2)氧气、水蒸气;
(3)亚铁离子;铜。
六.工艺流程题(共1小题)
30.【解答】解:(1)结合电路板成分分析,铝与稀硫酸反应生成硫酸铝和氢气,铁与稀硫酸反应生成硫酸亚铁和氢气,因此滤液A中的溶质除硫酸外,还含有硫酸铝、硫酸亚铁。
(2)硫酸铜可加快过氧化氢分解速率,步骤II中铜与过氧化氢、硫酸反应生成的硫酸铜溶液加快了过氧化氢分解,且反应放热使溶液温度升高也能加快过氧化氢的分解。
(3)滤渣B为金、铜混合物,根据已知中的反应分析,可知步骤II中铜全部反应,过滤所得固体D为金。
(4)滤液C为硫酸铜溶液,步骤Ⅲ加入过量铁粉后,铁与硫酸铜反应生成硫酸亚铁和铜,滤渣F为铁,铜混合物,加入过量稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,滤液G为硫酸亚铁和过量稀硫酸的混合溶液,加入过量氢氧化钠溶液,生成沉淀的反应为硫酸亚铁与氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,据此写出反应的化学方程式为FeSO4+2NaOH=Na2SO4+Fe (OH) 2↓。
故答案为:(1)Al2(SO4)3;FeSO4;
(2)硫酸铜对过氧化氢的分解起到了催化作用(合理即可);
(3)金(或Au);
(4)FeSO4+2NaOH=Na2SO4+Fe (OH) 2↓。
七.科普阅读题(共1小题)
31.【解答】解:(1)一般合金的硬度大于其组成中纯金属的硬度,因此锂铍合金的硬度大于锂;故答案为:大于;
(2)锂能与水反应生成氢氧化锂和氢气,氢气具有可燃性,因此锂着火时不能用水灭火,以防发生爆炸;故答案为:不能;
(3)氢氧化锂吸收二氧化碳生成碳酸锂和水,化学方程式为2LiOH+CO2═Li2CO3+H2O;故答案为:2LiOH+CO2═Li2CO3+H2O;
(4)A.氢气化学性质活泼,不能用作保护气;
B.氮气可以与液态锂发生反应,不能用作保护气;
C.氧气化学性质活泼,不能用作保护气;
D.氩气化学性质稳定,可用作保护气;
故答案为:D。
同课章节目录
