2023-2024学年高中化学苏教版(2020)必修第二册 6.1.1化学反应速率 课件(共26张PPT)
文档属性
| 名称 | 2023-2024学年高中化学苏教版(2020)必修第二册 6.1.1化学反应速率 课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 14:43:19 | ||
图片预览








文档简介
(共26张PPT)
专题6 化学反应与能量转化
第一单元 化学反应速率与反应限度
化学反应速率
化学
2
1、知道什么是化学反应速率,并能进行简单的计算;
2、认识影响化学反应速率的因素,并能用于说明有关问题。
3、知道可逆反应及其特点;
4、认识可逆反应的进行有一定的限度,理解化学平衡状态。
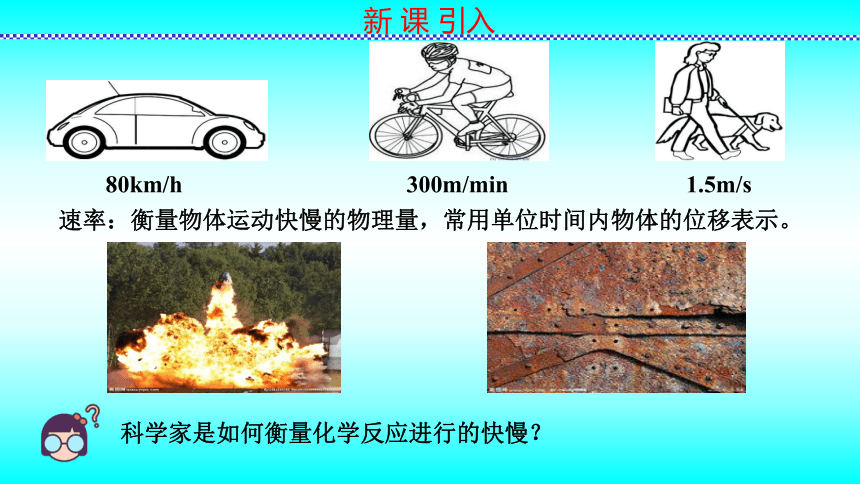
科学家是如何衡量化学反应进行的快慢?
80km/h
300m/min
1.5m/s
速率:衡量物体运动快慢的物理量,常用单位时间内物体的位移表示。
新 课 引入
1、概念:衡量化学反应进行快慢的物理量,常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
2、表示方法:
mol/(L·min)或mol/(L·s)
3、单位:
【例题】25℃时, 一份双氧水样品经过100 min,H2O2的浓度从 5×10-2 mol·L-1 下降到 4×10-2 mol·L-1 。那么,该双氧水在这 2 小时中分解的平均速率约是___________ mol·(L·min)-1
1×10-4
解:
化学反应速率
阅读教材,了解相关知识!
【典例训练1】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A+2B=3C。反应经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L。已知反应开始时B的浓度是1.2mol/L,求:
(1)2min末B、C的浓度。
(2)以单位时间内A的浓度的减小来表示2min内该反应的反应速率。
=0.1mol/(L·min)
答:2min末B、C的浓度分别为0.8mol/L、0.6mol/L;2min内v(A)为0.1mol/(L·min)。
0.2mol/L
0.4mol/L 0.6mol/L
0.8mol/L 0.6mol/L
解:
0.05mol/L 0.15mol/L
B
1、同一反应,用不同物质来表示反应速率时,其数值可能不同,但表示的意义相同,且都是某一段时间内的平均速率。
2、同一反应,各物质的化学反应速率之比等于各物质的化学计量数之比。即对于反应:
aA + bB = cC + dD
vA : vB : vC : vD= a : b : c : d
3、三段计算法
aA + bB = cC + dD
a b c d
开始
反应
结束
2、对于反应A2+3B2 2AB3以下表示的反应速率中,速率最大的是( )
A、v(A2)=0.4mol·L-1min-1 B、v(B2)=0.8mol·L-1min-1
C、v(AB3)=0.6mol·L-1min-1 D、v(A2)=0.01mol·L-1·S-1
D
1、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是( )
A、v (A)=0.005mol/(L·s) B、v (C)=0.002mol/(L·s)
C、v (B)=V(A)/3 D、v (A)=0.001mol/(L·s)
A
3、某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:写出反应的化学方程式?求反应开始至2min末,Z的平均反应速率?
4.把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+ Y(g)=nZ(g)+2W(g)。2 min末已生成0.2 mol W,若测得以Z的浓度变化表示的反应速率为0.1 mol·L-1·min-1,计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)求n值。
例子 影响速率因素 如何影响
相同条件下,镁条和铁片与盐酸反应,前者更剧烈
食物在冬天不易变质,而在夏天却容易变质
硫在氧气中比在空气中燃烧更剧烈
碳酸钙与盐酸反应时,粉状比块状快
双氧水加入二氧化锰后分解加快
工业合成氨通常在高压下进行
化学反应有快有慢,是哪些因素在影响化学反应的速率?请分析下列现象,归纳影响化学反应速率的因素。
物质的性质
温度
浓度
接触面积
催化剂
压强
性质越活泼,反应越快
温度越高,反应越快
浓度越大,反应越快
接触面积越大,反应越快
催化剂能加快反应
压强越大,反应越快
1、钠与水反应,增加水的量,反应速率会加快吗?高温下碳还原氧化铜,增加碳的用量,反应速率会加快吗?
2、对于反应CaO + H2O = Ca(OH)2,增大压强,反应速率会加快吗?
3、在某一密闭容器中发生如下反应:CO(g)+H2O(g) == H2(g)+CO2(g),向容器中通入N2,使容器中压强增大,反应速率会加快吗?
4、催化剂是因其能够改变反应的途径,所以能对化学反应速率产生影响。哪催化剂一定能加快反应速率吗?
高温
①温度:其它条件不变,升高温度,反应速率加快。
④催化剂:催化剂能够改变(加快或减慢)化学反应速率
②浓度:其它条件不变,增大反应物的浓度,反应速率加快。 (固体与纯液体的浓度为定值)
1、内因:反应物本身的性质(决定因素)
③压强:其他条件不变,增大压强,反应速率加快。(针对有气体参加的反应,且压强对反应速率的影响需通过浓度的改变来实现。)
⑤接触面积:其它条件不变,增大接触面积,反应速率加快。
2、外因:
影响化学反应速率的因素
t1-t2
t1-t2
t0~t1:浓度最大,温度最低。较快
t1~t2:浓度较大,温度较高。最快
t2~t3:反应即将结束,浓度最小。最慢
某一反应物几乎消耗殆尽
C
D
D
编号 金属(粉末状) 酸的浓度及体积 反应温度
A Mg,0.1 mol 3 mol·L-1硫酸10ml 60℃
B Mg,0.1 mol 3 mol·L-1盐酸10ml 60℃
C Fe,0.1 mol 3 mol·L-1盐酸10ml 60℃
D Mg,0.1 mol 3 mol·L-1硫酸10ml 50℃
A
B
在高炉炼铁中,工程师发现排出的高炉气体中含有一定量的CO,他们认为是CO与铁矿石接触时间短,反应不充分导致的,可以通过加高高炉的高度来增加反应时间,较少CO的含量。但是高炉无论怎样加高,炉气中仍含有一定量的一氧化碳。
之后法国化学家勒夏特列,深入研究了炼钢技术中的“高炉反应”。勒夏特列认为,这是因为发生了可逆反应:
故高炉气中存在着一定量的一氧化碳是难以避免的。
可逆反应
阅读教材回答:什么是可逆反应?可逆反应有什么特点?
特点:反应物不能完全转化为生成物,即转化率小于100%。
可逆反应中反应物为什么不能完全转化为生成物?
反应开始时:
反应物浓度最大,V(正) 最大;
生成物浓度为零,最小,V(逆)为零。
反应进行中:
反应物减少,导致V(正) 逐渐减小;
生成物由无到有逐渐增多,导致V(逆) 从零逐渐增大。
一定时间后:
V(正)= V(逆) ≠0;
各反应物和生成物的浓度不再发生变化
根据右图,分析合成氨反应中正、逆反应的反应速率、反应物和生成物的浓度随时间的变化情况。
概念:在一定条件下,当可逆反应的正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化时,反应达到化学平衡状态。
化学平衡状态
特点:
①②④⑥⑦
③⑤⑥
1.下列不属于可逆反应的是( )
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2可以生成NH3,同时 NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气转化成H2O
D.SO2溶于水和H2SO3分解
2.对化学反应限度的叙述,错误的是( )
A.任何可逆反应都有一定的限度
B、当达到化学平衡时,正逆反应均已停止
C、当达到化学平衡时,反应混合物中各成分的浓度保持不变
D、化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏。
C
B
4.在一定条件下,NO和O2反应为可逆反应,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是 ( )
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
B
3、将一定量的SO2和18O2通入一密闭容器中,在一定条件下发生可逆反应:2SO2 +O2 2SO3,当反应达到一定限度时,18O存在于( )
A、SO3、O2中 B、SO3 、SO2中
C、SO2 、O2中 D、SO3 、SO2 、O2中
D
6.在一定温度下,反应A2(g) + B2 (g) 2AB(g)达到平衡的标志是( )
A.单位时间生成n mol A2同时生成n mol AB
B.容器内总压不随时间变化
C.单位时间生成2n mol AB同时生成n mol B2
D.单位时间生成n mol A2同时生成n mol B2
C
5.对于可逆反应M+N Q 达到平衡时,下列说法正确的是( )
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物中各成分的百分组成不再变化
D.反应已经停止
C
8.在一定温度下,向2 L某恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),5min时测得Z的物质的量为1.2mol,下列说法正确的是( )
A.此时Y的浓度为0.6mol/L
B.5min 内v (X)=0.06mol/(L·min)
C.容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态
D.单位时间消耗0.1 molX同时生成0.2molZ,则该反应达到平衡状态
7.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g),不能说明已达到平衡状态的是 ( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变
D.混合气体总物质的量保持不变
A
B
专题6 化学反应与能量转化
第一单元 化学反应速率与反应限度
化学反应速率
化学
2
1、知道什么是化学反应速率,并能进行简单的计算;
2、认识影响化学反应速率的因素,并能用于说明有关问题。
3、知道可逆反应及其特点;
4、认识可逆反应的进行有一定的限度,理解化学平衡状态。
科学家是如何衡量化学反应进行的快慢?
80km/h
300m/min
1.5m/s
速率:衡量物体运动快慢的物理量,常用单位时间内物体的位移表示。
新 课 引入
1、概念:衡量化学反应进行快慢的物理量,常用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
2、表示方法:
mol/(L·min)或mol/(L·s)
3、单位:
【例题】25℃时, 一份双氧水样品经过100 min,H2O2的浓度从 5×10-2 mol·L-1 下降到 4×10-2 mol·L-1 。那么,该双氧水在这 2 小时中分解的平均速率约是___________ mol·(L·min)-1
1×10-4
解:
化学反应速率
阅读教材,了解相关知识!
【典例训练1】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A+2B=3C。反应经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L。已知反应开始时B的浓度是1.2mol/L,求:
(1)2min末B、C的浓度。
(2)以单位时间内A的浓度的减小来表示2min内该反应的反应速率。
=0.1mol/(L·min)
答:2min末B、C的浓度分别为0.8mol/L、0.6mol/L;2min内v(A)为0.1mol/(L·min)。
0.2mol/L
0.4mol/L 0.6mol/L
0.8mol/L 0.6mol/L
解:
0.05mol/L 0.15mol/L
B
1、同一反应,用不同物质来表示反应速率时,其数值可能不同,但表示的意义相同,且都是某一段时间内的平均速率。
2、同一反应,各物质的化学反应速率之比等于各物质的化学计量数之比。即对于反应:
aA + bB = cC + dD
vA : vB : vC : vD= a : b : c : d
3、三段计算法
aA + bB = cC + dD
a b c d
开始
反应
结束
2、对于反应A2+3B2 2AB3以下表示的反应速率中,速率最大的是( )
A、v(A2)=0.4mol·L-1min-1 B、v(B2)=0.8mol·L-1min-1
C、v(AB3)=0.6mol·L-1min-1 D、v(A2)=0.01mol·L-1·S-1
D
1、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是( )
A、v (A)=0.005mol/(L·s) B、v (C)=0.002mol/(L·s)
C、v (B)=V(A)/3 D、v (A)=0.001mol/(L·s)
A
3、某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:写出反应的化学方程式?求反应开始至2min末,Z的平均反应速率?
4.把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+ Y(g)=nZ(g)+2W(g)。2 min末已生成0.2 mol W,若测得以Z的浓度变化表示的反应速率为0.1 mol·L-1·min-1,计算:
(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)求n值。
例子 影响速率因素 如何影响
相同条件下,镁条和铁片与盐酸反应,前者更剧烈
食物在冬天不易变质,而在夏天却容易变质
硫在氧气中比在空气中燃烧更剧烈
碳酸钙与盐酸反应时,粉状比块状快
双氧水加入二氧化锰后分解加快
工业合成氨通常在高压下进行
化学反应有快有慢,是哪些因素在影响化学反应的速率?请分析下列现象,归纳影响化学反应速率的因素。
物质的性质
温度
浓度
接触面积
催化剂
压强
性质越活泼,反应越快
温度越高,反应越快
浓度越大,反应越快
接触面积越大,反应越快
催化剂能加快反应
压强越大,反应越快
1、钠与水反应,增加水的量,反应速率会加快吗?高温下碳还原氧化铜,增加碳的用量,反应速率会加快吗?
2、对于反应CaO + H2O = Ca(OH)2,增大压强,反应速率会加快吗?
3、在某一密闭容器中发生如下反应:CO(g)+H2O(g) == H2(g)+CO2(g),向容器中通入N2,使容器中压强增大,反应速率会加快吗?
4、催化剂是因其能够改变反应的途径,所以能对化学反应速率产生影响。哪催化剂一定能加快反应速率吗?
高温
①温度:其它条件不变,升高温度,反应速率加快。
④催化剂:催化剂能够改变(加快或减慢)化学反应速率
②浓度:其它条件不变,增大反应物的浓度,反应速率加快。 (固体与纯液体的浓度为定值)
1、内因:反应物本身的性质(决定因素)
③压强:其他条件不变,增大压强,反应速率加快。(针对有气体参加的反应,且压强对反应速率的影响需通过浓度的改变来实现。)
⑤接触面积:其它条件不变,增大接触面积,反应速率加快。
2、外因:
影响化学反应速率的因素
t1-t2
t1-t2
t0~t1:浓度最大,温度最低。较快
t1~t2:浓度较大,温度较高。最快
t2~t3:反应即将结束,浓度最小。最慢
某一反应物几乎消耗殆尽
C
D
D
编号 金属(粉末状) 酸的浓度及体积 反应温度
A Mg,0.1 mol 3 mol·L-1硫酸10ml 60℃
B Mg,0.1 mol 3 mol·L-1盐酸10ml 60℃
C Fe,0.1 mol 3 mol·L-1盐酸10ml 60℃
D Mg,0.1 mol 3 mol·L-1硫酸10ml 50℃
A
B
在高炉炼铁中,工程师发现排出的高炉气体中含有一定量的CO,他们认为是CO与铁矿石接触时间短,反应不充分导致的,可以通过加高高炉的高度来增加反应时间,较少CO的含量。但是高炉无论怎样加高,炉气中仍含有一定量的一氧化碳。
之后法国化学家勒夏特列,深入研究了炼钢技术中的“高炉反应”。勒夏特列认为,这是因为发生了可逆反应:
故高炉气中存在着一定量的一氧化碳是难以避免的。
可逆反应
阅读教材回答:什么是可逆反应?可逆反应有什么特点?
特点:反应物不能完全转化为生成物,即转化率小于100%。
可逆反应中反应物为什么不能完全转化为生成物?
反应开始时:
反应物浓度最大,V(正) 最大;
生成物浓度为零,最小,V(逆)为零。
反应进行中:
反应物减少,导致V(正) 逐渐减小;
生成物由无到有逐渐增多,导致V(逆) 从零逐渐增大。
一定时间后:
V(正)= V(逆) ≠0;
各反应物和生成物的浓度不再发生变化
根据右图,分析合成氨反应中正、逆反应的反应速率、反应物和生成物的浓度随时间的变化情况。
概念:在一定条件下,当可逆反应的正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化时,反应达到化学平衡状态。
化学平衡状态
特点:
①②④⑥⑦
③⑤⑥
1.下列不属于可逆反应的是( )
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2可以生成NH3,同时 NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气转化成H2O
D.SO2溶于水和H2SO3分解
2.对化学反应限度的叙述,错误的是( )
A.任何可逆反应都有一定的限度
B、当达到化学平衡时,正逆反应均已停止
C、当达到化学平衡时,反应混合物中各成分的浓度保持不变
D、化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏。
C
B
4.在一定条件下,NO和O2反应为可逆反应,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是 ( )
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
B
3、将一定量的SO2和18O2通入一密闭容器中,在一定条件下发生可逆反应:2SO2 +O2 2SO3,当反应达到一定限度时,18O存在于( )
A、SO3、O2中 B、SO3 、SO2中
C、SO2 、O2中 D、SO3 、SO2 、O2中
D
6.在一定温度下,反应A2(g) + B2 (g) 2AB(g)达到平衡的标志是( )
A.单位时间生成n mol A2同时生成n mol AB
B.容器内总压不随时间变化
C.单位时间生成2n mol AB同时生成n mol B2
D.单位时间生成n mol A2同时生成n mol B2
C
5.对于可逆反应M+N Q 达到平衡时,下列说法正确的是( )
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物中各成分的百分组成不再变化
D.反应已经停止
C
8.在一定温度下,向2 L某恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),5min时测得Z的物质的量为1.2mol,下列说法正确的是( )
A.此时Y的浓度为0.6mol/L
B.5min 内v (X)=0.06mol/(L·min)
C.容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态
D.单位时间消耗0.1 molX同时生成0.2molZ,则该反应达到平衡状态
7.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g),不能说明已达到平衡状态的是 ( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变
D.混合气体总物质的量保持不变
A
B
