2.2.1氯及其化合物 课件(共28张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯及其化合物 课件(共28张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 42.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 14:47:00 | ||
图片预览







文档简介
(共28张PPT)
2.2 氯及其化合物
第一课时
《氯气的性质》
CaCl2 MgCl2 NaCl
Cl-
Cl2
富集、分离提纯、转化
海水中的重要元素——氯
重要的化工原料
氯是一种重要的“成盐元素”,在自然界中除了以 MgCl2 、 NaCl 、 CaCl2等形式 大量存在于海水中,还存在于陆地的盐湖和盐矿中。
观看实验视频,总结氯气的物理性质
氯气的发现史
氯气的性质
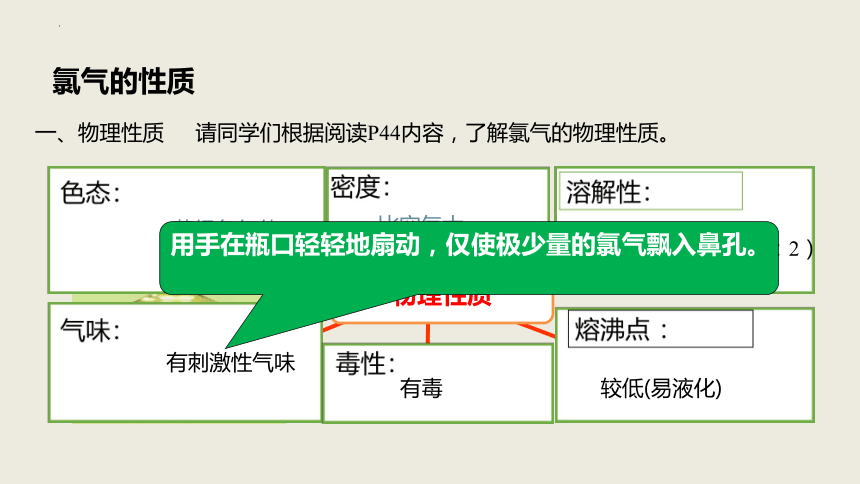
一、物理性质
物理性质
黄绿色气体
比空气大
在水中溶解度不大(1:2)
有刺激性气味
有毒
较低(易液化)
用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。
请同学们根据阅读P44内容,了解氯气的物理性质。
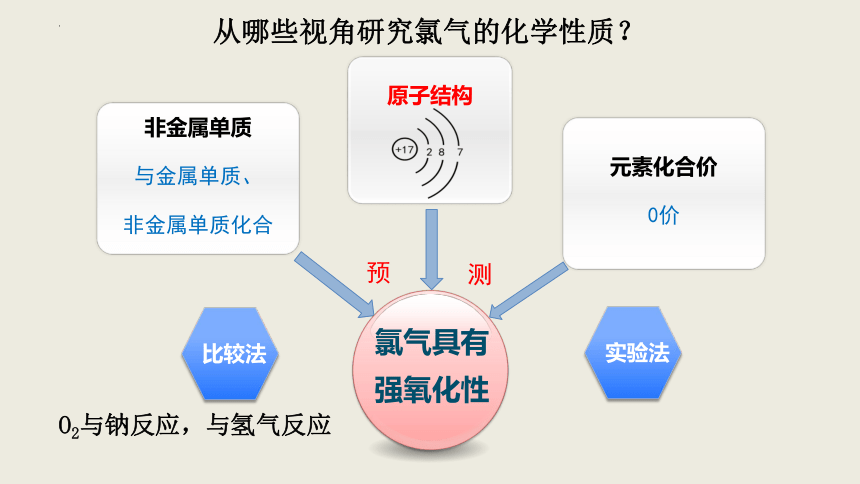
氯气具有
强氧化性
非金属单质
与金属单质、
非金属单质化合
原子结构
预
测
元素化合价
0价
实验法
比较法
O2与钠反应,与氢气反应
从哪些视角研究氯气的化学性质?
2Na+Cl2 2NaCl
剧烈燃烧,火焰黄色,产生大量白烟
1.与金属单质反应
2Fe+3Cl2 2FeCl3
产生大量棕褐色烟,溶液呈棕黄色
1.与金属单质反应
Cu + Cl2 CuCl2
产生大量棕黄色烟,溶液呈蓝色
1.与金属单质反应
1.氯气与金属单质的反应
实验 钠与氯气的反应 铁与氯气的反应 铜与氯气的反应
实验现象 剧烈燃烧,产生 色的烟 剧烈燃烧,产生 色的烟 剧烈燃烧,产生 色的烟
化学方程式
特别提醒:1.氯气和变价金属反应,得到高价金属氯化物。
2.常温时,干燥的氯气不能与铁反应,因此,可用钢瓶储运液氯。
棕褐
二、化学性质
FeCl3 和 CuCl2 能用它们的金属与盐酸反应制取吗?
通过前面观看的氯气与钠、铁、铜和氢气燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
①燃烧不一定有 O 2 参加
②可燃物与氧化剂(如 O 2 、 Cl 2 、 CO 2 等)在一定条件(点燃、灼烧等)下发生的发光、发热的剧烈反应都可以称为燃烧
③燃烧的本质是氧化还原反应
教材P45
你知道游泳池水特殊味道的物质是什么吗?
用氯水消毒,余氯的味道
思考:氯气溶于水,是单纯的气体溶解,还是也发生了化学反应?
实验操作
实验现象
实验结论
有色布条不褪色
有色布条褪色
有色鲜花褪色
干燥的Cl2没有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
结论:干燥的氯气无漂白性,氯气溶于水后生成的另一物质具有漂白性
3.氯气与H2O反应
Cl2 + H2O = HCl + HClO
次氯酸
①强氧化性
可用于漂白和杀菌消毒
②一元弱酸,比碳酸还弱,写离子方程式时不拆。
③不稳定性
2HClO 2HCl+O2↑
光照
具有漂白性
干燥的Cl2
没有漂白性
根据氯气与水的化学反应推测新制氯水中可能存在哪些粒子?
分子: Cl 2 、 H 2 O 、 HClO
Cl2 + H2O = HCl + HClO
离子: H+ 、 Cl- 、 ClO - 、 OH - ( 极少量 )
HCl = H + + Cl -
氯水成分:
Cl2、H2O、HClO
H+、Cl-、ClO-、OH-(极少量)
微点拨
注意:不能用pH试纸测量氯水和次氯酸的pH
物质 液氯 新制氯水 久置氯水
成分
分类
颜色
性质
保存方法
液氯、新制氯水和久置氯水的比较
Cl2
Cl2、HClO、H2O、H+、
Cl-、ClO-、OH-(极少量)
H+、Cl-、
OH-(极少量)、H2O
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
氧化性
酸性、氧化性、漂白性
酸性
特制钢瓶
棕色试剂瓶盛装,置于阴凉处,一般现配现用
置于普通试剂瓶,玻璃塞即可(会腐蚀橡胶)
“三分四离”
练习:为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是____。
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是___。
(3)盛有氯水的试管中有色布条褪色,说明氯水中含有的粒子是______。
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作用的微粒是____,
过一会儿,溶液的颜色褪去,起作用的微粒是_______。
(5)向氯水中滴加硝酸酸化的硝酸银溶液有白色沉淀生成,证明氯水中含有的粒子是____。
Cl2
H+
HClO
H+
HClO
Cl-
(6)氯水经光照后,颜色_________,放出的气体是____,化学方程式为
_______________________,溶液的酸性______(填“增强”“不变”或“减弱”)。所以实验室的氯水应该用___色瓶密封保存,放到_____处。
(7)将氯气通入水中,所得溶液中具有氧化性的含氯微粒是_______________。
(8)将氯水滴入氯化亚铁溶液中,溶液由浅绿色变为黄色,该反应的离子方程式为:______________________。
变浅或褪色
O2
增强
棕
阴暗
Cl2、ClO-、HClO
2Fe2++Cl2=2Fe3++2Cl-
思考:下图为市面上常用的消毒液和漂白剂,为什么不直接用次氯酸作漂白剂?
氯气在水中的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。于是人们在此基础上制得了方便储存和运输的漂白液( NaClO )、漂白粉[ Ca(ClO)2 ]。
新冠的克星
Cl2+2NaOH===NaCl+NaClO+H2O
(1)Cl2与NaOH溶液反应
Cl2+2OH- === Cl-+ClO-+H2O
Cl2的尾气处理
制84消毒液、漂白液
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2) Cl2通入冷的石灰乳
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
制漂白粉和漂粉精
4.氯气与碱反应
有效成分:
NaClO
有效成分: Ca(ClO) 2
常温下氯气与碱反应:氯气 + 碱 = 氯化物 + 次氯酸盐 + 水
真正具有漂白作用的是次氯酸,但漂白粉当中并没有次氯酸,那漂白粉是怎样发挥漂白作用的呢?(漂白原理是什么?)
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
漂白原理:
(强酸制取弱酸)
漂白液、漂白粉、漂白精的漂白原理相同,在酸性条件下生成有漂白、消毒作用的 次氯酸( HClO ) 。氯水、漂白液、漂白粉、漂粉精的漂白作用都是因为反应生成的 HClO 。
漂白粉在空气中长期放置易失效,失效原理是什么?应该如何保存漂白粉?
失效原理:
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
2HClO 2HCl+O2↑ (失效)
光照
密封、干燥、避光保存
漂白粉的广泛使用
用途: 既可做漂白棉、麻、纸张的漂白剂,又可做游泳池及环境的消毒剂。
氯气是一种重要的化工原料:
(1)可大量用于制造盐酸、 有机溶剂 、农药、染料和药品等。
(2)用于自来水的杀菌消毒,制取消毒液、漂白液等。
(3)处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物。
氯气的用途
课堂小结
2.下列各组物质在一定条件下反应,其中生成+3价铁盐的是( )
A.铁和稀硫酸 B.铁和氯化铜溶液
C.铁和氯气 D.铁和氧气
3. 下列氯化物不能通过单质之间直接制取的是( )
A.FeCl2 B.FeCl3 C.NaCl D.CuCl2
C
A
1. 下列说法正确的是( )
A.氯气以液态形式存在时可称作氯水或液氯
B.Cl2有毒,Cl-也有毒
C.Cl2和Cl-都是黄绿色
D.红热的铜丝在氯气中燃烧,生成棕黄色固体CuCl2
D
4.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是
①氯气 ②液氯 ③新制氯水 ④盐酸
A.①② B.①②③ C.③ D.③④
C
5.某城市以“液氯泄漏”作应急预警演习,演习时,下列防护措施合理的是
①及时向上风口和地势较高处转移疏散人群;
②及时戴上用浓烧碱溶液湿润过的口罩;
③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;
④及时戴上用稀纯碱溶液湿润过的口罩;
⑤及时用毛巾包裹活性炭捂住口鼻;
⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
C
2.2 氯及其化合物
第一课时
《氯气的性质》
CaCl2 MgCl2 NaCl
Cl-
Cl2
富集、分离提纯、转化
海水中的重要元素——氯
重要的化工原料
氯是一种重要的“成盐元素”,在自然界中除了以 MgCl2 、 NaCl 、 CaCl2等形式 大量存在于海水中,还存在于陆地的盐湖和盐矿中。
观看实验视频,总结氯气的物理性质
氯气的发现史
氯气的性质
一、物理性质
物理性质
黄绿色气体
比空气大
在水中溶解度不大(1:2)
有刺激性气味
有毒
较低(易液化)
用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。
请同学们根据阅读P44内容,了解氯气的物理性质。
氯气具有
强氧化性
非金属单质
与金属单质、
非金属单质化合
原子结构
预
测
元素化合价
0价
实验法
比较法
O2与钠反应,与氢气反应
从哪些视角研究氯气的化学性质?
2Na+Cl2 2NaCl
剧烈燃烧,火焰黄色,产生大量白烟
1.与金属单质反应
2Fe+3Cl2 2FeCl3
产生大量棕褐色烟,溶液呈棕黄色
1.与金属单质反应
Cu + Cl2 CuCl2
产生大量棕黄色烟,溶液呈蓝色
1.与金属单质反应
1.氯气与金属单质的反应
实验 钠与氯气的反应 铁与氯气的反应 铜与氯气的反应
实验现象 剧烈燃烧,产生 色的烟 剧烈燃烧,产生 色的烟 剧烈燃烧,产生 色的烟
化学方程式
特别提醒:1.氯气和变价金属反应,得到高价金属氯化物。
2.常温时,干燥的氯气不能与铁反应,因此,可用钢瓶储运液氯。
棕褐
二、化学性质
FeCl3 和 CuCl2 能用它们的金属与盐酸反应制取吗?
通过前面观看的氯气与钠、铁、铜和氢气燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
①燃烧不一定有 O 2 参加
②可燃物与氧化剂(如 O 2 、 Cl 2 、 CO 2 等)在一定条件(点燃、灼烧等)下发生的发光、发热的剧烈反应都可以称为燃烧
③燃烧的本质是氧化还原反应
教材P45
你知道游泳池水特殊味道的物质是什么吗?
用氯水消毒,余氯的味道
思考:氯气溶于水,是单纯的气体溶解,还是也发生了化学反应?
实验操作
实验现象
实验结论
有色布条不褪色
有色布条褪色
有色鲜花褪色
干燥的Cl2没有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
在有H2O存在的条件下,Cl2有漂白作用
结论:干燥的氯气无漂白性,氯气溶于水后生成的另一物质具有漂白性
3.氯气与H2O反应
Cl2 + H2O = HCl + HClO
次氯酸
①强氧化性
可用于漂白和杀菌消毒
②一元弱酸,比碳酸还弱,写离子方程式时不拆。
③不稳定性
2HClO 2HCl+O2↑
光照
具有漂白性
干燥的Cl2
没有漂白性
根据氯气与水的化学反应推测新制氯水中可能存在哪些粒子?
分子: Cl 2 、 H 2 O 、 HClO
Cl2 + H2O = HCl + HClO
离子: H+ 、 Cl- 、 ClO - 、 OH - ( 极少量 )
HCl = H + + Cl -
氯水成分:
Cl2、H2O、HClO
H+、Cl-、ClO-、OH-(极少量)
微点拨
注意:不能用pH试纸测量氯水和次氯酸的pH
物质 液氯 新制氯水 久置氯水
成分
分类
颜色
性质
保存方法
液氯、新制氯水和久置氯水的比较
Cl2
Cl2、HClO、H2O、H+、
Cl-、ClO-、OH-(极少量)
H+、Cl-、
OH-(极少量)、H2O
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
氧化性
酸性、氧化性、漂白性
酸性
特制钢瓶
棕色试剂瓶盛装,置于阴凉处,一般现配现用
置于普通试剂瓶,玻璃塞即可(会腐蚀橡胶)
“三分四离”
练习:为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是____。
(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是___。
(3)盛有氯水的试管中有色布条褪色,说明氯水中含有的粒子是______。
(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作用的微粒是____,
过一会儿,溶液的颜色褪去,起作用的微粒是_______。
(5)向氯水中滴加硝酸酸化的硝酸银溶液有白色沉淀生成,证明氯水中含有的粒子是____。
Cl2
H+
HClO
H+
HClO
Cl-
(6)氯水经光照后,颜色_________,放出的气体是____,化学方程式为
_______________________,溶液的酸性______(填“增强”“不变”或“减弱”)。所以实验室的氯水应该用___色瓶密封保存,放到_____处。
(7)将氯气通入水中,所得溶液中具有氧化性的含氯微粒是_______________。
(8)将氯水滴入氯化亚铁溶液中,溶液由浅绿色变为黄色,该反应的离子方程式为:______________________。
变浅或褪色
O2
增强
棕
阴暗
Cl2、ClO-、HClO
2Fe2++Cl2=2Fe3++2Cl-
思考:下图为市面上常用的消毒液和漂白剂,为什么不直接用次氯酸作漂白剂?
氯气在水中的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。于是人们在此基础上制得了方便储存和运输的漂白液( NaClO )、漂白粉[ Ca(ClO)2 ]。
新冠的克星
Cl2+2NaOH===NaCl+NaClO+H2O
(1)Cl2与NaOH溶液反应
Cl2+2OH- === Cl-+ClO-+H2O
Cl2的尾气处理
制84消毒液、漂白液
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2) Cl2通入冷的石灰乳
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
制漂白粉和漂粉精
4.氯气与碱反应
有效成分:
NaClO
有效成分: Ca(ClO) 2
常温下氯气与碱反应:氯气 + 碱 = 氯化物 + 次氯酸盐 + 水
真正具有漂白作用的是次氯酸,但漂白粉当中并没有次氯酸,那漂白粉是怎样发挥漂白作用的呢?(漂白原理是什么?)
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
漂白原理:
(强酸制取弱酸)
漂白液、漂白粉、漂白精的漂白原理相同,在酸性条件下生成有漂白、消毒作用的 次氯酸( HClO ) 。氯水、漂白液、漂白粉、漂粉精的漂白作用都是因为反应生成的 HClO 。
漂白粉在空气中长期放置易失效,失效原理是什么?应该如何保存漂白粉?
失效原理:
Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO
2HClO 2HCl+O2↑ (失效)
光照
密封、干燥、避光保存
漂白粉的广泛使用
用途: 既可做漂白棉、麻、纸张的漂白剂,又可做游泳池及环境的消毒剂。
氯气是一种重要的化工原料:
(1)可大量用于制造盐酸、 有机溶剂 、农药、染料和药品等。
(2)用于自来水的杀菌消毒,制取消毒液、漂白液等。
(3)处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物。
氯气的用途
课堂小结
2.下列各组物质在一定条件下反应,其中生成+3价铁盐的是( )
A.铁和稀硫酸 B.铁和氯化铜溶液
C.铁和氯气 D.铁和氧气
3. 下列氯化物不能通过单质之间直接制取的是( )
A.FeCl2 B.FeCl3 C.NaCl D.CuCl2
C
A
1. 下列说法正确的是( )
A.氯气以液态形式存在时可称作氯水或液氯
B.Cl2有毒,Cl-也有毒
C.Cl2和Cl-都是黄绿色
D.红热的铜丝在氯气中燃烧,生成棕黄色固体CuCl2
D
4.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是
①氯气 ②液氯 ③新制氯水 ④盐酸
A.①② B.①②③ C.③ D.③④
C
5.某城市以“液氯泄漏”作应急预警演习,演习时,下列防护措施合理的是
①及时向上风口和地势较高处转移疏散人群;
②及时戴上用浓烧碱溶液湿润过的口罩;
③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;
④及时戴上用稀纯碱溶液湿润过的口罩;
⑤及时用毛巾包裹活性炭捂住口鼻;
⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
C
