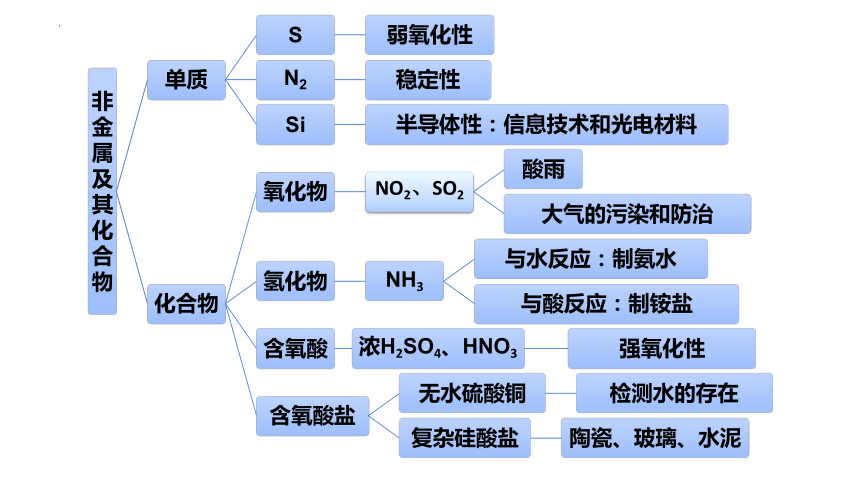
第五章化工生产中的重要非金属元素 复习课件(共55张PPT)2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章化工生产中的重要非金属元素 复习课件(共55张PPT)2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 17:13:24 | ||
图片预览










文档简介
(共55张PPT)
第五章 化工生产中的重要非金属元素
复 习
试管内壁上有硫附着时可用CS2试剂洗涤
俗称 色、态 溶解性
水 酒精 CS2
一、硫
1. 物理性质
黄色或淡黄色晶体
难溶
硫黄
微溶
易溶
2. 化学性质
(1)与金属反应(低价金属硫化物)
(黑色)
(黑色)
Hg +S = HgS (黑色) 用于除去洒落的汞
(2)与非金属单质反应
S+H2 H2S
空气中燃烧
淡蓝色火焰
氧气中燃烧
蓝紫色火焰
单质硫燃烧时,产物只能是SO2,无论O2的量是否
充足,均不会生成SO3。
二、 SO2 的性质
1、物理性质:无色,有刺激性气味、有毒,密度>空气,通常情况下,水:SO2=1:40溶于水
2.用途:①制硫酸 ②漂白纸浆、毛、丝等
③杀菌消毒、食品添加剂(漂白、防腐、抗氧化)
原理:SO2+H2O H2SO3
可逆反应特点:同一反应、同一条件、同时进行 “三同”
3.化学性质
(1)还原性:与氧化性物质反应
如O2 、X2(X=Cl /Br /I) 、酸性高锰酸钾、Fe3+、 Na2O2等
与高锰酸钾: 5SO2 + 2MnO4- + 2H2O = 2Mn2+ + 4H++5SO42-
与卤素:
与O2:
可逆反应
(2)氧化性:只有与S2-反应才体现SO2的氧化性
如:H2S、Na2S
现象:产生黄色沉淀
例 :如何检验某混合气体中含有SO2和CO2?
SO2、CO2
澄清
石灰水
品红溶液
KMnO4
溶液
品红溶液
NaOH溶液
褪色 褪色 不褪色
先浑浊
后澄清
该原理可用于实验室制SO2
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O H2SO4作用
不浓不热不反应
实验现象:品红溶液褪色,紫色石蕊溶液逐渐变红;浸NaOH的棉团的作用吸收多余的SO2,防止污染空气。
处理尾气发生的化学方程式SO2+2NaOH=Na2SO3+H2O
(一)浓硫酸与Cu反应实验
1、螺旋状可抽动铜丝的优点(两点):①控制反应的发生与停止;②增大反应的接触面积
2.实验结束后若想观察到蓝色溶液,应将反应剩余物质加入到水中(原理类似浓硫酸的稀释操作)
3.下列药品能证明反应后烧瓶中确有余酸的是 .
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
4.若检验出反应后有余酸,但仍有Cu未溶解,解释原因随着反应进行,浓硫酸浓度减小,不能与Cu反应。
5.足量Zn与浓硫酸反应,酸是否有剩余?没有 ,整个过程生成的气体有SO2、H2 。
a、d
两点符合绿色化学的设计:
1.螺旋状可抽动铜丝、2.NaOH棉团吸收尾气
(二)浓硫酸与蔗糖(C12H22O11)反应实验
1.现象:蔗糖逐渐变黑→脱水性
体积膨胀,产生刺激性气味气体→强氧化性
2.C+2H2SO4(浓) CO2+2SO2↑+2H2O
不浓不热不反应,H2SO4作用
要事先往蔗糖里滴加少量水的原因:浓硫酸吸水放出大量的热,为C与浓硫酸的反应提供热量。
黑面包实验体现浓H2SO4性质:脱水性、强氧化性
(二)浓硫酸与蔗糖(C12H22O11)反应实验
产物验证:H2O SO2 CO2
请思考可以替代酸性高锰酸钾的是? ①新制氯水②溴水③FeCl3溶液③NaHCO3溶液
判断下列过程浓硫酸体现的性质:
①强酸性 ②强氧化性 ③吸水性 ④脱水性 ⑤难挥发性
(1)往胆矾(CuSO4·5H2O)中加浓硫酸后变白 ③ ;
(2)敞口放置浓硫酸浓度变小 ③ ;
(3)用浓硫酸在纸上书写的字迹变黑 ④ ;
(4)用铁制或铝制槽车运输浓硫酸 ② ;
(5)可用浓硫酸干燥O2、N2、Cl2等气体 ③ ;
(6)浓硫酸与NaCl固体反应制备HCl ⑤ ;
(7)将浓硫酸滴在紫色石蕊试纸上现象是 先变红后变黑 ,体现浓硫酸的 ①④ 性;
SO3+H2O====H2SO4
净化目的:防止催化剂中毒
不能用水淋洗防止形成酸雾
发烟硫酸:98%浓H2SO4吸收了SO3
工业上SO2尾气处理:氨水 (NH4)2SO3 → (NH4)2SO4
氧化
硫黄
一、工业制硫酸
二、不同价态含硫物质的转化
通过氧化还原反应实现不同价态的转化:氧化剂/还原剂
实验一:粗盐提纯
用化学沉淀法去除粗盐中的杂质离子
(杂质:不溶的泥沙和Ca2+、Mg2+、SO42-)
1.除杂原则:除杂试剂要过量,过量试剂要除去
除杂不引杂。过量的原因:使杂质离子沉淀完全
2.步骤:
①溶解:
5.0g
左物右码
玻璃棒作用:搅拌,加速溶解
水不易过量
2.步骤:
①先加入过量的BaCl2溶液,使SO42-沉淀完全;②再加入过量的NaOH溶液,使Mg2+沉淀完全;③再加入过量的Na2CO3溶液,使Ca2+和Ba2+沉淀完全;
【注意】1.分析每步试剂时,写全反应方程式。
加入Na2CO3溶液方程式:
2.加入试剂的顺序为:三种在Na2CO3在BaCl2溶液之后
BaCl2溶液 、 Na2CO3溶液
3.检验沉淀完全的操作:取上层清液,再加沉淀剂,……
检验SO42-是否沉淀完全:取上层清液,再加BaCl2溶液,若无沉淀生成,则证明已沉淀完全;反之,则未沉淀完全
试剂过量,也不要太多
2.步骤:
④过滤;⑤向滤液中加入盐酸,用玻璃棒搅拌,直到没有气泡冒出,并用pH试纸 检测,使滤液呈中性或微酸性。
1.最后过滤一次即可,除去生成的沉淀和不溶性杂质
2.过滤时玻璃棒的作用引流,一贴二低三靠
3.最后加入盐酸的目的是什么?
除去过量的NaOH溶液、Na2CO3溶液
离子方程式写两个,盐酸过量怎么除?
4.过滤和加入盐酸这两步能否颠倒? 否,原因是
沉淀会再次溶解
5.盐酸能否换成硫酸:不能,引杂
最少一次
2.步骤:
最后,将滤液倒入蒸发皿中,用酒精灯加热,同时用玻璃棒不断搅拌,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干.【蒸发结晶的规范操作】
玻璃棒作用:
蒸发结晶的仪器:
区分蒸发皿、坩埚
实验二:SO42-检验
1.SO42-检验:取少量溶液于试管中,先加HCl,无明显现象,再加BaCl2,若生成白色沉淀,则证明有SO42-。(唯一试剂,唯一顺序)必考
①加入稀盐酸排除Ag+ SO32- CO32-离子的干扰
②若加入盐酸酸化的BaCl2溶液,产生白色沉淀,可能含有 Ag+ 离子
若先加BaCl2,再加HCl沉淀不溶解,则可能存在的离子有Ag+。
③加入试剂错误:若用HNO3酸化,则不能排除的离子有Ag+ SO32-
2.变式考察:检验Na2SO3是否变质?
取少量试剂于试管中,先加过量的盐酸,再加BaCl2溶液,若产生白色沉淀,说明Na2SO3变质
1.氮及其化合物
一、N2的性质
1.物理性质:难溶于水,M=28g/mol;只能用排水法收集
用途:保护气、冷冻剂、麻醉剂、合成氨、制硝酸;
2.化学性质:
二、氮的固定:游离态的氮转变为氮的化合物。
1)自然固氮:①生物固氮:植物根瘤菌固氮②雷电作用
雷雨发庄稼:N2+O2 =======2 NO 2NO+O2=2NO2
3NO2+H2O==2HNO3+2NO
2)人工固氮:工业合成氨
不能做Mg的保护气
自然固氮,区分条件
工业合成氨,条件
三、NO的性质
1.物理性质:无色、无味的有毒气体,不溶于水,
只能用排水法收集
2.化学性质: 2NO + O2 == 2NO2 可用于检验NO
NO是不成盐氧化物,不是酸性氧化物
四、NO2的性质:
1.物理性质:红棕色、刺激性气味、有毒,密度比空气大,易溶于水,向上排空气法收集。
不是酸性氧化物
2.化学性质—自然界无纯净的NO2 2NO2 N2O4
①与水: 3NO2 + H2O == 2HNO3 + NO 工业制硝酸
氧化剂:还原剂=1:2应用:除去NO中的NO2
四、NO2的性质:
③与碱:2NO2+2NaOH=NaNO3+NaNO2+H2O
NO:NO2混合1:1时恰好反应
NO+NO2+2NaOH=2NaNO2+H2O
NO、NO2满足<1:1比例时,可被NaOH完全吸收。如果没有被完全吸收可以通入O2。
实验5-5 在一支50ml的注射器里充入20mlNO,然后吸入5ml水,用乳胶管和弹簧夹封住管口,振荡注射器,观察无明显现象。打开弹簧夹,快速吸入10ml空气后夹上弹簧夹,观察气体由无色变为红棕色。振荡注射器,再观察气体由红棕色变为无色,注射器塞子向左移动
化学反应:2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
要将NO充分转化可以采取措施:反复通入O2
工业生产硝酸的启示:向其中加入一定量的O2可提高二氧化氮的利用率,增大硝酸的产率
4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
①当混合气体NO2 O2满足4:1时,液体全部充满试管。
②当混合气体NO O2满足4:3时,液体全部充满试管。
1.氮及其化合物
一、NH3的性质
1.物理性质:无色、有刺激性气味、极易溶于水( 1:700 )氨易液化,液化时放热。液氨汽化时吸收大量的热,使周围温度急剧降低。因此,液氨可用作制冷剂。
2.化学性质:
(1)与水反应
三分子:NH3、H2O、NH3·H2O 三离子:NH4+、OH-、H+
NH3+H2O
NH3·H2O
注:1、氨水是混合物,氨气、液氨、NH3·H2O是纯净物。
2、氨水不稳定,见光受热易分解需用棕色试剂瓶避光阴凉处保存
3、氨水、氯水久置后均变质,但原理不同!
氨水久置,NH3逸出,浓度减小,碱性减弱;
(非氧化还原)
氯水久置,最终HClO分解为HCl,酸性增强。
(氧化还原)
氨水显碱性的原因
+OH-
2.化学性质:
(2)与酸反应:与挥发性酸有白烟
NH3+HCl == NH4Cl (白烟)→NH3与HCl互检
NH3+HNO3 === NH4NO3 (白烟)→NH3与挥发性酸生成盐是固体小颗粒,现象为白烟
2NH3(过量)+H2SO4 === (NH4)2SO4
NH3(少量)+H2SO4 === NH4HSO4
(3)还原性 ①与O2:
催化氧化:4NH3+5O2===4NO+6H2O→工业制硝酸的基础
催化剂
4.NH3是高中阶段唯一一个碱性气体
检验NH3的方法:
①湿润的红色石蕊试纸变蓝
②使酚酞试液变红
③湿润的PH试纸变红
④蘸有浓盐酸的玻璃棒靠近产生白烟
二、喷泉实验 实验5-6
喷泉实验成功的关键:
①气密性要好(否则无喷泉现象)
②气体要充满烧瓶(否则液体喷不满)
③烧瓶要干燥
一、铵盐:铵根离子(NH4+)与酸根离子构成的化合物
1.受热易分解——产物不一定有NH3 如:NH4NO3
NH4HCO3 == H2O +CO2 ↑ +NH3↑
△
NH4Cl == NH3↑+HCl ↑ 试管底部分解,试管口重新化合
△
2.与碱反应:加热→NH3,不加热→NH3·H2O
NH4Cl +NaOH===NaCl+NH3↑+ H2O
(NH4)2CO3 +2NaOH===Na2CO3+2NH3↑+ 2H2O
铵盐与强碱离子方程式:NH4++OH==NH3↑+H2O
3.NH4+检验的规范叙述:(取加若则)
取待测液少许于试管中,向其中加入NaOH溶液并加热,
若产生能使湿润的红色石蕊试纸变蓝的气体,则含有NH4+
4.实验方法证明某种无色晶体是(NH4)2SO4
阴阳离子均检验,先加水溶解,再分别检验NH4+、SO42-
△
△
二、实验室制氨气
1.原理:试剂:NH4Cl、Ca(OH)2
2NH4Cl+Ca(OH)2===CaCl2+2H2O+2NH3↑
是复分解反应,但不是离子反应,固体反应
注意事项:
①仪器:固固加热型,酒精灯(加热) 试管口略向下倾斜
②收集方法:向下排空气,导管伸入试管底部
③干棉花的作用:减小对流,提高氨气的收集速度和纯度
若为湿棉花:还有吸收尾气的作用
棉花还可以沾稀硫酸
△
试剂选择
①不用NH4NO3原因:加热过程中NH4NO3分解易爆炸
②不能直接加热NH4Cl固体制NH3
③若改用直接加热NH4HCO3、(NH4)2CO3固体制NH3
应在收集装置前加碱石灰除CO2
2.除杂、干燥(碱石灰)
×
CaCl2+8NH3==CaCl2 8NH3
干燥NH3应选: ①浓H2SO4 ②P2O5 ③碱石灰 ④无水CaCl2
3.收集:向下排空气法
4.验满:试纸必须湿润/瓶口验满
①用湿润的红色石蕊试纸靠近试管口,试纸变蓝
②湿润的无色酚酞试纸靠近试管口,试纸变红
③湿润的pH试纸靠近试管口,试纸变蓝
④蘸有浓盐酸的玻璃棒靠近试管口 产生白烟
⑤遇氯气靠近试管口,产生白烟
5.尾气处理:(用水或稀酸吸收氨气→防倒吸)
a b d e
三、实验室快速制取NH3的方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH ①NaOH溶于水放热,促使NH3·H2O分解,②OH-浓度的增大也有利于NH3的逸出
浓氨水+固体CaO ①CaO与水反应消耗水,使溶剂(水)减少②反应放热,促进NH3逸出; ③生成OH-,OH-浓度的增大也有利于NH3的逸出
NH3+H2O NH3·H2O NH4++OH-
1.氮及其化合物
一、硝酸的化学性质
1.不稳定性:
保存在棕色细口瓶(玻璃塞)中,并放置在阴凉处
【思考】浓硝酸呈黄色的原因:生成的NO2溶解在硝酸中
如何消除黄色?通入O2
2.酸性
(1)指示剂:
①稀硝酸使紫色石蕊试液变红
②浓硝酸使紫色石蕊试液先变红后褪色(酸性、氧化性)
(2)与部分盐反应(如Na2CO3)CO32-+2H+=CO2+H2O
(3)与碱、NH3反应:NH3+HNO3=NH4NO3
现象:产生白烟
3.强氧化性:体现在+5价的N上,浓度越大,氧化性越强
浓HNO3还原产物为NO2,稀HNO3还原产物为NO
(1)与金属Cu反应-装置
主要反应现象(海陆空) 反应原理化学方程式
浓硝酸与铜 常温下反应剧烈,溶液变为绿色 ,铜丝逐渐变细,试管上方出现红棕色气体 溶液绿色是因为溶解了红棕色的NO2,加水可变为蓝色
稀硝酸与铜 常温下反应比较温和,溶液变为蓝色,铜丝逐渐变细,试管上方出现无色气体
硝酸在反应中体现:酸性和氧化性
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2O
3Cu+8H++2NO3=
3Cu2++2NO↑+4H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
二、工业制硝酸(3个反应) 基础是氨的催化氧化
①4NH3+5O2 4NO+6H2O (氨的催化氧化)
②2NO+O2=2NO2
③3NO2+H2O=NO+2HNO3
实际生产中可以通入过量空气(或氧气)使NO完全转化为硝酸
酸雨的来源:SO2、NO、NO2
空气中SO2来源:
①煤、石油的燃烧 ②金属矿物冶炼;
氮氧化物来源:①汽车尾气(汽车内燃机高温使空气中N2与O2反应)②工业制硝酸废气中的NO、NO2 。
O2+2H2SO3=2H2SO4
SO3+H2O=H2SO4
2SO2+O2 2SO3
催化剂
SO2+H2O H2SO3
途径1
途径2
一、1.酸雨的形成:两种类型
硝酸型:
硝酸型酸雨的形成过程都是氧化还原反应
硫酸型:
硫酸型酸雨在空气中久置pH降低原因:H2SO3转化为H2SO4
N2+O2=高温=2NO 2NO+O2 == 2NO2
3NO2+H2O == 2HNO3+NO
2、酸雨的吸收处理:
1.Si在元素周期表中的位置:第三周期第ⅣA族(不容易得也不容易失去电子),处于金属与非金属的过渡位置,其导电性介于导体和绝缘体之间,是应用最为广泛的半导体材料,Si在自然界存在:主要以硅酸盐和氧化物的形式 (无游离态)
2.SiO2存在于水晶、玛瑙、沙子、石英,光导纤维,饰品
一、硅 用途:与电有关!
应用最广泛的半导体材料,做硅芯片、硅太阳能电池
二、SiO2是酸性氧化物 用途:与光有关!
做建筑材料:沙子;
做饰品水晶、玛瑙;做石英坩埚、玻璃坩埚;
①与HF SiO2 + 4HF =SiF4↑ + 2H2O 用途:刻蚀玻璃
②与NaOH SiO2+2NaOH ==Na2SiO3+ H2O
③与盐:SiO2+Na2CO3 =高温=Na2SiO3+ CO2↑
SiO2+CaCO3 =高温=CaSiO3+ CO2↑
第一步中C是过量的,所以产物为CO,不是CO2 ,C过量,会发生下列反应SiO2 +3C==SiC+2CO↑所以粗硅中所含杂质为SiC、C。H2 、HCl可循环利用
三、硅的制备(从沙滩到用户)
①SiO2 +2C==== Si(粗硅)+2CO↑
②Si(粗硅)+3HCl=== SiHCl3+H2
③SiHCl3+2H2=== Si(纯)+3HCl
1800-2000℃
300℃
1100℃
不可证明非金属性强弱
气态SiHCl3、H2高温发生反应制的固态高纯硅
酸性比较
1、比较盐酸、碳酸、硅酸酸性强弱。
(1)①盐酸②CaCO3③饱和NaHCO3溶液④Na2SiO3溶液
(2)A中产生气泡,酸性:盐酸>H2CO3
(3) B作用吸收挥发的HCl,防干扰
(4) C中出现白色沉淀,酸性: H2CO3 >H2SiO3
2.若比较Cl、C、Si非金属强弱(比较最高价氧化物对应水化物酸性,所以把①换成HClO4)
SiO2不可一步制H2SiO3,用SiO2制备硅酸的两步反应:
① SiO2+2NaOH ==Na2SiO3+ H2O
②2HCl+Na2SiO3 === H2SiO3 ↓ +2NaCl
或CO2+H2O+Na2SiO3 === H2SiO3 ↓ +Na2CO3
CO2+H2O+Na2SiO3 === H2SiO3 ↓ +Na2CO3
①
②
③
④
传统非金属材料
1.有下列物品或设施:
①陶瓷餐具 ②砖瓦 ③混凝土桥墩 ④门窗玻璃 ⑤水晶镜片 ⑥石英钟 ⑦水晶项链 ⑧硅太阳能电池 ⑨光导纤维
⑩计算机芯片
(1)使用了硅单质的是
(2)使用了二氧化硅的是
(3)使用了硅酸盐材料的是
(1)⑧⑩
(2)⑤⑥⑦⑨
(3)①②③④
2.下列过程能一步制得的是
①Na2CO3→Na2SiO3 ②Na2SiO3→Na2CO3 ③SiO2→H2SiO3
①②
SiO2+Na2CO3 =高温=Na2SiO3+ CO2↑
CO2+H2O+Na2SiO3 === H2SiO3 ↓ +Na2CO3
第五章 化工生产中的重要非金属元素
复 习
试管内壁上有硫附着时可用CS2试剂洗涤
俗称 色、态 溶解性
水 酒精 CS2
一、硫
1. 物理性质
黄色或淡黄色晶体
难溶
硫黄
微溶
易溶
2. 化学性质
(1)与金属反应(低价金属硫化物)
(黑色)
(黑色)
Hg +S = HgS (黑色) 用于除去洒落的汞
(2)与非金属单质反应
S+H2 H2S
空气中燃烧
淡蓝色火焰
氧气中燃烧
蓝紫色火焰
单质硫燃烧时,产物只能是SO2,无论O2的量是否
充足,均不会生成SO3。
二、 SO2 的性质
1、物理性质:无色,有刺激性气味、有毒,密度>空气,通常情况下,水:SO2=1:40溶于水
2.用途:①制硫酸 ②漂白纸浆、毛、丝等
③杀菌消毒、食品添加剂(漂白、防腐、抗氧化)
原理:SO2+H2O H2SO3
可逆反应特点:同一反应、同一条件、同时进行 “三同”
3.化学性质
(1)还原性:与氧化性物质反应
如O2 、X2(X=Cl /Br /I) 、酸性高锰酸钾、Fe3+、 Na2O2等
与高锰酸钾: 5SO2 + 2MnO4- + 2H2O = 2Mn2+ + 4H++5SO42-
与卤素:
与O2:
可逆反应
(2)氧化性:只有与S2-反应才体现SO2的氧化性
如:H2S、Na2S
现象:产生黄色沉淀
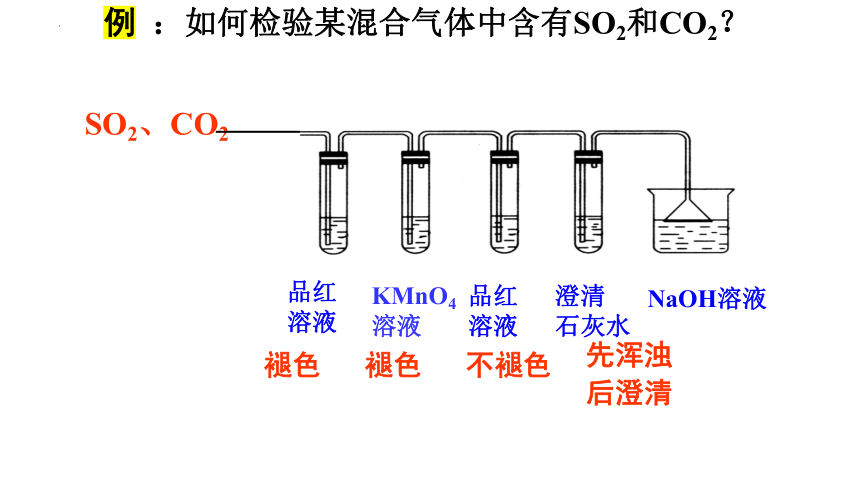
例 :如何检验某混合气体中含有SO2和CO2?
SO2、CO2
澄清
石灰水
品红溶液
KMnO4
溶液
品红溶液
NaOH溶液
褪色 褪色 不褪色
先浑浊
后澄清
该原理可用于实验室制SO2
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O H2SO4作用
不浓不热不反应
实验现象:品红溶液褪色,紫色石蕊溶液逐渐变红;浸NaOH的棉团的作用吸收多余的SO2,防止污染空气。
处理尾气发生的化学方程式SO2+2NaOH=Na2SO3+H2O
(一)浓硫酸与Cu反应实验
1、螺旋状可抽动铜丝的优点(两点):①控制反应的发生与停止;②增大反应的接触面积
2.实验结束后若想观察到蓝色溶液,应将反应剩余物质加入到水中(原理类似浓硫酸的稀释操作)
3.下列药品能证明反应后烧瓶中确有余酸的是 .
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
4.若检验出反应后有余酸,但仍有Cu未溶解,解释原因随着反应进行,浓硫酸浓度减小,不能与Cu反应。
5.足量Zn与浓硫酸反应,酸是否有剩余?没有 ,整个过程生成的气体有SO2、H2 。
a、d
两点符合绿色化学的设计:
1.螺旋状可抽动铜丝、2.NaOH棉团吸收尾气
(二)浓硫酸与蔗糖(C12H22O11)反应实验
1.现象:蔗糖逐渐变黑→脱水性
体积膨胀,产生刺激性气味气体→强氧化性
2.C+2H2SO4(浓) CO2+2SO2↑+2H2O
不浓不热不反应,H2SO4作用
要事先往蔗糖里滴加少量水的原因:浓硫酸吸水放出大量的热,为C与浓硫酸的反应提供热量。
黑面包实验体现浓H2SO4性质:脱水性、强氧化性
(二)浓硫酸与蔗糖(C12H22O11)反应实验
产物验证:H2O SO2 CO2
请思考可以替代酸性高锰酸钾的是? ①新制氯水②溴水③FeCl3溶液③NaHCO3溶液
判断下列过程浓硫酸体现的性质:
①强酸性 ②强氧化性 ③吸水性 ④脱水性 ⑤难挥发性
(1)往胆矾(CuSO4·5H2O)中加浓硫酸后变白 ③ ;
(2)敞口放置浓硫酸浓度变小 ③ ;
(3)用浓硫酸在纸上书写的字迹变黑 ④ ;
(4)用铁制或铝制槽车运输浓硫酸 ② ;
(5)可用浓硫酸干燥O2、N2、Cl2等气体 ③ ;
(6)浓硫酸与NaCl固体反应制备HCl ⑤ ;
(7)将浓硫酸滴在紫色石蕊试纸上现象是 先变红后变黑 ,体现浓硫酸的 ①④ 性;
SO3+H2O====H2SO4
净化目的:防止催化剂中毒
不能用水淋洗防止形成酸雾
发烟硫酸:98%浓H2SO4吸收了SO3
工业上SO2尾气处理:氨水 (NH4)2SO3 → (NH4)2SO4
氧化
硫黄
一、工业制硫酸
二、不同价态含硫物质的转化
通过氧化还原反应实现不同价态的转化:氧化剂/还原剂
实验一:粗盐提纯
用化学沉淀法去除粗盐中的杂质离子
(杂质:不溶的泥沙和Ca2+、Mg2+、SO42-)
1.除杂原则:除杂试剂要过量,过量试剂要除去
除杂不引杂。过量的原因:使杂质离子沉淀完全
2.步骤:
①溶解:
5.0g
左物右码
玻璃棒作用:搅拌,加速溶解
水不易过量
2.步骤:
①先加入过量的BaCl2溶液,使SO42-沉淀完全;②再加入过量的NaOH溶液,使Mg2+沉淀完全;③再加入过量的Na2CO3溶液,使Ca2+和Ba2+沉淀完全;
【注意】1.分析每步试剂时,写全反应方程式。
加入Na2CO3溶液方程式:
2.加入试剂的顺序为:三种在Na2CO3在BaCl2溶液之后
BaCl2溶液 、 Na2CO3溶液
3.检验沉淀完全的操作:取上层清液,再加沉淀剂,……
检验SO42-是否沉淀完全:取上层清液,再加BaCl2溶液,若无沉淀生成,则证明已沉淀完全;反之,则未沉淀完全
试剂过量,也不要太多
2.步骤:
④过滤;⑤向滤液中加入盐酸,用玻璃棒搅拌,直到没有气泡冒出,并用pH试纸 检测,使滤液呈中性或微酸性。
1.最后过滤一次即可,除去生成的沉淀和不溶性杂质
2.过滤时玻璃棒的作用引流,一贴二低三靠
3.最后加入盐酸的目的是什么?
除去过量的NaOH溶液、Na2CO3溶液
离子方程式写两个,盐酸过量怎么除?
4.过滤和加入盐酸这两步能否颠倒? 否,原因是
沉淀会再次溶解
5.盐酸能否换成硫酸:不能,引杂
最少一次
2.步骤:
最后,将滤液倒入蒸发皿中,用酒精灯加热,同时用玻璃棒不断搅拌,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干.【蒸发结晶的规范操作】
玻璃棒作用:
蒸发结晶的仪器:
区分蒸发皿、坩埚
实验二:SO42-检验
1.SO42-检验:取少量溶液于试管中,先加HCl,无明显现象,再加BaCl2,若生成白色沉淀,则证明有SO42-。(唯一试剂,唯一顺序)必考
①加入稀盐酸排除Ag+ SO32- CO32-离子的干扰
②若加入盐酸酸化的BaCl2溶液,产生白色沉淀,可能含有 Ag+ 离子
若先加BaCl2,再加HCl沉淀不溶解,则可能存在的离子有Ag+。
③加入试剂错误:若用HNO3酸化,则不能排除的离子有Ag+ SO32-
2.变式考察:检验Na2SO3是否变质?
取少量试剂于试管中,先加过量的盐酸,再加BaCl2溶液,若产生白色沉淀,说明Na2SO3变质
1.氮及其化合物
一、N2的性质
1.物理性质:难溶于水,M=28g/mol;只能用排水法收集
用途:保护气、冷冻剂、麻醉剂、合成氨、制硝酸;
2.化学性质:
二、氮的固定:游离态的氮转变为氮的化合物。
1)自然固氮:①生物固氮:植物根瘤菌固氮②雷电作用
雷雨发庄稼:N2+O2 =======2 NO 2NO+O2=2NO2
3NO2+H2O==2HNO3+2NO
2)人工固氮:工业合成氨
不能做Mg的保护气
自然固氮,区分条件
工业合成氨,条件
三、NO的性质
1.物理性质:无色、无味的有毒气体,不溶于水,
只能用排水法收集
2.化学性质: 2NO + O2 == 2NO2 可用于检验NO
NO是不成盐氧化物,不是酸性氧化物
四、NO2的性质:
1.物理性质:红棕色、刺激性气味、有毒,密度比空气大,易溶于水,向上排空气法收集。
不是酸性氧化物
2.化学性质—自然界无纯净的NO2 2NO2 N2O4
①与水: 3NO2 + H2O == 2HNO3 + NO 工业制硝酸
氧化剂:还原剂=1:2应用:除去NO中的NO2
四、NO2的性质:
③与碱:2NO2+2NaOH=NaNO3+NaNO2+H2O
NO:NO2混合1:1时恰好反应
NO+NO2+2NaOH=2NaNO2+H2O
NO、NO2满足<1:1比例时,可被NaOH完全吸收。如果没有被完全吸收可以通入O2。
实验5-5 在一支50ml的注射器里充入20mlNO,然后吸入5ml水,用乳胶管和弹簧夹封住管口,振荡注射器,观察无明显现象。打开弹簧夹,快速吸入10ml空气后夹上弹簧夹,观察气体由无色变为红棕色。振荡注射器,再观察气体由红棕色变为无色,注射器塞子向左移动
化学反应:2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
要将NO充分转化可以采取措施:反复通入O2
工业生产硝酸的启示:向其中加入一定量的O2可提高二氧化氮的利用率,增大硝酸的产率
4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
①当混合气体NO2 O2满足4:1时,液体全部充满试管。
②当混合气体NO O2满足4:3时,液体全部充满试管。
1.氮及其化合物
一、NH3的性质
1.物理性质:无色、有刺激性气味、极易溶于水( 1:700 )氨易液化,液化时放热。液氨汽化时吸收大量的热,使周围温度急剧降低。因此,液氨可用作制冷剂。
2.化学性质:
(1)与水反应
三分子:NH3、H2O、NH3·H2O 三离子:NH4+、OH-、H+
NH3+H2O
NH3·H2O
注:1、氨水是混合物,氨气、液氨、NH3·H2O是纯净物。
2、氨水不稳定,见光受热易分解需用棕色试剂瓶避光阴凉处保存
3、氨水、氯水久置后均变质,但原理不同!
氨水久置,NH3逸出,浓度减小,碱性减弱;
(非氧化还原)
氯水久置,最终HClO分解为HCl,酸性增强。
(氧化还原)
氨水显碱性的原因
+OH-
2.化学性质:
(2)与酸反应:与挥发性酸有白烟
NH3+HCl == NH4Cl (白烟)→NH3与HCl互检
NH3+HNO3 === NH4NO3 (白烟)→NH3与挥发性酸生成盐是固体小颗粒,现象为白烟
2NH3(过量)+H2SO4 === (NH4)2SO4
NH3(少量)+H2SO4 === NH4HSO4
(3)还原性 ①与O2:
催化氧化:4NH3+5O2===4NO+6H2O→工业制硝酸的基础
催化剂
4.NH3是高中阶段唯一一个碱性气体
检验NH3的方法:
①湿润的红色石蕊试纸变蓝
②使酚酞试液变红
③湿润的PH试纸变红
④蘸有浓盐酸的玻璃棒靠近产生白烟
二、喷泉实验 实验5-6
喷泉实验成功的关键:
①气密性要好(否则无喷泉现象)
②气体要充满烧瓶(否则液体喷不满)
③烧瓶要干燥
一、铵盐:铵根离子(NH4+)与酸根离子构成的化合物
1.受热易分解——产物不一定有NH3 如:NH4NO3
NH4HCO3 == H2O +CO2 ↑ +NH3↑
△
NH4Cl == NH3↑+HCl ↑ 试管底部分解,试管口重新化合
△
2.与碱反应:加热→NH3,不加热→NH3·H2O
NH4Cl +NaOH===NaCl+NH3↑+ H2O
(NH4)2CO3 +2NaOH===Na2CO3+2NH3↑+ 2H2O
铵盐与强碱离子方程式:NH4++OH==NH3↑+H2O
3.NH4+检验的规范叙述:(取加若则)
取待测液少许于试管中,向其中加入NaOH溶液并加热,
若产生能使湿润的红色石蕊试纸变蓝的气体,则含有NH4+
4.实验方法证明某种无色晶体是(NH4)2SO4
阴阳离子均检验,先加水溶解,再分别检验NH4+、SO42-
△
△
二、实验室制氨气
1.原理:试剂:NH4Cl、Ca(OH)2
2NH4Cl+Ca(OH)2===CaCl2+2H2O+2NH3↑
是复分解反应,但不是离子反应,固体反应
注意事项:
①仪器:固固加热型,酒精灯(加热) 试管口略向下倾斜
②收集方法:向下排空气,导管伸入试管底部
③干棉花的作用:减小对流,提高氨气的收集速度和纯度
若为湿棉花:还有吸收尾气的作用
棉花还可以沾稀硫酸
△
试剂选择
①不用NH4NO3原因:加热过程中NH4NO3分解易爆炸
②不能直接加热NH4Cl固体制NH3
③若改用直接加热NH4HCO3、(NH4)2CO3固体制NH3
应在收集装置前加碱石灰除CO2
2.除杂、干燥(碱石灰)
×
CaCl2+8NH3==CaCl2 8NH3
干燥NH3应选: ①浓H2SO4 ②P2O5 ③碱石灰 ④无水CaCl2
3.收集:向下排空气法
4.验满:试纸必须湿润/瓶口验满
①用湿润的红色石蕊试纸靠近试管口,试纸变蓝
②湿润的无色酚酞试纸靠近试管口,试纸变红
③湿润的pH试纸靠近试管口,试纸变蓝
④蘸有浓盐酸的玻璃棒靠近试管口 产生白烟
⑤遇氯气靠近试管口,产生白烟
5.尾气处理:(用水或稀酸吸收氨气→防倒吸)
a b d e
三、实验室快速制取NH3的方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH ①NaOH溶于水放热,促使NH3·H2O分解,②OH-浓度的增大也有利于NH3的逸出
浓氨水+固体CaO ①CaO与水反应消耗水,使溶剂(水)减少②反应放热,促进NH3逸出; ③生成OH-,OH-浓度的增大也有利于NH3的逸出
NH3+H2O NH3·H2O NH4++OH-
1.氮及其化合物
一、硝酸的化学性质
1.不稳定性:
保存在棕色细口瓶(玻璃塞)中,并放置在阴凉处
【思考】浓硝酸呈黄色的原因:生成的NO2溶解在硝酸中
如何消除黄色?通入O2
2.酸性
(1)指示剂:
①稀硝酸使紫色石蕊试液变红
②浓硝酸使紫色石蕊试液先变红后褪色(酸性、氧化性)
(2)与部分盐反应(如Na2CO3)CO32-+2H+=CO2+H2O
(3)与碱、NH3反应:NH3+HNO3=NH4NO3
现象:产生白烟
3.强氧化性:体现在+5价的N上,浓度越大,氧化性越强
浓HNO3还原产物为NO2,稀HNO3还原产物为NO
(1)与金属Cu反应-装置
主要反应现象(海陆空) 反应原理化学方程式
浓硝酸与铜 常温下反应剧烈,溶液变为绿色 ,铜丝逐渐变细,试管上方出现红棕色气体 溶液绿色是因为溶解了红棕色的NO2,加水可变为蓝色
稀硝酸与铜 常温下反应比较温和,溶液变为蓝色,铜丝逐渐变细,试管上方出现无色气体
硝酸在反应中体现:酸性和氧化性
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2O
3Cu+8H++2NO3=
3Cu2++2NO↑+4H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
二、工业制硝酸(3个反应) 基础是氨的催化氧化
①4NH3+5O2 4NO+6H2O (氨的催化氧化)
②2NO+O2=2NO2
③3NO2+H2O=NO+2HNO3
实际生产中可以通入过量空气(或氧气)使NO完全转化为硝酸
酸雨的来源:SO2、NO、NO2
空气中SO2来源:
①煤、石油的燃烧 ②金属矿物冶炼;
氮氧化物来源:①汽车尾气(汽车内燃机高温使空气中N2与O2反应)②工业制硝酸废气中的NO、NO2 。
O2+2H2SO3=2H2SO4
SO3+H2O=H2SO4
2SO2+O2 2SO3
催化剂
SO2+H2O H2SO3
途径1
途径2
一、1.酸雨的形成:两种类型
硝酸型:
硝酸型酸雨的形成过程都是氧化还原反应
硫酸型:
硫酸型酸雨在空气中久置pH降低原因:H2SO3转化为H2SO4
N2+O2=高温=2NO 2NO+O2 == 2NO2
3NO2+H2O == 2HNO3+NO
2、酸雨的吸收处理:
1.Si在元素周期表中的位置:第三周期第ⅣA族(不容易得也不容易失去电子),处于金属与非金属的过渡位置,其导电性介于导体和绝缘体之间,是应用最为广泛的半导体材料,Si在自然界存在:主要以硅酸盐和氧化物的形式 (无游离态)
2.SiO2存在于水晶、玛瑙、沙子、石英,光导纤维,饰品
一、硅 用途:与电有关!
应用最广泛的半导体材料,做硅芯片、硅太阳能电池
二、SiO2是酸性氧化物 用途:与光有关!
做建筑材料:沙子;
做饰品水晶、玛瑙;做石英坩埚、玻璃坩埚;
①与HF SiO2 + 4HF =SiF4↑ + 2H2O 用途:刻蚀玻璃
②与NaOH SiO2+2NaOH ==Na2SiO3+ H2O
③与盐:SiO2+Na2CO3 =高温=Na2SiO3+ CO2↑
SiO2+CaCO3 =高温=CaSiO3+ CO2↑
第一步中C是过量的,所以产物为CO,不是CO2 ,C过量,会发生下列反应SiO2 +3C==SiC+2CO↑所以粗硅中所含杂质为SiC、C。H2 、HCl可循环利用
三、硅的制备(从沙滩到用户)
①SiO2 +2C==== Si(粗硅)+2CO↑
②Si(粗硅)+3HCl=== SiHCl3+H2
③SiHCl3+2H2=== Si(纯)+3HCl
1800-2000℃
300℃
1100℃
不可证明非金属性强弱
气态SiHCl3、H2高温发生反应制的固态高纯硅
酸性比较
1、比较盐酸、碳酸、硅酸酸性强弱。
(1)①盐酸②CaCO3③饱和NaHCO3溶液④Na2SiO3溶液
(2)A中产生气泡,酸性:盐酸>H2CO3
(3) B作用吸收挥发的HCl,防干扰
(4) C中出现白色沉淀,酸性: H2CO3 >H2SiO3
2.若比较Cl、C、Si非金属强弱(比较最高价氧化物对应水化物酸性,所以把①换成HClO4)
SiO2不可一步制H2SiO3,用SiO2制备硅酸的两步反应:
① SiO2+2NaOH ==Na2SiO3+ H2O
②2HCl+Na2SiO3 === H2SiO3 ↓ +2NaCl
或CO2+H2O+Na2SiO3 === H2SiO3 ↓ +Na2CO3
CO2+H2O+Na2SiO3 === H2SiO3 ↓ +Na2CO3
①
②
③
④
传统非金属材料
1.有下列物品或设施:
①陶瓷餐具 ②砖瓦 ③混凝土桥墩 ④门窗玻璃 ⑤水晶镜片 ⑥石英钟 ⑦水晶项链 ⑧硅太阳能电池 ⑨光导纤维
⑩计算机芯片
(1)使用了硅单质的是
(2)使用了二氧化硅的是
(3)使用了硅酸盐材料的是
(1)⑧⑩
(2)⑤⑥⑦⑨
(3)①②③④
2.下列过程能一步制得的是
①Na2CO3→Na2SiO3 ②Na2SiO3→Na2CO3 ③SiO2→H2SiO3
①②
SiO2+Na2CO3 =高温=Na2SiO3+ CO2↑
CO2+H2O+Na2SiO3 === H2SiO3 ↓ +Na2CO3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
