2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 第2节 第3课时 氯气的实验室制法 氯离子的检验 课时同步练(含答案)
文档属性
| 名称 | 2023秋高中化学人教版2019必修1 第二章 海水中的重要元素—钠和氯 第2节 第3课时 氯气的实验室制法 氯离子的检验 课时同步练(含答案) |

|
|
| 格式 | DOC | ||
| 文件大小 | 311.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-14 00:00:00 | ||
图片预览


文档简介
第3课时 氯气的实验室制法 氯离子的检验
1. 常温下,将两种气体同时通入足量的NaOH溶液中,气体被完全吸收,则这两种气体是( )
A. Cl2和H2 B. Cl2和HCl
C. O2和HCl D. N2和Cl2
2. 下列物质中,存在氯离子的是( )
A. 氯酸钾溶液 B. 次氯酸钠溶液
C. 液氯 D. 氯水
3. 下列关于Cl-的说法中,正确的是( )
A. Cl-呈黄绿色 B. Cl-有毒
C. Cl-有强氧化性 D. Cl-有稳定结构
4. 下列能证明某溶液中含有NaCl的是( )
A. 焰色反应是黄色
B. 溶液有咸味
C. 取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D. 焰色反应是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
5. 氯气是制备含氯化合物的重要原料。下列有关氯气的实验装置或操作能达到实验目的的是( )
6. 实验室制取的氯气往往含有水蒸气和HCl气体杂质,若想得到纯净、干燥的氯气,下列试剂及顺序正确的是( )
A. 浓硫酸、氢氧化钠溶液 B. 氢氧化钠溶液、浓硫酸
C. 蒸馏水、浓硫酸 D. 饱和食盐水、浓硫酸
7. 下列说法中正确的是( )
① 把氯气通入装有湿润的有色布条的集气瓶中,有色布条的颜色褪去,说明氯气具有漂白性
② 实验室制取氯气时,为了防止环境污染,多余的氯气可以用饱和NaCl溶液吸收
③ 久置氯水的酸性强于新制氯水
④ 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液中
⑤ 除去HCl气体中的Cl2,可将气体通入氢氧化钠溶液中
A. ①③④ B. ①③
C. ③ D. ①②⑤
8. 实验室用MnO2和浓盐酸在加热条件下反应制取Cl2,下列说法正确的是( )
A. 反应中HCl既表现酸性,又表现还原性
B. 用饱和碳酸氢钠溶液可除去Cl2中的HCl
C. 用NaOH溶液吸收Cl2时,反应中Cl2只作氧化剂
D. 将湿润的有色布条伸入集满Cl2的集气瓶中,布条褪色说明Cl2具有漂白性
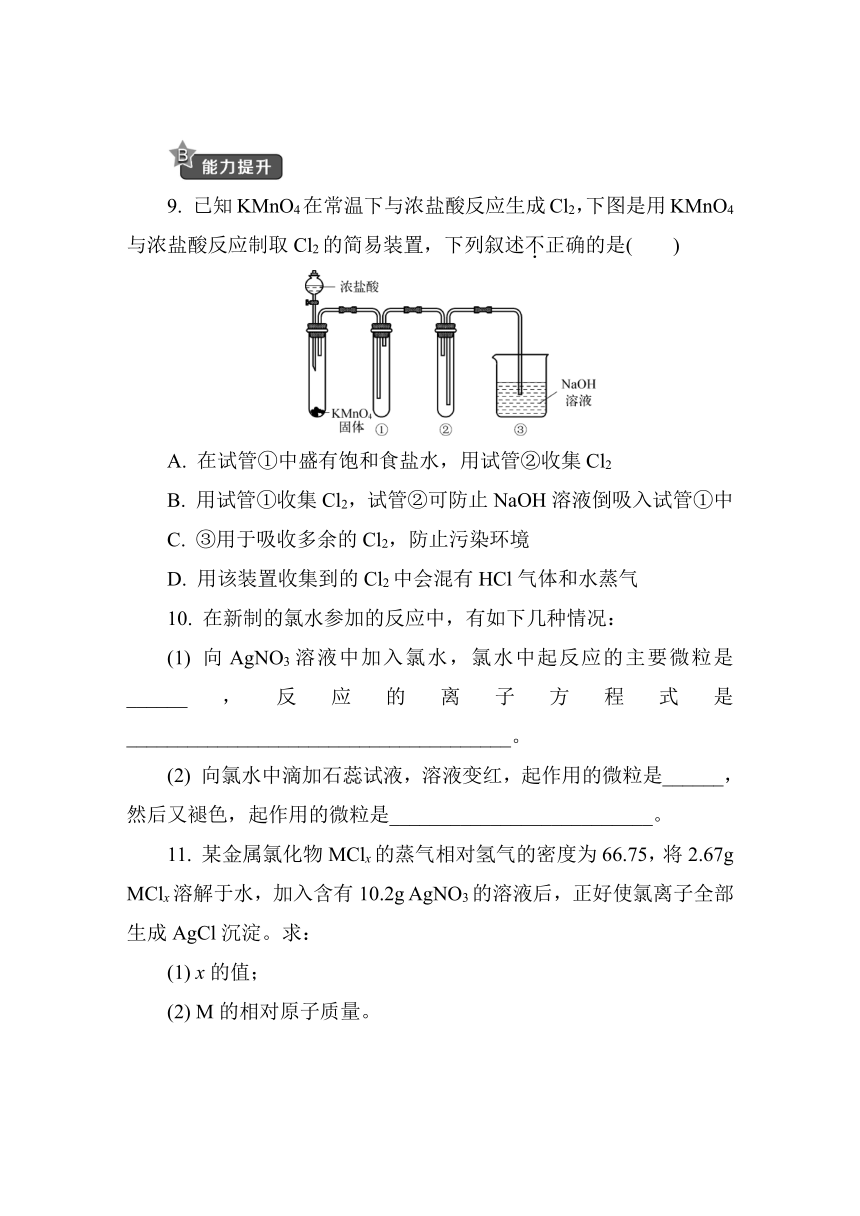
9. 已知KMnO4在常温下与浓盐酸反应生成Cl2,下图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A. 在试管①中盛有饱和食盐水,用试管②收集Cl2
B. 用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C. ③用于吸收多余的Cl2,防止污染环境
D. 用该装置收集到的Cl2中会混有HCl气体和水蒸气
10. 在新制的氯水参加的反应中,有如下几种情况:
(1) 向AgNO3溶液中加入氯水,氯水中起反应的主要微粒是______,反应的离子方程式是______________________________________。
(2) 向氯水中滴加石蕊试液,溶液变红,起作用的微粒是______,然后又褪色,起作用的微粒是__________________________。
11. 某金属氯化物MClx的蒸气相对氢气的密度为66.75,将2.67g MClx溶解于水,加入含有10.2g AgNO3的溶液后,正好使氯离子全部生成AgCl沉淀。求:
(1) x的值;
(2) M的相对原子质量。
12. 氯气是一种重要的化工原料。
(1) 实验室可用二氧化锰和浓盐酸共热制取氯气,反应的化学方程式是__________________________________________________。
(2) 某学习小组利用此原理设计如图一所示的装置制取氯气。
图一
图二
① 在该实验中,制取氯气的装置应选择图二中的____________(填字母)。
② 图一C装置中盛放饱和氯化钠溶液,其作用是______________________________。
③ 图一D装置的作用是干燥氯气,其中盛放的试剂是_________。
④ Cl2有毒,实验室进行该实验时常在收集装置后增加尾气吸收装置,请画出尾气吸收装置,并写出相关反应的离子方程式。
_____________________________________________________。
答案与解析
第3课时 氯气的实验室制法 氯离子的检验
1. B [解析] H2、O2和N2都不与NaOH反应,且不溶于NaOH溶液,Cl2和HCl都能与NaOH溶液反应从而被吸收,故B项正确。
2. D [解析] 氯酸钾溶液中存在的是ClO,次氯酸钠溶液中存在的是ClO-,液氯是氯气分子。
3. D [解析] 黄绿色、有毒、强氧化性均为氯气的性质。
4. D [解析] 要证明含有Na+,则焰色反应为黄色;要证明含有Cl-,则加入稀硝酸酸化的AgNO3溶液后生成白色沉淀。
5. C [解析] A项,没有加热装置;B项,NaOH不但会吸收HCl,也会吸收Cl2,不能用于此处除杂,应换成饱和食盐水;D项,氯水中的HClO具有漂白性,不可以用pH试纸来测量氯水的pH。
6. D [解析] 氯气中含有水蒸气和HCl气体杂质,因为氯气与氢氧化钠能反应,所以不能用氢氧化钠溶液除氯化氢,氯气在饱和食盐水中溶解度小,可以降低氯气的溶解度,同时除去氯化氢杂质;又因饱和食盐水中有水,所以先用饱和食盐水除氯化氢,再用浓硫酸吸收水蒸气。
7. C [解析] ① 氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性,故错误;② Cl2在饱和食盐水中难溶解,故错误;③ 氯水中含有次氯酸,不稳定,分解生成盐酸和氧气,则久置氯水的酸性增强,故正确;④ HCl也与硝酸银反应,可通过观察颜色来判断,故错误;⑤ HCl、Cl2都与氢氧化钠溶液反应,不能用于除杂,应用苯洗气,故错误。
8. A [解析] 反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,HCl既表现酸性,又表现还原性,故A项正确;盐酸与碳酸氢钠发生反应生成CO2,引入CO2气体,应用饱和氯化钠溶液除去Cl2中的HCl,故B项错误;用NaOH溶液吸收Cl2,Cl2+2NaOH===NaCl+NaClO+H2O,反应中Cl2既作氧化剂也作还原剂,故C项错误;氯气与水反应生成的次氯酸具有漂白性,氯气无漂白性,故D项错误。
9. A [解析] 根据导管的进出长短可知试管①用于收集Cl2,试管②用于防止NaOH溶液倒吸入①中,NaOH溶液吸收多余的Cl2,防止污染环境,①中收集到的Cl2不纯,混有HCl和水蒸气。
10. (1) Cl- Ag++Cl-===AgCl↓ (2) H+ HClO
11. (1) x=3 (2) 27 [解析] 由题意知,Mr+35.5x=66.75×2=133.5
MClx ~ xAgNO3
133.5 170x
2.67g 10.2g
=
x=3 Mr=133.5-35.5×3=27
12. (1) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2) ① c ② 除去氯气中的氯化氢 ③ 浓硫酸 ④ Cl2+2OH-===Cl-+ClO-+H2O [解析] 实验室用二氧化锰和浓盐酸反应制取氯气,该反应是固体和液体需要加热的反应,故选c装置制取氯气。因为浓盐酸具有挥发性,制取的氯气中含有杂质氯化氢,还有水蒸气,所以要得到干燥、纯净的氯气,应先通过饱和氯化钠溶液以除去氯气中的氯化氢,再通过浓硫酸干燥氯气。为防止氯气污染环境,要用氢氧化钠溶液吸收尾气。
1. 常温下,将两种气体同时通入足量的NaOH溶液中,气体被完全吸收,则这两种气体是( )
A. Cl2和H2 B. Cl2和HCl
C. O2和HCl D. N2和Cl2
2. 下列物质中,存在氯离子的是( )
A. 氯酸钾溶液 B. 次氯酸钠溶液
C. 液氯 D. 氯水
3. 下列关于Cl-的说法中,正确的是( )
A. Cl-呈黄绿色 B. Cl-有毒
C. Cl-有强氧化性 D. Cl-有稳定结构
4. 下列能证明某溶液中含有NaCl的是( )
A. 焰色反应是黄色
B. 溶液有咸味
C. 取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D. 焰色反应是黄色,同时又能与硝酸酸化的硝酸银溶液反应生成白色沉淀
5. 氯气是制备含氯化合物的重要原料。下列有关氯气的实验装置或操作能达到实验目的的是( )
6. 实验室制取的氯气往往含有水蒸气和HCl气体杂质,若想得到纯净、干燥的氯气,下列试剂及顺序正确的是( )
A. 浓硫酸、氢氧化钠溶液 B. 氢氧化钠溶液、浓硫酸
C. 蒸馏水、浓硫酸 D. 饱和食盐水、浓硫酸
7. 下列说法中正确的是( )
① 把氯气通入装有湿润的有色布条的集气瓶中,有色布条的颜色褪去,说明氯气具有漂白性
② 实验室制取氯气时,为了防止环境污染,多余的氯气可以用饱和NaCl溶液吸收
③ 久置氯水的酸性强于新制氯水
④ 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液中
⑤ 除去HCl气体中的Cl2,可将气体通入氢氧化钠溶液中
A. ①③④ B. ①③
C. ③ D. ①②⑤
8. 实验室用MnO2和浓盐酸在加热条件下反应制取Cl2,下列说法正确的是( )
A. 反应中HCl既表现酸性,又表现还原性
B. 用饱和碳酸氢钠溶液可除去Cl2中的HCl
C. 用NaOH溶液吸收Cl2时,反应中Cl2只作氧化剂
D. 将湿润的有色布条伸入集满Cl2的集气瓶中,布条褪色说明Cl2具有漂白性
9. 已知KMnO4在常温下与浓盐酸反应生成Cl2,下图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )
A. 在试管①中盛有饱和食盐水,用试管②收集Cl2
B. 用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C. ③用于吸收多余的Cl2,防止污染环境
D. 用该装置收集到的Cl2中会混有HCl气体和水蒸气
10. 在新制的氯水参加的反应中,有如下几种情况:
(1) 向AgNO3溶液中加入氯水,氯水中起反应的主要微粒是______,反应的离子方程式是______________________________________。
(2) 向氯水中滴加石蕊试液,溶液变红,起作用的微粒是______,然后又褪色,起作用的微粒是__________________________。
11. 某金属氯化物MClx的蒸气相对氢气的密度为66.75,将2.67g MClx溶解于水,加入含有10.2g AgNO3的溶液后,正好使氯离子全部生成AgCl沉淀。求:
(1) x的值;
(2) M的相对原子质量。
12. 氯气是一种重要的化工原料。
(1) 实验室可用二氧化锰和浓盐酸共热制取氯气,反应的化学方程式是__________________________________________________。
(2) 某学习小组利用此原理设计如图一所示的装置制取氯气。
图一
图二
① 在该实验中,制取氯气的装置应选择图二中的____________(填字母)。
② 图一C装置中盛放饱和氯化钠溶液,其作用是______________________________。
③ 图一D装置的作用是干燥氯气,其中盛放的试剂是_________。
④ Cl2有毒,实验室进行该实验时常在收集装置后增加尾气吸收装置,请画出尾气吸收装置,并写出相关反应的离子方程式。
_____________________________________________________。
答案与解析
第3课时 氯气的实验室制法 氯离子的检验
1. B [解析] H2、O2和N2都不与NaOH反应,且不溶于NaOH溶液,Cl2和HCl都能与NaOH溶液反应从而被吸收,故B项正确。
2. D [解析] 氯酸钾溶液中存在的是ClO,次氯酸钠溶液中存在的是ClO-,液氯是氯气分子。
3. D [解析] 黄绿色、有毒、强氧化性均为氯气的性质。
4. D [解析] 要证明含有Na+,则焰色反应为黄色;要证明含有Cl-,则加入稀硝酸酸化的AgNO3溶液后生成白色沉淀。
5. C [解析] A项,没有加热装置;B项,NaOH不但会吸收HCl,也会吸收Cl2,不能用于此处除杂,应换成饱和食盐水;D项,氯水中的HClO具有漂白性,不可以用pH试纸来测量氯水的pH。
6. D [解析] 氯气中含有水蒸气和HCl气体杂质,因为氯气与氢氧化钠能反应,所以不能用氢氧化钠溶液除氯化氢,氯气在饱和食盐水中溶解度小,可以降低氯气的溶解度,同时除去氯化氢杂质;又因饱和食盐水中有水,所以先用饱和食盐水除氯化氢,再用浓硫酸吸收水蒸气。
7. C [解析] ① 氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性,故错误;② Cl2在饱和食盐水中难溶解,故错误;③ 氯水中含有次氯酸,不稳定,分解生成盐酸和氧气,则久置氯水的酸性增强,故正确;④ HCl也与硝酸银反应,可通过观察颜色来判断,故错误;⑤ HCl、Cl2都与氢氧化钠溶液反应,不能用于除杂,应用苯洗气,故错误。
8. A [解析] 反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,HCl既表现酸性,又表现还原性,故A项正确;盐酸与碳酸氢钠发生反应生成CO2,引入CO2气体,应用饱和氯化钠溶液除去Cl2中的HCl,故B项错误;用NaOH溶液吸收Cl2,Cl2+2NaOH===NaCl+NaClO+H2O,反应中Cl2既作氧化剂也作还原剂,故C项错误;氯气与水反应生成的次氯酸具有漂白性,氯气无漂白性,故D项错误。
9. A [解析] 根据导管的进出长短可知试管①用于收集Cl2,试管②用于防止NaOH溶液倒吸入①中,NaOH溶液吸收多余的Cl2,防止污染环境,①中收集到的Cl2不纯,混有HCl和水蒸气。
10. (1) Cl- Ag++Cl-===AgCl↓ (2) H+ HClO
11. (1) x=3 (2) 27 [解析] 由题意知,Mr+35.5x=66.75×2=133.5
MClx ~ xAgNO3
133.5 170x
2.67g 10.2g
=
x=3 Mr=133.5-35.5×3=27
12. (1) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2) ① c ② 除去氯气中的氯化氢 ③ 浓硫酸 ④ Cl2+2OH-===Cl-+ClO-+H2O [解析] 实验室用二氧化锰和浓盐酸反应制取氯气,该反应是固体和液体需要加热的反应,故选c装置制取氯气。因为浓盐酸具有挥发性,制取的氯气中含有杂质氯化氢,还有水蒸气,所以要得到干燥、纯净的氯气,应先通过饱和氯化钠溶液以除去氯气中的氯化氢,再通过浓硫酸干燥氯气。为防止氯气污染环境,要用氢氧化钠溶液吸收尾气。
