10.1常见的酸和碱第二课时课件(共21张PPT) 人教版化学九年级下册
文档属性
| 名称 | 10.1常见的酸和碱第二课时课件(共21张PPT) 人教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 512.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-15 09:05:04 | ||
图片预览








文档简介
(共21张PPT)
课题1 常见的酸和碱
(第二课时)
掌握盐酸、硫酸的化学性质及酸的相似的化学性质(掌握)
三、酸的化学性质(重点、难点)
1.酸与指示剂的反应:酸能使紫色石蕊溶液变 红 色,
不 能使无色酚酞溶液变色。
2.酸与活泼金属的反应
(1)反应规律:酸能与多种活泼金属反应,生成该金属的化合物和 氢气 。
红
不
氢气
(2)写出下列常见金属与酸反应的化学方程式:
镁
锌
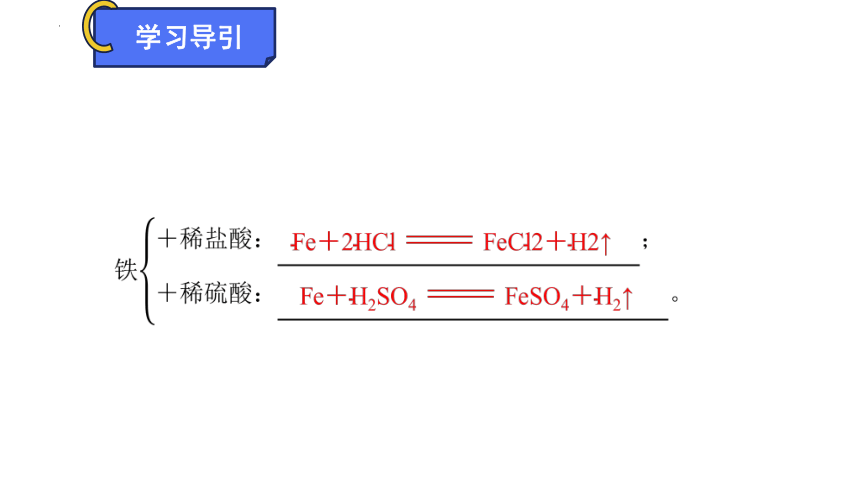
铁
3.酸与金属氧化物的反应
(1)反应规律:酸能与某些金属氧化物反应,生成该金属的化合物和水。
(2)写出下列反应的化学方程式:
Fe2O3与稀盐酸反应: Fe2O3+6HCl 2FeCl3+3H2O ;
Fe2O3与稀硫酸反应: Fe2O3+3H2SO4 Fe2(SO4)3+3H2O ;
CuO与稀硫酸反应: CuO+H2SO4 CuSO4+H2O ;
MgO与稀盐酸反应: MgO+2HCl MgCl2+H2O 。
Fe2O3+6HCl 2FeCl3+3H2O
Fe2O3+3H2SO4 Fe2(SO4)3+
3H2O
CuO+H2SO4 CuSO4+H2O
MgO+2HCl MgCl2+H2O
特别提醒
酸的化学通性:在溶液中都能解离出H+。
【例】下列关于酸的说法错.误.的是( C )
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸和稀硫酸都可用于金属除锈
C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D.稀硫酸能够与活泼金属反应制取氢气
方法点拨:浓硫酸具有吸水性,浓盐酸具有挥发性;稀盐酸和稀硫酸都可与金属氧化物反应,都可用于金属除锈;无色酚酞溶液遇酸不变色;酸能与活泼金属反应生成氢气。
C
知识点3 酸的化学性质
1.酸溶液的化学性质有很多相似之处,原因在于( A )
A.都能解离出氢离子 B.都含有氢元素
C.都含有酸根离子 D.都能跟所有金属反应
A
2.(核心素养)从反应原理和产物纯度两个角度考虑,下列制取Fe2(SO4)3溶液的方案中最佳的是( A )
A.过量的Fe2O3与适量的稀硫酸反应,过滤
B.过量的Fe粉与适量的稀硫酸反应,过滤
C.过量的稀硫酸与适量的Fe2O3反应
D.过量的Fe粉与适量的CuSO4溶液反应,过滤
A
3.如图所示,装置气密性良好,试管中装有稀盐酸。向试管中加入某物质后,温度计温度升高,该物质是( A )
A.锌粒 B.冰块 C.铜块 D.氯化钠
4.检验某溶液是不是稀硫酸,不.能.选用的试剂是( A )
A.无色酚酞溶液 B.紫色石蕊溶液
C.生锈的铁钉 D.镁条
A
A
5.下列关于硫酸的认识正确的是( C )
A.组成:硫酸溶液中H+和S的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用NaCl处理后直接排放
6.(易错题)下列说法正确的是( C )
A.含有氧元素的物质一定是氧化物
B.只含一种元素的物质一定是单质
C.质子数相同的原子一定属于同种元素
D.能与稀盐酸反应产生气泡的物质一定是活泼金属
C
C
7.(情景题)柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不.能.与柠檬酸反应的是( C )
A.Mg B.Fe2 C.CO2 D.Na2O
C
8.构建知识网络,可以帮助我们理解知识之间的内在联系。如图所示是盐酸与不同类别物质反应的知识网络图。回答下列问题。
(1)写出一种金属与盐酸反应的化学方程式: Zn+2HCl ZnCl2+H2↑(答案合理即可) 。
Zn+2HCl
ZnCl2+H2↑(答案合理即可)
(2)用盐酸除铁锈的化学方程式
是 Fe2O3+6HCl 2FeCl3+3H2 。
(3)小明学完“酸的化学性质”后,邀请你与他讨论,食醋也是一种酸,和盐酸具有相似的化学性质。列举两点食醋的化学性质: 能与指示剂反应、能跟活泼金属发生置换反应(答案合理即可) 。
(4)反思:盐酸、硫酸、食醋具有相似化学性质的原因是它们的水溶液中都含有 氢 离子。
Fe2O3+6HCl
2FeCl3+3H2O
能与指示剂反应、能跟活泼金属发生置换反应(答案
合理即可)
氢
9.古往今来,金属材料和制品在生产生活中应用广泛。回答下列问题。
(1)三星堆遗址发掘现场出土了华丽的鸟型金饰片,金能被加工成超薄金箔,是因为金具有良好的 延展性 ;同时出土的铜头像、青铜神树等表面有锈迹,铜生锈的主要原理是2Cu+H2O+O2+X Cu2(OH)2CO3,X的化学式为 CO2 。
(2)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤得到滤渣和滤液。
延展性
CO2
①在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化,则滤液中一定没有的阳离子是 H+、Cu2+ (写离子符号);
②向滤渣中再滴入稀硫酸产生气泡,则滤渣中一定含有 铁、铜 (写名称)。
H+、Cu2+
铁、
铜
10.(一课一练)写出下列反应的化学方程式。
(1)氧化铝与稀硫酸反应: Al2O3+3H2SO4 Al2(SO4)3+3H2O 。
(2)氧化铜与稀硫酸反应: CuO+H2SO4 CuSO4+H2O 。
(3)用稀硫酸除铁锈: Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 。
Al2O3+3H2SO4 Al2
(SO4)3+3H2O
CuO+H2SO4 CuSO4+
H2O
Fe2O3+3H2SO4 Fe2(SO4)3+
3H2O
(4)烧水的铝壶中常结有一层水垢(主要成分为CaCO3),用适量稀盐酸可以除去该水垢,反应的化学方程式是 CaCO3+2HCl CaCl2+H2O+CO2↑ ;若盐酸的用量过多,
会产生不良后果,用化学方程式可表示为 2Al+6HCl 2AlCl3+3H2↑ 。
CaCO3+
2HCl CaCl2+H2O+CO2↑
2Al+6HCl
2AlCl3+3H2↑
11.(核心素养)铁及其化合物在生产生活中有广泛的应用。铁红(Fe2O3)是一种重要的工业颜料,用硫酸厂的炉渣(含有Fe2O3、FeO、SiO2、CaSO4)制备铁红的流程如图所示,已知SiO2、CaSO4不与稀硫酸反应。回答下列问题。
(1)下列措施能防止铁制品锈蚀的是 AB (选填字母)。
A.涂油、喷漆 B.镀耐腐蚀的铬层
C.用盐水清洗 D.久置于酸性环境
(2)操作Ⅰ所需玻璃仪器除漏斗、玻璃棒外,还有 烧杯 。
(3)写出NH4HCO3中氮元素的化合价: H4HCO3 。
(4)滤液A中含有H2SO4、FeSO4和Fe2(SO4)3,加入Fe粉后全部转化为FeSO4,转化时除Fe与Fe2(SO4)3反应外,还发生其他反应的化学方程式为 Fe+H2SO4 FeSO4+H2↑ 。
(5)写出在空气中煅烧FeCO3的化学方程式: 4FeCO3+O22Fe2O3+4CO2 。
AB
烧杯
H4HCO3
Fe+H2SO4 FeSO4+H2↑
4FeCO3+
O22Fe2O3+4CO2
课题1 常见的酸和碱
(第二课时)
掌握盐酸、硫酸的化学性质及酸的相似的化学性质(掌握)
三、酸的化学性质(重点、难点)
1.酸与指示剂的反应:酸能使紫色石蕊溶液变 红 色,
不 能使无色酚酞溶液变色。
2.酸与活泼金属的反应
(1)反应规律:酸能与多种活泼金属反应,生成该金属的化合物和 氢气 。
红
不
氢气
(2)写出下列常见金属与酸反应的化学方程式:
镁
锌
铁
3.酸与金属氧化物的反应
(1)反应规律:酸能与某些金属氧化物反应,生成该金属的化合物和水。
(2)写出下列反应的化学方程式:
Fe2O3与稀盐酸反应: Fe2O3+6HCl 2FeCl3+3H2O ;
Fe2O3与稀硫酸反应: Fe2O3+3H2SO4 Fe2(SO4)3+3H2O ;
CuO与稀硫酸反应: CuO+H2SO4 CuSO4+H2O ;
MgO与稀盐酸反应: MgO+2HCl MgCl2+H2O 。
Fe2O3+6HCl 2FeCl3+3H2O
Fe2O3+3H2SO4 Fe2(SO4)3+
3H2O
CuO+H2SO4 CuSO4+H2O
MgO+2HCl MgCl2+H2O
特别提醒
酸的化学通性:在溶液中都能解离出H+。
【例】下列关于酸的说法错.误.的是( C )
A.浓硫酸具有吸水性,浓盐酸具有挥发性
B.稀盐酸和稀硫酸都可用于金属除锈
C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色
D.稀硫酸能够与活泼金属反应制取氢气
方法点拨:浓硫酸具有吸水性,浓盐酸具有挥发性;稀盐酸和稀硫酸都可与金属氧化物反应,都可用于金属除锈;无色酚酞溶液遇酸不变色;酸能与活泼金属反应生成氢气。
C
知识点3 酸的化学性质
1.酸溶液的化学性质有很多相似之处,原因在于( A )
A.都能解离出氢离子 B.都含有氢元素
C.都含有酸根离子 D.都能跟所有金属反应
A
2.(核心素养)从反应原理和产物纯度两个角度考虑,下列制取Fe2(SO4)3溶液的方案中最佳的是( A )
A.过量的Fe2O3与适量的稀硫酸反应,过滤
B.过量的Fe粉与适量的稀硫酸反应,过滤
C.过量的稀硫酸与适量的Fe2O3反应
D.过量的Fe粉与适量的CuSO4溶液反应,过滤
A
3.如图所示,装置气密性良好,试管中装有稀盐酸。向试管中加入某物质后,温度计温度升高,该物质是( A )
A.锌粒 B.冰块 C.铜块 D.氯化钠
4.检验某溶液是不是稀硫酸,不.能.选用的试剂是( A )
A.无色酚酞溶液 B.紫色石蕊溶液
C.生锈的铁钉 D.镁条
A
A
5.下列关于硫酸的认识正确的是( C )
A.组成:硫酸溶液中H+和S的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用NaCl处理后直接排放
6.(易错题)下列说法正确的是( C )
A.含有氧元素的物质一定是氧化物
B.只含一种元素的物质一定是单质
C.质子数相同的原子一定属于同种元素
D.能与稀盐酸反应产生气泡的物质一定是活泼金属
C
C
7.(情景题)柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出H+,从而呈现酸性,主要用于制造香料或作为饮料的酸化剂。下列物质不.能.与柠檬酸反应的是( C )
A.Mg B.Fe2 C.CO2 D.Na2O
C
8.构建知识网络,可以帮助我们理解知识之间的内在联系。如图所示是盐酸与不同类别物质反应的知识网络图。回答下列问题。
(1)写出一种金属与盐酸反应的化学方程式: Zn+2HCl ZnCl2+H2↑(答案合理即可) 。
Zn+2HCl
ZnCl2+H2↑(答案合理即可)
(2)用盐酸除铁锈的化学方程式
是 Fe2O3+6HCl 2FeCl3+3H2 。
(3)小明学完“酸的化学性质”后,邀请你与他讨论,食醋也是一种酸,和盐酸具有相似的化学性质。列举两点食醋的化学性质: 能与指示剂反应、能跟活泼金属发生置换反应(答案合理即可) 。
(4)反思:盐酸、硫酸、食醋具有相似化学性质的原因是它们的水溶液中都含有 氢 离子。
Fe2O3+6HCl
2FeCl3+3H2O
能与指示剂反应、能跟活泼金属发生置换反应(答案
合理即可)
氢
9.古往今来,金属材料和制品在生产生活中应用广泛。回答下列问题。
(1)三星堆遗址发掘现场出土了华丽的鸟型金饰片,金能被加工成超薄金箔,是因为金具有良好的 延展性 ;同时出土的铜头像、青铜神树等表面有锈迹,铜生锈的主要原理是2Cu+H2O+O2+X Cu2(OH)2CO3,X的化学式为 CO2 。
(2)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤得到滤渣和滤液。
延展性
CO2
①在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化,则滤液中一定没有的阳离子是 H+、Cu2+ (写离子符号);
②向滤渣中再滴入稀硫酸产生气泡,则滤渣中一定含有 铁、铜 (写名称)。
H+、Cu2+
铁、
铜
10.(一课一练)写出下列反应的化学方程式。
(1)氧化铝与稀硫酸反应: Al2O3+3H2SO4 Al2(SO4)3+3H2O 。
(2)氧化铜与稀硫酸反应: CuO+H2SO4 CuSO4+H2O 。
(3)用稀硫酸除铁锈: Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 。
Al2O3+3H2SO4 Al2
(SO4)3+3H2O
CuO+H2SO4 CuSO4+
H2O
Fe2O3+3H2SO4 Fe2(SO4)3+
3H2O
(4)烧水的铝壶中常结有一层水垢(主要成分为CaCO3),用适量稀盐酸可以除去该水垢,反应的化学方程式是 CaCO3+2HCl CaCl2+H2O+CO2↑ ;若盐酸的用量过多,
会产生不良后果,用化学方程式可表示为 2Al+6HCl 2AlCl3+3H2↑ 。
CaCO3+
2HCl CaCl2+H2O+CO2↑
2Al+6HCl
2AlCl3+3H2↑
11.(核心素养)铁及其化合物在生产生活中有广泛的应用。铁红(Fe2O3)是一种重要的工业颜料,用硫酸厂的炉渣(含有Fe2O3、FeO、SiO2、CaSO4)制备铁红的流程如图所示,已知SiO2、CaSO4不与稀硫酸反应。回答下列问题。
(1)下列措施能防止铁制品锈蚀的是 AB (选填字母)。
A.涂油、喷漆 B.镀耐腐蚀的铬层
C.用盐水清洗 D.久置于酸性环境
(2)操作Ⅰ所需玻璃仪器除漏斗、玻璃棒外,还有 烧杯 。
(3)写出NH4HCO3中氮元素的化合价: H4HCO3 。
(4)滤液A中含有H2SO4、FeSO4和Fe2(SO4)3,加入Fe粉后全部转化为FeSO4,转化时除Fe与Fe2(SO4)3反应外,还发生其他反应的化学方程式为 Fe+H2SO4 FeSO4+H2↑ 。
(5)写出在空气中煅烧FeCO3的化学方程式: 4FeCO3+O22Fe2O3+4CO2 。
AB
烧杯
H4HCO3
Fe+H2SO4 FeSO4+H2↑
4FeCO3+
O22Fe2O3+4CO2
同课章节目录
