8.3金属资源的利用和保护第一课时课件(共27张PPT) 人教版化学九年级下册
文档属性
| 名称 | 8.3金属资源的利用和保护第一课时课件(共27张PPT) 人教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 636.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-15 08:41:13 | ||
图片预览








文档简介
(共27张PPT)
课题3 金属资源的利用和保护(第一课时)
1.知道一些常见的金属矿物(知道)
2.理解工业炼铁的原理(理解)
3.学会根据化学方程式,对含有杂质的反应物或生成物进行计算(掌握)
一、金属在自然界中的存在形式
1.存在形式:金属资源广泛地存在于地壳和海洋中,除少数很不活泼的金属如金、银等以 单质 形式存在外,其余都以 化合物 的形式存在。
单质
化合物
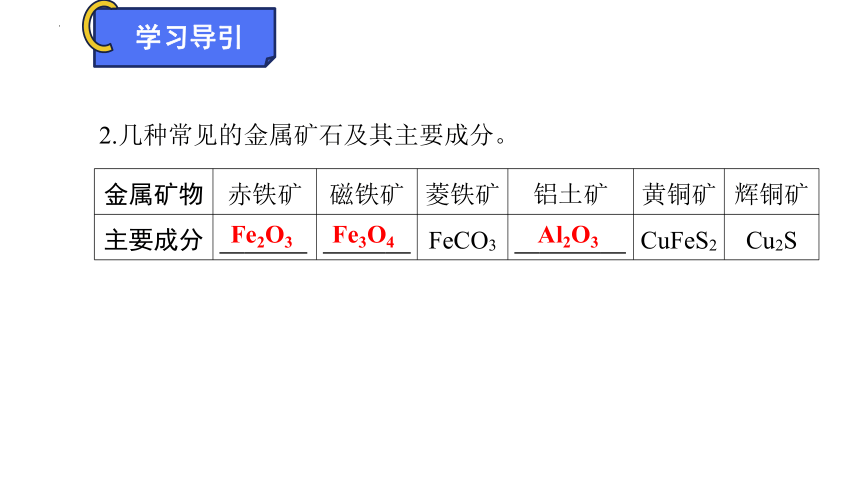
金属矿物 赤铁矿 磁铁矿 菱铁矿 铝土矿 黄铜矿 辉铜矿
主要成分 Fe2O3 Fe3O4 FeCO3 Al2O3 CuFeS2 Cu2S
Fe2O3
Fe3O4
Al2O3
2.几种常见的金属矿石及其主要成分。
二、铁的冶炼
1.炼铁的原理(重点)
(1)实验装置(如图所示)。
(2)实验现象:玻璃管里的粉末由 红棕 色逐渐变 黑 , 试管里澄清石灰水 变浑浊 ,导管口火焰呈 蓝 色。
红棕
黑
变浑浊
蓝
2.工业炼铁
(1)主要设备: 高炉 。
(2)原料: 铁矿石 、 焦炭 和石灰石。
(3)发生的主要反应。
①产生还原剂(CO):C+O2 CO2,CO2+C 2CO;
②生成生铁: Fe2O3+3CO 3CO2+2Fe (写化学方程式)。
高炉
铁矿石
焦炭
Fe2O3+3CO 3CO2+2Fe
3.含有杂质的物质的计算
(1)化学方程式所表达的是纯净物之间的质量关系,因此当反应物或生成物含有杂质时,应先换算成纯净物的质量,再进行计算。
(2)不纯物(含有杂质的物质)的质量、纯净物的质量和纯净物的质量分数之间的关系:
①纯净物的质量分数=×100%;
②纯净物的质量= 不纯物的质量×纯净物的质量分数 ;
③不纯物的质量=。
不纯物的质量×纯净物的质量分数
【例】工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有400 t含氧化铁80%的赤铁矿石。回答下列问题。
(1)该矿石中氧化铁的质量为多少?
解:400 t×80%=320 t
答:该矿石中氧化铁的质量为320 t。
含杂质4%的生铁,则含铁量为1-4%=96%
设该矿石能冶炼出含杂质4%的生铁的质量为x。
3CO+Fe2O3 2Fe+3CO2
160 112
320 t x×96%
=
x≈233.3 t
答:该矿石能冶炼出含杂质4%的生铁的质量约为233.3 t。
(2)该矿石能冶炼出含杂质4%的生铁的质量为多少?(结果精确到0.1)
方法点拨:利用含氧化铁80%的赤铁矿,可求出该矿石中氧化铁的质量。一氧化碳与氧化铁反应,生成铁和二氧化碳,由反应中铁与氧化铁的质量关系,利用含氧化铁80%的赤铁矿,可求出含杂质4%的生铁的质量。
知识点1 金属在自然界中的存在形式
1.下列说法错.误.的是( B )
A.金属资源广泛地存在于地壳和海洋中
B.赤铁矿的主要成分是Fe3O4
C.铝土矿的主要成分是Al2O3
D.黄铜矿富含铜元素和铁元素
B
2.下列关于金属资源的说法不.正.确.的是( B )
A.除少数不活泼的金属如金、银等以单质形式存在外,其余都以化合物形式存在
B.自然界中的金属资源是取之不尽的
C.人类大规模利用铁、铝、铜的先后顺序是铜、铁、铝,主要原因是它们的金属活动性差异
D.地壳中含量最多的且目前被人们利用逐渐增多的金属元素是铝元素
B
知识点2 铁的冶炼
3.工业炼铁的主要设备为( B )
A.瓶 B.高炉 C.电炉 D.转炉
B
4.(情景题)高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO 2Ni+CO2↑。下列说法错.误.的是( D )
A.C具有还原性
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
D
5.(教材变式)实验室里用如图所示的装置还原氧化铁。下列关于该实验的说法错.误.的是( A )
A.玻璃管中发生的反应属于置换反应
B.该实验说明了一氧化碳既可燃烧,又具有还原性
C.实验观察到的现象为红棕色固体变黑,澄清石灰水变浑浊
D.实验时,先通入一氧化碳,再点燃酒精喷灯
A
6.工业上将赤铁矿炼成生铁是一个复杂的过程,炼铁高炉中发生的主要反应有( B )
①C+O2 CO2
②Fe2O3+3H2 2Fe+3H2O
③Fe2O3+3CO 2Fe+3CO2
④2Fe2O3+3C 4Fe+3CO2↑
B
⑤CO2+C 2CO
A.②③⑤ B.①③⑤ C.①④⑤ D.②③
7.工业炼铁的部分反应如图所示。下列说法正确的是( A )
A.X可以是木炭
B.X与CO都具有氧化性
C.③反应后的尾气可直接排放
D.Y中铁元素以游离态存在
A
8.(核心素养)生铁用途十分广泛。工业上利用赤铁矿(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图所示。回答下列问题。
(1)生铁属于 金属 (选填“合成”或“金属”)材料。高炉气体中的 SO2 (写化学式)会导致酸雨。
金属
SO2
①生成CO的反应之一为C+CO2 2CO,该反应属于 化合 反应(写基本反应类型);
②CaCO3和SiO2在高温条件下反应,生成CO2气体和CaSiO3,该反应的化学方程式为 CaCO3+SiO2 CaSiO3+CO2↑ 。
化
合
CaCO3+SiO2 CaSiO3+
CO2↑
(2)“煅烧”时:
9.(教材变式)近年来,我国钢铁工业飞速发展。某钢铁厂采用赤铁矿炼铁,回答下列问题。
(1)写出Fe2O3中铁元素与氧元素的质量比: 7∶3 。
(2)现用1 000 t含氧化铁80%的赤铁矿石冶炼生铁,理论上可冶炼出生铁的质量为 560 t 。
7∶3
560 t
10.(一课一练)如图所示是高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图,已知硫酸镍的化学式为NiSO4。
(1)高炉冶铁的主要反应原理是 3CO+Fe2O3 2Fe+3CO2 (写化学方程式)。
(2)分析流程图,三脱装置中反应的基本反应类型是 化合反应 。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中 玻璃棒 (写一种仪器的名称)的作用。
3CO+Fe2O3 2Fe+
3CO2
化合
反应
玻璃棒
(4)铁与镍相比,铁的金属活动性 > (选填“>”“<”或“=”)镍,判断依据是 Fe+NiSO4 Ni+FeSO4 (写化学方程式)。
(5)白铜的成分是 铜、镍 (写名称),其硬度比纯铜 大 (选填“大”或“小”)。
>
Fe+NiSO4 Ni
+FeSO4
铜、镍
大
11.(核心素养)某化学兴趣小组利用如图所示的装置对CO还原Fe2O3的实验进行探究(固定装置已省略)。
【查阅资料】①CO能溶于铜液;②NaOH溶液能与二氧化碳反应,生成碳酸钠和水;NaOH溶液不与一氧化碳反应;③浓硫酸具有吸水性。
(1)按图连接装置A~E,在装入试剂前,先 检查装置的气密性 。
(2)写出装置B中反应的化学方程式: CO2+2NaOHNa2C
O3+H2O 。
(3)通入CO2一段时间后,先点燃 A (选填“A”或“D”)处酒精喷灯。
检查装置的气
密性
CO2+
2NaOHNa2CO3
A
+H2O
(4)装置C中玻璃管的作用是 调节压强 。
(5)反应一段时间后,能证明CO与Fe2O3反应的实验现象是 D中玻璃管内红色固体变成黑色; E中澄清的石灰水变浑浊 。
写出装置E中反应的化学方程式: Ca(OH)2+CO2 CaCO3↓+H2O 。
调节压强
玻璃管内红色固体变成黑色; E中澄清的石灰水变浑
浊
Ca(OH)2+CO2 CaCO3↓
+H2O
D中
(6)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是 吸收一氧化碳 。
装置E、F的接口连接顺序是a连接 c (选填“b”或“c”)。
吸收一氧化碳
c
课题3 金属资源的利用和保护(第一课时)
1.知道一些常见的金属矿物(知道)
2.理解工业炼铁的原理(理解)
3.学会根据化学方程式,对含有杂质的反应物或生成物进行计算(掌握)
一、金属在自然界中的存在形式
1.存在形式:金属资源广泛地存在于地壳和海洋中,除少数很不活泼的金属如金、银等以 单质 形式存在外,其余都以 化合物 的形式存在。
单质
化合物
金属矿物 赤铁矿 磁铁矿 菱铁矿 铝土矿 黄铜矿 辉铜矿
主要成分 Fe2O3 Fe3O4 FeCO3 Al2O3 CuFeS2 Cu2S
Fe2O3
Fe3O4
Al2O3
2.几种常见的金属矿石及其主要成分。
二、铁的冶炼
1.炼铁的原理(重点)
(1)实验装置(如图所示)。
(2)实验现象:玻璃管里的粉末由 红棕 色逐渐变 黑 , 试管里澄清石灰水 变浑浊 ,导管口火焰呈 蓝 色。
红棕
黑
变浑浊
蓝
2.工业炼铁
(1)主要设备: 高炉 。
(2)原料: 铁矿石 、 焦炭 和石灰石。
(3)发生的主要反应。
①产生还原剂(CO):C+O2 CO2,CO2+C 2CO;
②生成生铁: Fe2O3+3CO 3CO2+2Fe (写化学方程式)。
高炉
铁矿石
焦炭
Fe2O3+3CO 3CO2+2Fe
3.含有杂质的物质的计算
(1)化学方程式所表达的是纯净物之间的质量关系,因此当反应物或生成物含有杂质时,应先换算成纯净物的质量,再进行计算。
(2)不纯物(含有杂质的物质)的质量、纯净物的质量和纯净物的质量分数之间的关系:
①纯净物的质量分数=×100%;
②纯净物的质量= 不纯物的质量×纯净物的质量分数 ;
③不纯物的质量=。
不纯物的质量×纯净物的质量分数
【例】工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁。现有400 t含氧化铁80%的赤铁矿石。回答下列问题。
(1)该矿石中氧化铁的质量为多少?
解:400 t×80%=320 t
答:该矿石中氧化铁的质量为320 t。
含杂质4%的生铁,则含铁量为1-4%=96%
设该矿石能冶炼出含杂质4%的生铁的质量为x。
3CO+Fe2O3 2Fe+3CO2
160 112
320 t x×96%
=
x≈233.3 t
答:该矿石能冶炼出含杂质4%的生铁的质量约为233.3 t。
(2)该矿石能冶炼出含杂质4%的生铁的质量为多少?(结果精确到0.1)
方法点拨:利用含氧化铁80%的赤铁矿,可求出该矿石中氧化铁的质量。一氧化碳与氧化铁反应,生成铁和二氧化碳,由反应中铁与氧化铁的质量关系,利用含氧化铁80%的赤铁矿,可求出含杂质4%的生铁的质量。
知识点1 金属在自然界中的存在形式
1.下列说法错.误.的是( B )
A.金属资源广泛地存在于地壳和海洋中
B.赤铁矿的主要成分是Fe3O4
C.铝土矿的主要成分是Al2O3
D.黄铜矿富含铜元素和铁元素
B
2.下列关于金属资源的说法不.正.确.的是( B )
A.除少数不活泼的金属如金、银等以单质形式存在外,其余都以化合物形式存在
B.自然界中的金属资源是取之不尽的
C.人类大规模利用铁、铝、铜的先后顺序是铜、铁、铝,主要原因是它们的金属活动性差异
D.地壳中含量最多的且目前被人们利用逐渐增多的金属元素是铝元素
B
知识点2 铁的冶炼
3.工业炼铁的主要设备为( B )
A.瓶 B.高炉 C.电炉 D.转炉
B
4.(情景题)高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO 2Ni+CO2↑。下列说法错.误.的是( D )
A.C具有还原性
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
D
5.(教材变式)实验室里用如图所示的装置还原氧化铁。下列关于该实验的说法错.误.的是( A )
A.玻璃管中发生的反应属于置换反应
B.该实验说明了一氧化碳既可燃烧,又具有还原性
C.实验观察到的现象为红棕色固体变黑,澄清石灰水变浑浊
D.实验时,先通入一氧化碳,再点燃酒精喷灯
A
6.工业上将赤铁矿炼成生铁是一个复杂的过程,炼铁高炉中发生的主要反应有( B )
①C+O2 CO2
②Fe2O3+3H2 2Fe+3H2O
③Fe2O3+3CO 2Fe+3CO2
④2Fe2O3+3C 4Fe+3CO2↑
B
⑤CO2+C 2CO
A.②③⑤ B.①③⑤ C.①④⑤ D.②③
7.工业炼铁的部分反应如图所示。下列说法正确的是( A )
A.X可以是木炭
B.X与CO都具有氧化性
C.③反应后的尾气可直接排放
D.Y中铁元素以游离态存在
A
8.(核心素养)生铁用途十分广泛。工业上利用赤铁矿(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图所示。回答下列问题。
(1)生铁属于 金属 (选填“合成”或“金属”)材料。高炉气体中的 SO2 (写化学式)会导致酸雨。
金属
SO2
①生成CO的反应之一为C+CO2 2CO,该反应属于 化合 反应(写基本反应类型);
②CaCO3和SiO2在高温条件下反应,生成CO2气体和CaSiO3,该反应的化学方程式为 CaCO3+SiO2 CaSiO3+CO2↑ 。
化
合
CaCO3+SiO2 CaSiO3+
CO2↑
(2)“煅烧”时:
9.(教材变式)近年来,我国钢铁工业飞速发展。某钢铁厂采用赤铁矿炼铁,回答下列问题。
(1)写出Fe2O3中铁元素与氧元素的质量比: 7∶3 。
(2)现用1 000 t含氧化铁80%的赤铁矿石冶炼生铁,理论上可冶炼出生铁的质量为 560 t 。
7∶3
560 t
10.(一课一练)如图所示是高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图,已知硫酸镍的化学式为NiSO4。
(1)高炉冶铁的主要反应原理是 3CO+Fe2O3 2Fe+3CO2 (写化学方程式)。
(2)分析流程图,三脱装置中反应的基本反应类型是 化合反应 。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中 玻璃棒 (写一种仪器的名称)的作用。
3CO+Fe2O3 2Fe+
3CO2
化合
反应
玻璃棒
(4)铁与镍相比,铁的金属活动性 > (选填“>”“<”或“=”)镍,判断依据是 Fe+NiSO4 Ni+FeSO4 (写化学方程式)。
(5)白铜的成分是 铜、镍 (写名称),其硬度比纯铜 大 (选填“大”或“小”)。
>
Fe+NiSO4 Ni
+FeSO4
铜、镍
大
11.(核心素养)某化学兴趣小组利用如图所示的装置对CO还原Fe2O3的实验进行探究(固定装置已省略)。
【查阅资料】①CO能溶于铜液;②NaOH溶液能与二氧化碳反应,生成碳酸钠和水;NaOH溶液不与一氧化碳反应;③浓硫酸具有吸水性。
(1)按图连接装置A~E,在装入试剂前,先 检查装置的气密性 。
(2)写出装置B中反应的化学方程式: CO2+2NaOHNa2C
O3+H2O 。
(3)通入CO2一段时间后,先点燃 A (选填“A”或“D”)处酒精喷灯。
检查装置的气
密性
CO2+
2NaOHNa2CO3
A
+H2O
(4)装置C中玻璃管的作用是 调节压强 。
(5)反应一段时间后,能证明CO与Fe2O3反应的实验现象是 D中玻璃管内红色固体变成黑色; E中澄清的石灰水变浑浊 。
写出装置E中反应的化学方程式: Ca(OH)2+CO2 CaCO3↓+H2O 。
调节压强
玻璃管内红色固体变成黑色; E中澄清的石灰水变浑
浊
Ca(OH)2+CO2 CaCO3↓
+H2O
D中
(6)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是 吸收一氧化碳 。
装置E、F的接口连接顺序是a连接 c (选填“b”或“c”)。
吸收一氧化碳
c
同课章节目录
