化学人教版(2019)必修第二册5.2.1氮气和氮的氧化物 课件(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.1氮气和氮的氧化物 课件(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-15 08:23:36 | ||
图片预览









文档简介
(共31张PPT)
第二节 氮及其化合物(1) ——N2、NOx
第五章 化工生产中的重要非金属元素
回顾:N的“位”“构”“性”
1
位置:
2
结构:
第二周期 V A族
3
性质:
原子结构示意图
+7
2
5
氮元素非金属性——比氧弱,比碳强
硝酸的酸性——比磷酸强
最外层有5个电子,既不容易得到3个电子,也不容易失去5个电子
一般通过共用电子对与其他原子结合
4
自然界存在:
【P11】
主要以 N2 的形式存在于空气中
动植物体内的蛋白质中
土壤、海洋里的硝酸盐\铵盐中
一、氮气的结构、性质及用途
1.氮气的物理性质
颜色 气味 密度 溶解性 沸点
无色 无味 1.25 g/L 比空气稍小 难溶于水 -196 ℃
液氮可作冷冻剂
收集氮气时用排水法不用排空气法
一、氮气的结构、性质及用途
2.氮气的结构
电子式: 结构式:
预测N2的化学性质:
N≡N
断开N≡N化学键需要较多的能量,
共价键很牢固,氮气化学性质很稳定。
氮气可用作保护气
一、氮气的结构、性质及用途
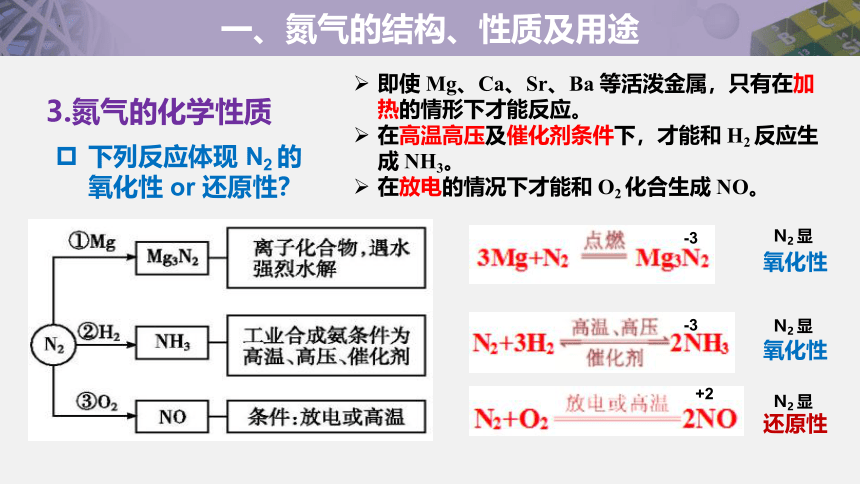
下列反应体现 N2 的
氧化性 or 还原性?
即使 Mg、Ca、Sr、Ba 等活泼金属,只有在加热的情形下才能反应。
在高温高压及催化剂条件下,才能和 H2 反应生成 NH3。
在放电的情况下才能和 O2 化合生成 NO。
3.氮气的化学性质
氧化性
N2 显
氧化性
N2 显
还原性
N2 显
-3
-3
+2
一、氮气的结构、性质及用途
4.氮气的制备、用途
工业上由液态空气分馏来获得氮气
实验室:亚硝酸铵(NH4 NO2)固体加热归中
-3
+3
用途:冷冻剂、保护气、食品加工助剂、合成氨/硝酸等
二、自然界中氮的循环
“魔鬼谷“之谜
在新疆与青海交界处有一山谷,常常电闪雷鸣,并有大量牲畜死亡,当地牧民称之为“魔鬼谷”,但是这里却牧草茂盛,四季长青。
Q: 阅读教材第11-12页, 分析归纳
“自然固氮”、“人工固氮”的概念。
二、自然界中氮的循环
1.氮的固定
概念:将大气中游离态的氮转化为氮的化合物的过程
分类
自然
固氮
高能固氮 (雷雨天气N2转化为NO)
生物固氮 (豆科植物的根瘤菌固氮)
人工
固氮
合成氨 (工业合成氨)
仿生固氮
(某些有机催化剂可起到类似根瘤菌的作用)
二、自然界中氮的循环
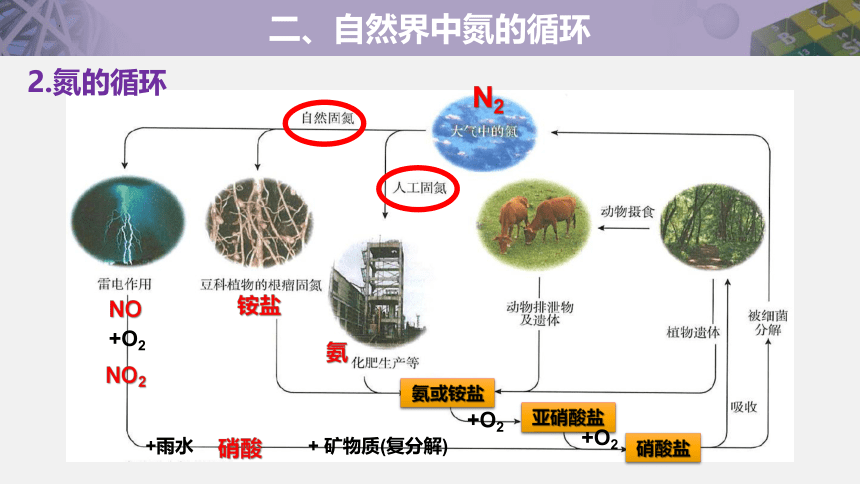
2.氮的循环
N2
NO
+雨水 + 矿物质(复分解)
铵盐
氨
氨或铵盐
亚硝酸盐
硝酸盐
+O2
+O2
+O2
NO2
硝酸
三、氮的氧化物
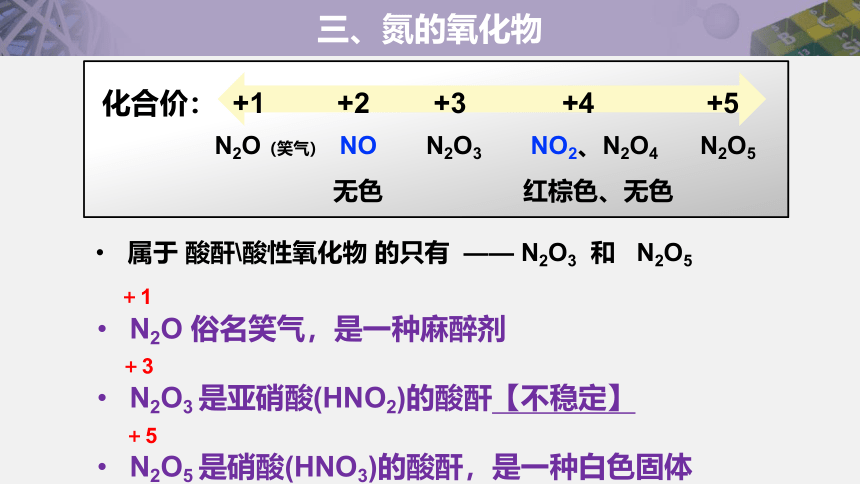
属于 酸酐\酸性氧化物 的只有 —— N2O3 和 N2O5
化合价: +1 +2 +3 +4 +5
N2O(笑气) NO N2O3 NO2、N2O4 N2O5
无色 红棕色、无色
N2O 俗名笑气,是一种麻醉剂
N2O3 是亚硝酸(HNO2)的酸酐【不稳定】
N2O5 是硝酸(HNO3)的酸酐,是一种白色固体
+1
+3
+5
三、氮的氧化物——NO和NO2
1. 物理性质
物质 颜色 状态 气味 毒性 水溶性
NO _____ 气体 _____ 有毒 ___溶于水
NO2 _______ 气体 _______ 有毒 ___溶于水
无色
无味
不
红棕色
刺激性
易
三、氮的氧化物——NO和NO2
现象:
结论:
1. 观察到NO2为红棕色气体;
2. 与水反应后,试管中液面上升,小试管内红棕色气体消失;
3. 紫色石蕊变红。
红棕色NO2气体与水发生反应生成硝酸和无色的NO气体;
NO难溶于水。
1. 在一支小试管里装有一定量NO2气体,观察颜色。
2. 打开橡胶塞,放入盛有水的水槽中一段时间,观察现象。
3. 取少量溶液,加入紫色石蕊试液,测溶液酸碱性。
操作:
实验探究
3NO2+H2O=2HNO3+NO
2NO+O2=2NO2
三、氮的氧化物——NO和NO2
① NO→NO2: _____________________
② NO2→NO: _____________________________
2 NO + O2 = 2 NO2
3 NO2 + H2O = 2 HNO3 + NO
NO在常温下很容易与O2化合,生成NO2
NO2溶于水时生成HNO3和NO,工业上利用这一原理生产HNO3
2. 化学性质
+2
+4
+4
+5
+2
如何收集?
4NO2 + O2 + 2H2O = 4HNO3
NO2、O2何比例混合通入水,气体完全吸收?
“雷雨作用”的固氮过程(雷雨发庄稼)
写出转化过程中化学反应方程式。
③ 3NO2+H2O = 2HNO3+NO
② 2NO+O2=2NO2
①
“魔鬼谷“之谜解密
N2与O2
NO
O2
NO2
HNO3
硝酸盐
矿物质
闪电
①
②
③
氮肥
H2O
三、氮的氧化物——NO和NO2
① NO→NO2: _____________________(验证NO的方法)
② NO2→NO: ________________________(NO2单独通入水)
2 NO + O2 = 2 NO2
3 NO2 + H2O = 2 HNO3 + NO
2. 化学性质
③ NO2通入碱溶液: ______________________________
④ 等量NO/NO2通入碱溶液:
___________________________________
NO2 + NO + 2 NaOH = 2 NaNO2 + H2O
+2
+4
+4
+5
+2
2 NO2 + 2 NaOH = NaNO3 + NaNO2 + H2O
+4
+5
+3
+4
差异理解?HNO2不稳定
2 HNO2 = H2O + NO↑ + NO2↑
+2
+3
注:NO单独通入
碱溶液,并不反应
三、氮的氧化物——NO和NO2
模型思考?
NO2、NO、O2 三者混合通入水,完全吸收时的要求?
NO2、NO 两者混合通入足量NaOH(aq),完全吸收时的要求?
n(NO) 小于等于 n(NO2)
得失电子守恒:n(O2) = n(NO) + n(NO2)
三、氮的氧化物——NO和NO2
3. 收集与检验
NO难溶于水,易与空气反应
NO2易溶于水,易与水反应
检验方法:
NO —— 向气体中通入少量O2或空气,气体由无色变为红棕色,则该气体为NO;
NO2 —— 将红棕色气体通入水中,若看到红棕色褪去,而在瓶口又可以重新出现红棕色,则该气体为NO2。
NO —— 排液法收集
NO2 —— 向上排空气法收集
收集
三、氮的氧化物——NO和NO2
4. 氮氧化物对环境的污染
① 光化学烟雾:在紫外线作用下,NOx与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx 排入大气中后,与水反应生成 HNO2和HNO3,随雨雪降到地面 【硝酸型酸雨】
硫酸/硝酸型酸雨的形成过程相互交织 ——
NO2+SO2 = NO+SO3 【NO2的氧化性】
③破坏臭氧层:NOx可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
城市中过量NOx的来源
—— 汽车气缸高温
性 质 NO NO2
物理性质
毒 性
与水反应
与氧气反应
实验室制备
收集方法
其他
对环境影响
无色、无味的有毒气体,难溶于水
红棕色、有刺激性气味的有毒气体
不反应 (难溶于水)
3NO2+H2O = 2HNO3+NO
2NO + O2 = 2NO2
不反应
铜与稀硝酸反应
铜与浓硝酸反应
常用排水法
常用向上排空气法
2NO2 N2O4
导致 光化学烟雾 和 酸雨,破坏臭氧层
有毒
有毒
小结
1.下列叙述中与氮的固定无关的是( )
A. 工业合成氨
B. 工业上将氨转化成硝酸和其他氮的氧化物
C. 豆科植物的根瘤菌吸收空气中的 N2 使之转化成植物蛋白质
D. 电闪雷鸣的雨天, N2 与 O2 会发生反应并最终转化为硝酸盐被植物吸收
解析:氮的固定过程是使游离态的氮转化为化合态的氮,B项,NH3转化为HNO3不符合要求。
B
2.下列属于人工固氮的化学反应是( )
A. N2 与 H2 在一定条件下合成 NH3
B. NO 与 O2 反应生成 NO2
C. NH3 被 O2 氧化成 NO 和 H2O
D. 由 NH3 制备化肥 NH4HCO3
解析:固氮的方式有自然固氮和人工固氮,工业合成氨为人工固氮,雷雨天气产生NO气体属于自然固氮。另外,豆科植物的根瘤菌能将空气中的氮气直接转化为植物体内的蛋白质,也属于自然固氮。
A
3. 下列有关氮气的说法正确的是( )
A. 氮气是由氮原子构成的双原子分子,所以化学性质不活泼
B. 医学上常用液氮做冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C. H2与N2在一定条件下反应生成NH3,反应中N2体现氧化性
D. 电闪雷鸣的雨天, 雨水中会含有一定量的硝酸, 其中可能发生的反应有 N2+2O2 2NO2
C
解析:A项,氮气性质稳定的原因是两个氮原子之间的作用力比较强,破坏这种作用力时需要很高的能量;B项,液氮汽化时需要吸收大量的能量,使周围环境温度降低,与其化学性质的不活泼无关;C项,反应的化学方程式为N2+3H2 2NH3,反应中氮元素化合价降低,氮气做氧化剂;D项,N2和O2在放电条件下生成NO,不能直接生成NO2。
4.下列有关氮气的叙述中,错误的是( )
A. 工业上,氮气常用作焊接金属的保护气
B. 在雷雨天,空气中的N2和O2可反应生成NO
C. 氮气既可做氧化剂又可做还原剂
D. 向某容器中充入1 mol N2可与3 mol H2完全反应生成2 mol NH3
解析:N2与H2的反应属于可逆反应,1 mol N2和3 mol H2不可能完全反应生成2 mol NH3,故D项错误;因氮气的化学性质很不活泼,常用作焊接金属的保护气;N2中的氮元素为0价,处于中间价态,故N2既可做氧化剂,又可做还原剂。
D
5.运载火箭的推进剂引燃后产生的气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红棕色烟雾。产生红棕色烟雾的原因是( )
A. 高温下N2遇空气生成NO2
B. NO遇空气生成NO2
C. CO2遇NO反应生成CO和NO2
D. NO和H2O反应生成H2和NO2
解析:根据火箭喷出的大量红棕色烟雾可推知其应是NO2,而高温下N2与O2不能生成NO2。
B
例1:在标况下,把一个大量筒装满水, 倒置于水槽中,先通入10 mL NO,然后通入20 mL O2,问最后剩余气体为多少?
解:
4NO + 3O2 + 2H2O == 4HNO3
10 mL x mL
现有氧气20 mL, 所以 O2 过量,
应根据 NO 的体积计算
剩余氧气有12.5mL.
故 x = 7.5 mL
例2:将12 mL NO2与O2混合气体被水充分吸收后,发现剩余2 mL气体 ,问原混合气体体积各为多少?
讨论:
(1)若剩余气体为O2,则
4NO2 + O2 + 2H2O === 4HNO3 ΔV
4 1 5
x mL [过量] 12 – 2 = 10mL
V(NO2)0 = x = 4×10÷5 = 8mL
V(O2)0 = (12–8) mL= 4 mL【2 mL反应,剩 2 mL】
例2:将12 mL NO2与O2混合气体被水充分吸收后,发现剩余2 mL气体 ,问原混合气体体积各为多少?
讨论:
设 V(NO2)0
= (4x + 6) mL
解得 V(O2)0 = x= 1.2 mL
V(NO2)0 = x= 10.8 mL
(2)若剩余气体是NO,则考虑两组反应
3 NO2 + H2O = 2 HNO3 + NO
2 mL
6 mL
4 NO2 + O2 + 2H2O = 4 HNO3
4x x
V0总 = (4x + 6) + x = 12 mL
则 V(O2)0
= x mL
例3:将40mLNO 和 NO2 的混合气体跟 20mL O2 同时通入装满水倒立于水槽中的量筒中,发现有 5 mL 气体剩余,问原 NO 和 NO2 混合气体的体积组成是什么?
(1)若剩余气体为O2,则无NO和NO2剩余,
设原有NO2体积为x, 则NO的体积为(40-x)
3NO2 + H2O == 2HNO3 + NO
x
x/3
4NO + 3O2 + 2H2O === 4HNO3
40-x+x/3 (20-5)
x = 30mL VNO = 10mL
故原气体组成为: VNO2 = 30mL
讨论:
(2) 若剩余气体为NO,无O2、NO2剩余
设原NO体积为y,则NO2体积为(40-y)
3NO2 + H2O === 2HNO3 + NO
40-y
(40-y)/3
4NO + 3O2 + 2H2O === 4HNO3
20
y+(40-y)/3-5
y=27.5mL, 则NO2体积为12.5mL
例3:将40mLNO 和 NO2 的混合气体跟 20mL O2 同时通入装满水倒立于水槽中的量筒中,发现有 5 mL 气体剩余,问原 NO 和 NO2 混合气体的体积组成是什么?
讨论:
谢
谢
看
观
谢
谢
看
观
下
课
啦
~
第二节 氮及其化合物(1) ——N2、NOx
第五章 化工生产中的重要非金属元素
回顾:N的“位”“构”“性”
1
位置:
2
结构:
第二周期 V A族
3
性质:
原子结构示意图
+7
2
5
氮元素非金属性——比氧弱,比碳强
硝酸的酸性——比磷酸强
最外层有5个电子,既不容易得到3个电子,也不容易失去5个电子
一般通过共用电子对与其他原子结合
4
自然界存在:
【P11】
主要以 N2 的形式存在于空气中
动植物体内的蛋白质中
土壤、海洋里的硝酸盐\铵盐中
一、氮气的结构、性质及用途
1.氮气的物理性质
颜色 气味 密度 溶解性 沸点
无色 无味 1.25 g/L 比空气稍小 难溶于水 -196 ℃
液氮可作冷冻剂
收集氮气时用排水法不用排空气法
一、氮气的结构、性质及用途
2.氮气的结构
电子式: 结构式:
预测N2的化学性质:
N≡N
断开N≡N化学键需要较多的能量,
共价键很牢固,氮气化学性质很稳定。
氮气可用作保护气
一、氮气的结构、性质及用途
下列反应体现 N2 的
氧化性 or 还原性?
即使 Mg、Ca、Sr、Ba 等活泼金属,只有在加热的情形下才能反应。
在高温高压及催化剂条件下,才能和 H2 反应生成 NH3。
在放电的情况下才能和 O2 化合生成 NO。
3.氮气的化学性质
氧化性
N2 显
氧化性
N2 显
还原性
N2 显
-3
-3
+2
一、氮气的结构、性质及用途
4.氮气的制备、用途
工业上由液态空气分馏来获得氮气
实验室:亚硝酸铵(NH4 NO2)固体加热归中
-3
+3
用途:冷冻剂、保护气、食品加工助剂、合成氨/硝酸等
二、自然界中氮的循环
“魔鬼谷“之谜
在新疆与青海交界处有一山谷,常常电闪雷鸣,并有大量牲畜死亡,当地牧民称之为“魔鬼谷”,但是这里却牧草茂盛,四季长青。
Q: 阅读教材第11-12页, 分析归纳
“自然固氮”、“人工固氮”的概念。
二、自然界中氮的循环
1.氮的固定
概念:将大气中游离态的氮转化为氮的化合物的过程
分类
自然
固氮
高能固氮 (雷雨天气N2转化为NO)
生物固氮 (豆科植物的根瘤菌固氮)
人工
固氮
合成氨 (工业合成氨)
仿生固氮
(某些有机催化剂可起到类似根瘤菌的作用)
二、自然界中氮的循环
2.氮的循环
N2
NO
+雨水 + 矿物质(复分解)
铵盐
氨
氨或铵盐
亚硝酸盐
硝酸盐
+O2
+O2
+O2
NO2
硝酸
三、氮的氧化物
属于 酸酐\酸性氧化物 的只有 —— N2O3 和 N2O5
化合价: +1 +2 +3 +4 +5
N2O(笑气) NO N2O3 NO2、N2O4 N2O5
无色 红棕色、无色
N2O 俗名笑气,是一种麻醉剂
N2O3 是亚硝酸(HNO2)的酸酐【不稳定】
N2O5 是硝酸(HNO3)的酸酐,是一种白色固体
+1
+3
+5
三、氮的氧化物——NO和NO2
1. 物理性质
物质 颜色 状态 气味 毒性 水溶性
NO _____ 气体 _____ 有毒 ___溶于水
NO2 _______ 气体 _______ 有毒 ___溶于水
无色
无味
不
红棕色
刺激性
易
三、氮的氧化物——NO和NO2
现象:
结论:
1. 观察到NO2为红棕色气体;
2. 与水反应后,试管中液面上升,小试管内红棕色气体消失;
3. 紫色石蕊变红。
红棕色NO2气体与水发生反应生成硝酸和无色的NO气体;
NO难溶于水。
1. 在一支小试管里装有一定量NO2气体,观察颜色。
2. 打开橡胶塞,放入盛有水的水槽中一段时间,观察现象。
3. 取少量溶液,加入紫色石蕊试液,测溶液酸碱性。
操作:
实验探究
3NO2+H2O=2HNO3+NO
2NO+O2=2NO2
三、氮的氧化物——NO和NO2
① NO→NO2: _____________________
② NO2→NO: _____________________________
2 NO + O2 = 2 NO2
3 NO2 + H2O = 2 HNO3 + NO
NO在常温下很容易与O2化合,生成NO2
NO2溶于水时生成HNO3和NO,工业上利用这一原理生产HNO3
2. 化学性质
+2
+4
+4
+5
+2
如何收集?
4NO2 + O2 + 2H2O = 4HNO3
NO2、O2何比例混合通入水,气体完全吸收?
“雷雨作用”的固氮过程(雷雨发庄稼)
写出转化过程中化学反应方程式。
③ 3NO2+H2O = 2HNO3+NO
② 2NO+O2=2NO2
①
“魔鬼谷“之谜解密
N2与O2
NO
O2
NO2
HNO3
硝酸盐
矿物质
闪电
①
②
③
氮肥
H2O
三、氮的氧化物——NO和NO2
① NO→NO2: _____________________(验证NO的方法)
② NO2→NO: ________________________(NO2单独通入水)
2 NO + O2 = 2 NO2
3 NO2 + H2O = 2 HNO3 + NO
2. 化学性质
③ NO2通入碱溶液: ______________________________
④ 等量NO/NO2通入碱溶液:
___________________________________
NO2 + NO + 2 NaOH = 2 NaNO2 + H2O
+2
+4
+4
+5
+2
2 NO2 + 2 NaOH = NaNO3 + NaNO2 + H2O
+4
+5
+3
+4
差异理解?HNO2不稳定
2 HNO2 = H2O + NO↑ + NO2↑
+2
+3
注:NO单独通入
碱溶液,并不反应
三、氮的氧化物——NO和NO2
模型思考?
NO2、NO、O2 三者混合通入水,完全吸收时的要求?
NO2、NO 两者混合通入足量NaOH(aq),完全吸收时的要求?
n(NO) 小于等于 n(NO2)
得失电子守恒:n(O2) = n(NO) + n(NO2)
三、氮的氧化物——NO和NO2
3. 收集与检验
NO难溶于水,易与空气反应
NO2易溶于水,易与水反应
检验方法:
NO —— 向气体中通入少量O2或空气,气体由无色变为红棕色,则该气体为NO;
NO2 —— 将红棕色气体通入水中,若看到红棕色褪去,而在瓶口又可以重新出现红棕色,则该气体为NO2。
NO —— 排液法收集
NO2 —— 向上排空气法收集
收集
三、氮的氧化物——NO和NO2
4. 氮氧化物对环境的污染
① 光化学烟雾:在紫外线作用下,NOx与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx 排入大气中后,与水反应生成 HNO2和HNO3,随雨雪降到地面 【硝酸型酸雨】
硫酸/硝酸型酸雨的形成过程相互交织 ——
NO2+SO2 = NO+SO3 【NO2的氧化性】
③破坏臭氧层:NOx可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
城市中过量NOx的来源
—— 汽车气缸高温
性 质 NO NO2
物理性质
毒 性
与水反应
与氧气反应
实验室制备
收集方法
其他
对环境影响
无色、无味的有毒气体,难溶于水
红棕色、有刺激性气味的有毒气体
不反应 (难溶于水)
3NO2+H2O = 2HNO3+NO
2NO + O2 = 2NO2
不反应
铜与稀硝酸反应
铜与浓硝酸反应
常用排水法
常用向上排空气法
2NO2 N2O4
导致 光化学烟雾 和 酸雨,破坏臭氧层
有毒
有毒
小结
1.下列叙述中与氮的固定无关的是( )
A. 工业合成氨
B. 工业上将氨转化成硝酸和其他氮的氧化物
C. 豆科植物的根瘤菌吸收空气中的 N2 使之转化成植物蛋白质
D. 电闪雷鸣的雨天, N2 与 O2 会发生反应并最终转化为硝酸盐被植物吸收
解析:氮的固定过程是使游离态的氮转化为化合态的氮,B项,NH3转化为HNO3不符合要求。
B
2.下列属于人工固氮的化学反应是( )
A. N2 与 H2 在一定条件下合成 NH3
B. NO 与 O2 反应生成 NO2
C. NH3 被 O2 氧化成 NO 和 H2O
D. 由 NH3 制备化肥 NH4HCO3
解析:固氮的方式有自然固氮和人工固氮,工业合成氨为人工固氮,雷雨天气产生NO气体属于自然固氮。另外,豆科植物的根瘤菌能将空气中的氮气直接转化为植物体内的蛋白质,也属于自然固氮。
A
3. 下列有关氮气的说法正确的是( )
A. 氮气是由氮原子构成的双原子分子,所以化学性质不活泼
B. 医学上常用液氮做冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C. H2与N2在一定条件下反应生成NH3,反应中N2体现氧化性
D. 电闪雷鸣的雨天, 雨水中会含有一定量的硝酸, 其中可能发生的反应有 N2+2O2 2NO2
C
解析:A项,氮气性质稳定的原因是两个氮原子之间的作用力比较强,破坏这种作用力时需要很高的能量;B项,液氮汽化时需要吸收大量的能量,使周围环境温度降低,与其化学性质的不活泼无关;C项,反应的化学方程式为N2+3H2 2NH3,反应中氮元素化合价降低,氮气做氧化剂;D项,N2和O2在放电条件下生成NO,不能直接生成NO2。
4.下列有关氮气的叙述中,错误的是( )
A. 工业上,氮气常用作焊接金属的保护气
B. 在雷雨天,空气中的N2和O2可反应生成NO
C. 氮气既可做氧化剂又可做还原剂
D. 向某容器中充入1 mol N2可与3 mol H2完全反应生成2 mol NH3
解析:N2与H2的反应属于可逆反应,1 mol N2和3 mol H2不可能完全反应生成2 mol NH3,故D项错误;因氮气的化学性质很不活泼,常用作焊接金属的保护气;N2中的氮元素为0价,处于中间价态,故N2既可做氧化剂,又可做还原剂。
D
5.运载火箭的推进剂引燃后产生的气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红棕色烟雾。产生红棕色烟雾的原因是( )
A. 高温下N2遇空气生成NO2
B. NO遇空气生成NO2
C. CO2遇NO反应生成CO和NO2
D. NO和H2O反应生成H2和NO2
解析:根据火箭喷出的大量红棕色烟雾可推知其应是NO2,而高温下N2与O2不能生成NO2。
B
例1:在标况下,把一个大量筒装满水, 倒置于水槽中,先通入10 mL NO,然后通入20 mL O2,问最后剩余气体为多少?
解:
4NO + 3O2 + 2H2O == 4HNO3
10 mL x mL
现有氧气20 mL, 所以 O2 过量,
应根据 NO 的体积计算
剩余氧气有12.5mL.
故 x = 7.5 mL
例2:将12 mL NO2与O2混合气体被水充分吸收后,发现剩余2 mL气体 ,问原混合气体体积各为多少?
讨论:
(1)若剩余气体为O2,则
4NO2 + O2 + 2H2O === 4HNO3 ΔV
4 1 5
x mL [过量] 12 – 2 = 10mL
V(NO2)0 = x = 4×10÷5 = 8mL
V(O2)0 = (12–8) mL= 4 mL【2 mL反应,剩 2 mL】
例2:将12 mL NO2与O2混合气体被水充分吸收后,发现剩余2 mL气体 ,问原混合气体体积各为多少?
讨论:
设 V(NO2)0
= (4x + 6) mL
解得 V(O2)0 = x= 1.2 mL
V(NO2)0 = x= 10.8 mL
(2)若剩余气体是NO,则考虑两组反应
3 NO2 + H2O = 2 HNO3 + NO
2 mL
6 mL
4 NO2 + O2 + 2H2O = 4 HNO3
4x x
V0总 = (4x + 6) + x = 12 mL
则 V(O2)0
= x mL
例3:将40mLNO 和 NO2 的混合气体跟 20mL O2 同时通入装满水倒立于水槽中的量筒中,发现有 5 mL 气体剩余,问原 NO 和 NO2 混合气体的体积组成是什么?
(1)若剩余气体为O2,则无NO和NO2剩余,
设原有NO2体积为x, 则NO的体积为(40-x)
3NO2 + H2O == 2HNO3 + NO
x
x/3
4NO + 3O2 + 2H2O === 4HNO3
40-x+x/3 (20-5)
x = 30mL VNO = 10mL
故原气体组成为: VNO2 = 30mL
讨论:
(2) 若剩余气体为NO,无O2、NO2剩余
设原NO体积为y,则NO2体积为(40-y)
3NO2 + H2O === 2HNO3 + NO
40-y
(40-y)/3
4NO + 3O2 + 2H2O === 4HNO3
20
y+(40-y)/3-5
y=27.5mL, 则NO2体积为12.5mL
例3:将40mLNO 和 NO2 的混合气体跟 20mL O2 同时通入装满水倒立于水槽中的量筒中,发现有 5 mL 气体剩余,问原 NO 和 NO2 混合气体的体积组成是什么?
讨论:
谢
谢
看
观
谢
谢
看
观
下
课
啦
~
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
