2024年高三化学专题复习 水溶液中离子反应与平衡(共22张PPT)
文档属性
| 名称 | 2024年高三化学专题复习 水溶液中离子反应与平衡(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-15 09:20:06 | ||
图片预览






文档简介
(共22张PPT)
01
请在此输入您的文本。请在此输入您的文本。请在此输入您的文本。请在此输入您的文本。
水溶液中的离子反应与平衡
考情分析
问题:
1、复杂情境下如何快速识别图像
2、图像中如何快速找到K计算的突破口
学情分析
学会数形结合识图、辨图,并应用于常数计算,深化Ksp的计算。
学习目标
识图辨图与常数计算
重难点
主题一:识图辨图
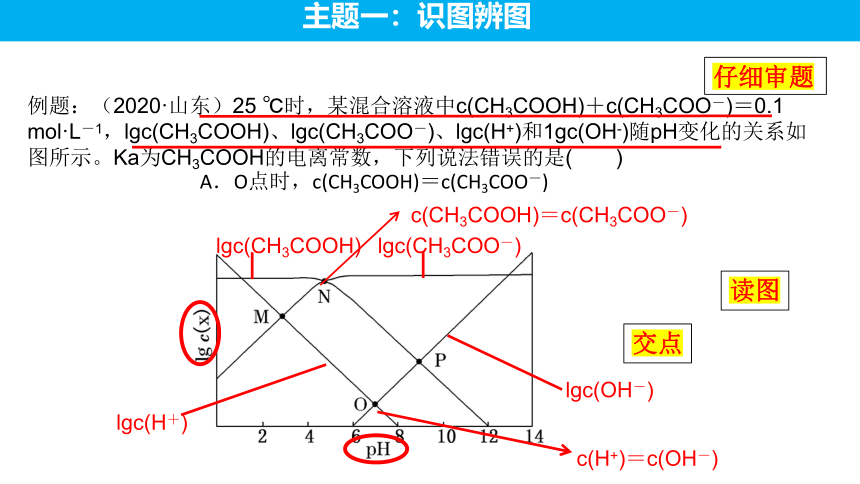
例题:(2020·山东)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法错误的是( )
lgc(CH3COOH)
lgc(CH3COO-)
lgc(H+)
lgc(OH-)
c(CH3COOH)=c(CH3COO-)
c(H+)=c(OH-)
仔细审题
读图
交点
A.O点时,c(CH3COOH)=c(CH3COO-)
概括归理1 识图辨图方法
主题一:识图辨图
一面
二线
三看点
明确坐标含义
分析曲线代表的
意义和变化趋势
结合离子反应和平衡原理
与浓度或比值正相关:lgc、
、 lg 等
与浓度或比值负相关:pH、 pOH、pc、pK等
核心突破一:识图辨图
思考与交流1
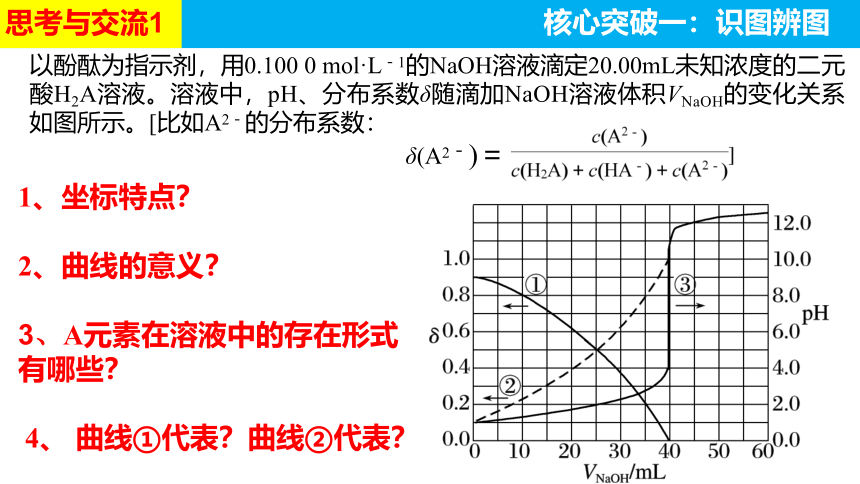
以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布系数:
δ(A2-)=
1、坐标特点?
2、曲线的意义?
3、A元素在溶液中的存在形式有哪些?
4、 曲线①代表?曲线②代表?
主题一:识图辨图
对数-PH图像
【练习1】人体血液存在H2CO3/HCO3-、HPO42-/H2PO4-等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示c(H2CO3)/c(HCO3-)或c(HPO42-)/c(H2PO4-)]与pH的关系如图所示。已知碳酸pKal=6.4、磷酸pKa2=7.2(pKa=-lgKa)。
A曲线Ⅰ表示1gc[c((HPO42-)/c(H2PO4-)]与
pH的变化关系
巩固题组一
×
【练习4】 主题一:识图辨图
√
巩固题组一
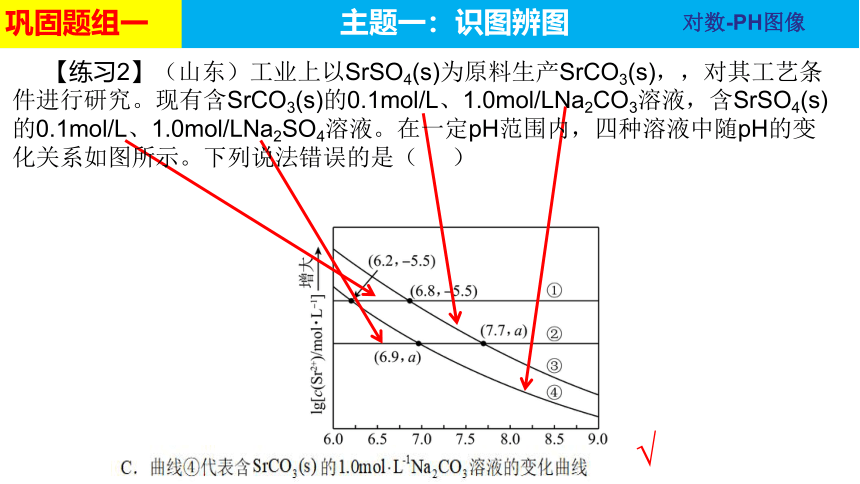
【练习2】(山东)工业上以SrSO4(s)为原料生产SrCO3(s),,对其工艺条件进行研究。现有含SrCO3(s)的0.1mol/L、1.0mol/LNa2CO3溶液,含SrSO4(s)的0.1mol/L、1.0mol/LNa2SO4溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是( )
对数-PH图像
主题一:识图辨图
分布系数-PH图像
【练习3】(2021山东济南联考)已知H3PO4是一种三元中强酸。25 ℃时,向某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷粒子的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列说法正确的是( )
H2PO4-
PO43-
H3PO4
HPO42-
A.曲线2表示HPO42-曲线4表示PO43-
巩固题组一
主题二:有关各类常数的计算和换算
例题:(山东)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法错误的是( )
lgc(CH3COOH)
lgc(CH3COO-)
lgc(H+)
lgc(OH-)
c(CH3COOH)=c(CH3COO-)
c(H+)=c(OH-)
交点
B.N点时,pH=-lg Ka
Ka= 代入等量关系并变形可知pH=-lg Ka
概括归理2 思维模型----求数找点
主题二:有关各类常数的计算和换算
写出表达式
明确表达式中c的意义
思考c之间的关系
寻找图像中的相关点
找点的依据:
滴定曲线:起点、恰好点、中性点
比值对数曲线:0点或赋值点
分布系数曲线:交点
沉淀溶解平衡曲线:线上点
主题二:有关各类常数的计算和换算
思考与交流2
根据下面的图像求K
√
√
主题二:有关各类常数的计算和换算
巩固题组二
【练习1】 (山东)工业上以SrSO4(s)为原料生产SrCO3(s),,对其工艺条件进行研究。现有含SrCO3(s)的0.1mol/L、1.0mol/LNa2CO3溶液,
含SrSO4(s)的0.1mol/L、1.0mol/LNa2SO4溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是( )
【练习2】(2023潍坊期末)常温下,天然水体中的H2CO3与空气中的CO2保持平衡,pH变化对H2CO3的浓度基本无影响。已知Ksp(CaCO3)=2.8×10-9,常温时测得某溶洞水体中-lgc(X)(X为H2CO3、HCO3-、CO32-、或Ca2+)与pH的关系如图所示。下列说法正确的是( )
HCO3-
CO32-
Ca2+
H2CO3
B. H2CO3的二级电离常数Ka2=10-8.3
主题二:有关各类常数的计算和换算
巩固题组二
×
√
主题二:有关各类常数的计算和换算
【练习3】(2023枣庄期末)25℃时,向20mol0.5mol/L的弱碱(MOH)溶液中
逐滴加入浓度为0.25mol/L的盐酸,溶液中 和溶液的pOH[pOH=-lgc(OH-)]
随中和率变化关系如图所示,下列说法错误的是
巩固题组二
H2A
HA-
A2-
主题二:有关各类常数的计算和换算
应用提升
×
主题二:有关各类常数的计算和换算
知识梳理:
1、如何判断开始沉淀?
2、如何判断沉淀离子沉淀完全?
3、如何判断沉淀的先后?
1、判断沉淀的生成:Q≥Ksp开始生成沉淀
2、判断沉淀是否完全:离子浓度c≤1.0×10-5 mol·L-1时沉淀完全
3、判断沉淀顺序:利用Ksp计算所需沉淀剂的最小浓度,所需浓度越小越优先沉淀。
概括归理3 Ksp的计算依据
【练习1】(滨州期末)镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下:
已知:①镓在元素周期表中位于第四周期ⅢA族,化学性质与铝相似。
②lg2=0.3,lg3=0.48。③部分物质的Ksp如表所示:
物质 Zn(OH)2 Ga(OH)3 Fe(OH)2 Fe(OH)3
Ksp 1.6×10-17 2.7×10-31 8×10-16 2.8×10-39
(2)调pH的目的是_________________________________________;室温条件下,若浸出液中各阳离子的浓度均为0.01 mol·L-1,当溶液中某种离子浓度小于1×10-5 mol·L-1时即认为该离子已完全除去,则pH应调节的范围为____________________。
使Fe3+、Ga3+沉淀完全而Zn2+不沉淀
5.48~6.6
主题二:有关各类常数的计算和换算
提纯离子不沉淀
杂质离子沉淀完全
巩固题组三
【练习2】(山东高考)(13分)工业上以氟磷灰石[Ca5F(PO4)3],含SiO2等杂质]为原料生产磷酸和石膏,工艺流程如下:
SO42-
主题二:有关各类常数的计算和换算
巩固题组三
优先沉淀
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比n(Na2CO3):n(SiF62-)= 1:1
加入Na2CO3脱氟,充分反应后,c(Na+)=_______ mol L-1;再分批加入一定量的BaCO3,
首先转化为沉淀的离子是_______。
2×10-2
BaSiF6 Na2SiF6 CaSO4 BaSO4
Ksp 1.0×10-6 4.0×10-6 9.0×10-4 1.0×10-10
课堂小结
03
培养学科素养:
宏观辨识与微观探析
变化观念与平衡思想
识图、辨图
各类常数的计算和换算
Ksp的计算
02
提升关键能力:
理解与辨析
分析与推测
归纳与论证
数形结合
求数找点
夯实必备知识
01
水溶液中的离子反应与平衡
高考必胜
01
请在此输入您的文本。请在此输入您的文本。请在此输入您的文本。请在此输入您的文本。
水溶液中的离子反应与平衡
考情分析
问题:
1、复杂情境下如何快速识别图像
2、图像中如何快速找到K计算的突破口
学情分析
学会数形结合识图、辨图,并应用于常数计算,深化Ksp的计算。
学习目标
识图辨图与常数计算
重难点
主题一:识图辨图
例题:(2020·山东)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法错误的是( )
lgc(CH3COOH)
lgc(CH3COO-)
lgc(H+)
lgc(OH-)
c(CH3COOH)=c(CH3COO-)
c(H+)=c(OH-)
仔细审题
读图
交点
A.O点时,c(CH3COOH)=c(CH3COO-)
概括归理1 识图辨图方法
主题一:识图辨图
一面
二线
三看点
明确坐标含义
分析曲线代表的
意义和变化趋势
结合离子反应和平衡原理
与浓度或比值正相关:lgc、
、 lg 等
与浓度或比值负相关:pH、 pOH、pc、pK等
核心突破一:识图辨图
思考与交流1
以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布系数:
δ(A2-)=
1、坐标特点?
2、曲线的意义?
3、A元素在溶液中的存在形式有哪些?
4、 曲线①代表?曲线②代表?
主题一:识图辨图
对数-PH图像
【练习1】人体血液存在H2CO3/HCO3-、HPO42-/H2PO4-等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示c(H2CO3)/c(HCO3-)或c(HPO42-)/c(H2PO4-)]与pH的关系如图所示。已知碳酸pKal=6.4、磷酸pKa2=7.2(pKa=-lgKa)。
A曲线Ⅰ表示1gc[c((HPO42-)/c(H2PO4-)]与
pH的变化关系
巩固题组一
×
【练习4】 主题一:识图辨图
√
巩固题组一
【练习2】(山东)工业上以SrSO4(s)为原料生产SrCO3(s),,对其工艺条件进行研究。现有含SrCO3(s)的0.1mol/L、1.0mol/LNa2CO3溶液,含SrSO4(s)的0.1mol/L、1.0mol/LNa2SO4溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是( )
对数-PH图像
主题一:识图辨图
分布系数-PH图像
【练习3】(2021山东济南联考)已知H3PO4是一种三元中强酸。25 ℃时,向某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷粒子的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列说法正确的是( )
H2PO4-
PO43-
H3PO4
HPO42-
A.曲线2表示HPO42-曲线4表示PO43-
巩固题组一
主题二:有关各类常数的计算和换算
例题:(山东)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法错误的是( )
lgc(CH3COOH)
lgc(CH3COO-)
lgc(H+)
lgc(OH-)
c(CH3COOH)=c(CH3COO-)
c(H+)=c(OH-)
交点
B.N点时,pH=-lg Ka
Ka= 代入等量关系并变形可知pH=-lg Ka
概括归理2 思维模型----求数找点
主题二:有关各类常数的计算和换算
写出表达式
明确表达式中c的意义
思考c之间的关系
寻找图像中的相关点
找点的依据:
滴定曲线:起点、恰好点、中性点
比值对数曲线:0点或赋值点
分布系数曲线:交点
沉淀溶解平衡曲线:线上点
主题二:有关各类常数的计算和换算
思考与交流2
根据下面的图像求K
√
√
主题二:有关各类常数的计算和换算
巩固题组二
【练习1】 (山东)工业上以SrSO4(s)为原料生产SrCO3(s),,对其工艺条件进行研究。现有含SrCO3(s)的0.1mol/L、1.0mol/LNa2CO3溶液,
含SrSO4(s)的0.1mol/L、1.0mol/LNa2SO4溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是( )
【练习2】(2023潍坊期末)常温下,天然水体中的H2CO3与空气中的CO2保持平衡,pH变化对H2CO3的浓度基本无影响。已知Ksp(CaCO3)=2.8×10-9,常温时测得某溶洞水体中-lgc(X)(X为H2CO3、HCO3-、CO32-、或Ca2+)与pH的关系如图所示。下列说法正确的是( )
HCO3-
CO32-
Ca2+
H2CO3
B. H2CO3的二级电离常数Ka2=10-8.3
主题二:有关各类常数的计算和换算
巩固题组二
×
√
主题二:有关各类常数的计算和换算
【练习3】(2023枣庄期末)25℃时,向20mol0.5mol/L的弱碱(MOH)溶液中
逐滴加入浓度为0.25mol/L的盐酸,溶液中 和溶液的pOH[pOH=-lgc(OH-)]
随中和率变化关系如图所示,下列说法错误的是
巩固题组二
H2A
HA-
A2-
主题二:有关各类常数的计算和换算
应用提升
×
主题二:有关各类常数的计算和换算
知识梳理:
1、如何判断开始沉淀?
2、如何判断沉淀离子沉淀完全?
3、如何判断沉淀的先后?
1、判断沉淀的生成:Q≥Ksp开始生成沉淀
2、判断沉淀是否完全:离子浓度c≤1.0×10-5 mol·L-1时沉淀完全
3、判断沉淀顺序:利用Ksp计算所需沉淀剂的最小浓度,所需浓度越小越优先沉淀。
概括归理3 Ksp的计算依据
【练习1】(滨州期末)镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下:
已知:①镓在元素周期表中位于第四周期ⅢA族,化学性质与铝相似。
②lg2=0.3,lg3=0.48。③部分物质的Ksp如表所示:
物质 Zn(OH)2 Ga(OH)3 Fe(OH)2 Fe(OH)3
Ksp 1.6×10-17 2.7×10-31 8×10-16 2.8×10-39
(2)调pH的目的是_________________________________________;室温条件下,若浸出液中各阳离子的浓度均为0.01 mol·L-1,当溶液中某种离子浓度小于1×10-5 mol·L-1时即认为该离子已完全除去,则pH应调节的范围为____________________。
使Fe3+、Ga3+沉淀完全而Zn2+不沉淀
5.48~6.6
主题二:有关各类常数的计算和换算
提纯离子不沉淀
杂质离子沉淀完全
巩固题组三
【练习2】(山东高考)(13分)工业上以氟磷灰石[Ca5F(PO4)3],含SiO2等杂质]为原料生产磷酸和石膏,工艺流程如下:
SO42-
主题二:有关各类常数的计算和换算
巩固题组三
优先沉淀
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比n(Na2CO3):n(SiF62-)= 1:1
加入Na2CO3脱氟,充分反应后,c(Na+)=_______ mol L-1;再分批加入一定量的BaCO3,
首先转化为沉淀的离子是_______。
2×10-2
BaSiF6 Na2SiF6 CaSO4 BaSO4
Ksp 1.0×10-6 4.0×10-6 9.0×10-4 1.0×10-10
课堂小结
03
培养学科素养:
宏观辨识与微观探析
变化观念与平衡思想
识图、辨图
各类常数的计算和换算
Ksp的计算
02
提升关键能力:
理解与辨析
分析与推测
归纳与论证
数形结合
求数找点
夯实必备知识
01
水溶液中的离子反应与平衡
高考必胜
同课章节目录
