化学人教版(2019)必修第一册1.3.3氧化还原反应的规律与应用 课件(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.3氧化还原反应的规律与应用 课件(共27张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-15 17:39:33 | ||
图片预览







文档简介
(共27张PPT)
第一章 物质及其变化
2019人教版必修一
第三节 氧化还原反应
红酒中添加二氧化硫的原因
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
ClO2
O3
KMnO4
H2O2
生活中常用ClO2、KMnO4、O3、H2O2物质能杀菌消毒,利用其氧化性
氧化剂具有氧化性
生活中常见的氧化剂
第三课时 氧化还原反应的规律与应用
核心素养发展目标
1、从化合价的角度分析氧化性、还原性以及氧化还原反应的价态规律
2、能利用氧化还原反应的概念判断物质的氧化性和还原性
3、归纳常见的氧化剂和还原剂
4、同种元素不同价态物质间,能否发生氧化还原反应。
氧化性和还原性
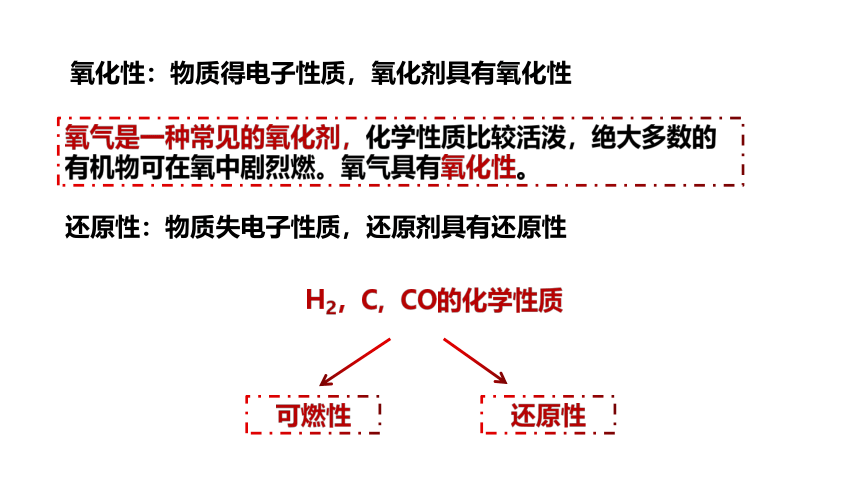
氧化性:物质得电子性质,氧化剂具有氧化性
氧气是一种常见的氧化剂,化学性质比较活泼,绝大多数的有机物可在氧中剧烈燃。氧气具有氧化性。
还原性:物质失电子性质,还原剂具有还原性
H2,C, CO的化学性质
可燃性
还原性
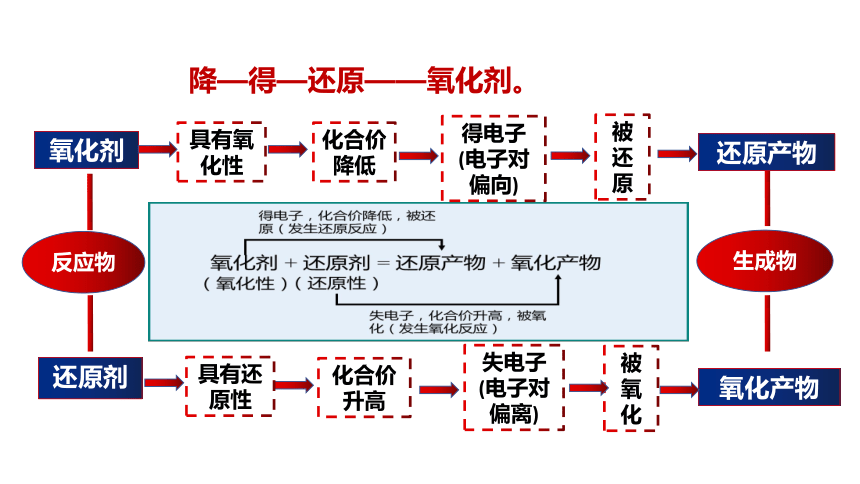
化合价降低
反应物
氧化剂
还原剂
生成物
还原产物
被还原
失电子(电子对偏离)
被氧化
氧化产物
升—失—氧化——还原剂,
降—得—还原——氧化剂。
构建氧化还原反应概念模型
具有氧化性
得电子(电子对偏向)
化合价升高
具有还原性
依据反应Fe+CuSO4=FeSO4+Cu,请总结一下:判断有关微粒的氧化性与还原性的强弱有何规律?
物质的氧化性、还原性其强弱如何判断?
氧化性、还原性强弱的比较
1、根据氧化还原反应进行的方向判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
例:根据下列反应判断有关物质还原性强弱的顺序
H2SO3 > I- > Fe2+
I- > Fe2+ > H2SO3
Fe2+ > I- > H2SO3
Fe2+ > H2SO3 > I-
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
2、根据金属活动性顺序判断
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
K+Ca2+Na+Mg2+Al3+ Zn2+Fe2+ Sn2+ Pb2+(H+) Cu2+ Hg2+Ag+
得电子能力逐渐增强,氧化性逐渐增强
氧化性、还原性强弱的比较
3、根据非金属活动性顺序进行判断
F2 O2 Cl2 Br2 I2 S ( N2 P C Si H2 )
得电子能力减弱,氧化性减弱
F- Cl- Br- I- S2-
失电子能力增强,还原性增强
氧化性、还原性强弱的比较
4、根据氧化还原反应发生的难易程度(反应条件高低)与相对强弱性不同进行判断:
2)一种还原剂和多种氧化剂反应,反应条件低则氧化性强,先发生反应—即“谁低谁强,谁强谁先”原则
[例如] :
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
MnO2 + 4HCl (浓)= MnCl2 + Cl2 + 2H2O
△
氧化性、还原性强弱的比较
1)一种氧化剂和多种还原剂反应,反应条件低则还原性强, 先发生反应;
-2
0
+4
+6
氧化性
氧化性
还原性
还原性
据元素的价态,判断是否具有氧化性或还原性
硫元素化合价有:-2、0、+4、+6,
请判断下列微粒中硫元素具有下列哪些性质:
① 只有氧化性
② 只有还原性
③ 既有氧化性又有还原性
1. H2SO4 ___________
2. SO2 _____________________
3. Na2S ____________
只有氧化性
既有氧化性又有还原性
只有还原性
硫元素各个价态的氧化性和还原性
-2
0
+4
+6
氧化性
氧化性
还原性
氧化性
还原性
还原性
a、处于最高价态的元素 → 只有氧化性;
b、处于最低价态的元素 → 只有还原性;
c、处于中间价态的元素 → 既有氧化性又有还原性
价态律
注意:
物质的氧化性、还原性不同于元素的氧化性、还原性
例如:HCl
根据价态规律,你知道哪些物质可做氧化剂?
氧化剂 还原产物
类别 物质 活泼非金属单质
氧化性酸
高价盐
过氧化物
O2
O2-
Cl2
Cl-
浓硫酸
NO2 NO
HNO3
KMnO4(H+)
Mn2+
SO2
FeCl3
FeCl2
H2O2
H2O
根据价态规律,你知道哪些物质可做氧化剂?
还原剂 氧化产物
类别 物质 少数非金属单质
金属单质
阴离子
阳离子
C
CO CO2
H2
H2O
Na
Cu2+
Cu
I-
I2
Na+
S2-
S
Fe2+
Fe3+
根据价态规律,你知道哪些物质可做还原剂?
下列反应中双氧水表现什么性质(氧化性或还原性)?
Cl2+H2O2=2HCl+O2↑
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
2H2O2 H2O+O2↑
H2O2
在氧化还原反应中,化合价有升必有降
守恒律
还原剂失电子总数 = 氧化剂得电子总数
即:化合价升高总数 = 化合价降低总数
原子个数相等的镁、铝,分别与足量的硫酸反应,求产生氢气的个数之比。
2∶3
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
若溶液中有若干物质具有氧化性,加入一还有剂,哪种物质先和还原剂反应呢?
C
优先律
同等条件下,谁强谁先反应。
不同的氧化剂与同一还原剂反应,氧化性强的氧化剂先反应
强者优先
优先律
不同的还原剂与同一氧化剂反应,还原性强的还原剂先反应
如:将Zn和Fe同时投入稀HCl溶液中,谁先反应?
Zn先反应,因为还原性:Zn>Fe.
H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O
-2 +6 0 +4
失去2e-
得2e-
转化律
不同价态的同一元素的化合物间反应,遵循:
元素化合价只靠拢, 不交叉,最多到同价。
同种元素发生氧化还原反应有何要求?
-2
0
+4
+6
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 - 1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
转化律
一些酸在反应中可以表现出多种性质,该反应盐酸表现什么性质?
氧化剂和还原剂个数之比是多少?
2NaOH+H2SO4=Na2SO4+H2O
例:分析下列反应中硫酸的作用
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
酸性
氧化性
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
酸性
氧化性
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 - 1 0
得到5e-
失去5×e-
转化律
反应盐酸表现什么性质?氧化剂和还原剂个数之比是多少?
酸性,还原性
1:5
如何证明维生素C还原性强于二价铁离子?
氧化还原反应的应用
维生素C+ → Fe2+
?
FeCl3溶液
2CO + 2NO=== 2CO2 + N2
高温
催化剂
还原剂
氧化剂
目前,汽车尾气系统中均安装了催化转化器(如图⒈-17)。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(1)请写出上述反应的化学方程式。
(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。
+2 +2 +4 0
化合价升高, 失2×2e-, 被氧化
化合价降低, 得2×2e-电子, 被还原
氧化产物
还原产物
教材P24【思考与讨论】
NO、CO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2,和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。
氧化还原反应的应用
碘缺乏病是机体因缺碘导致的疾病,即地方性甲状腺肿大和地方性克汀病,主要病因是环境缺碘,人体摄取碘不足所致。
我国政府对碘缺乏病相当重视,为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可用如下反应:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
问题探究:(1)上述反应中,氧化剂、还原剂、氧化产物、还原产物分别是什么物质?
(2)上述反应中,氧化产物与还原产物的质量比是多少?
(3)请分别用双线桥法和单线桥法标出该反应电子转移的方向和数目。
氧化剂是KIO3,还原剂是KI,氧化产物、还原产物均是I2
5∶1
氧化还原反应的应用
氧化还原反应
惯穿于整个中学化学
学好规律 解决问题
第一章 物质及其变化
2019人教版必修一
第三节 氧化还原反应
红酒中添加二氧化硫的原因
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
ClO2
O3
KMnO4
H2O2
生活中常用ClO2、KMnO4、O3、H2O2物质能杀菌消毒,利用其氧化性
氧化剂具有氧化性
生活中常见的氧化剂
第三课时 氧化还原反应的规律与应用
核心素养发展目标
1、从化合价的角度分析氧化性、还原性以及氧化还原反应的价态规律
2、能利用氧化还原反应的概念判断物质的氧化性和还原性
3、归纳常见的氧化剂和还原剂
4、同种元素不同价态物质间,能否发生氧化还原反应。
氧化性和还原性
氧化性:物质得电子性质,氧化剂具有氧化性
氧气是一种常见的氧化剂,化学性质比较活泼,绝大多数的有机物可在氧中剧烈燃。氧气具有氧化性。
还原性:物质失电子性质,还原剂具有还原性
H2,C, CO的化学性质
可燃性
还原性
化合价降低
反应物
氧化剂
还原剂
生成物
还原产物
被还原
失电子(电子对偏离)
被氧化
氧化产物
升—失—氧化——还原剂,
降—得—还原——氧化剂。
构建氧化还原反应概念模型
具有氧化性
得电子(电子对偏向)
化合价升高
具有还原性
依据反应Fe+CuSO4=FeSO4+Cu,请总结一下:判断有关微粒的氧化性与还原性的强弱有何规律?
物质的氧化性、还原性其强弱如何判断?
氧化性、还原性强弱的比较
1、根据氧化还原反应进行的方向判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
例:根据下列反应判断有关物质还原性强弱的顺序
H2SO3 > I- > Fe2+
I- > Fe2+ > H2SO3
Fe2+ > I- > H2SO3
Fe2+ > H2SO3 > I-
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
2、根据金属活动性顺序判断
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
K+Ca2+Na+Mg2+Al3+ Zn2+Fe2+ Sn2+ Pb2+(H+) Cu2+ Hg2+Ag+
得电子能力逐渐增强,氧化性逐渐增强
氧化性、还原性强弱的比较
3、根据非金属活动性顺序进行判断
F2 O2 Cl2 Br2 I2 S ( N2 P C Si H2 )
得电子能力减弱,氧化性减弱
F- Cl- Br- I- S2-
失电子能力增强,还原性增强
氧化性、还原性强弱的比较
4、根据氧化还原反应发生的难易程度(反应条件高低)与相对强弱性不同进行判断:
2)一种还原剂和多种氧化剂反应,反应条件低则氧化性强,先发生反应—即“谁低谁强,谁强谁先”原则
[例如] :
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
MnO2 + 4HCl (浓)= MnCl2 + Cl2 + 2H2O
△
氧化性、还原性强弱的比较
1)一种氧化剂和多种还原剂反应,反应条件低则还原性强, 先发生反应;
-2
0
+4
+6
氧化性
氧化性
还原性
还原性
据元素的价态,判断是否具有氧化性或还原性
硫元素化合价有:-2、0、+4、+6,
请判断下列微粒中硫元素具有下列哪些性质:
① 只有氧化性
② 只有还原性
③ 既有氧化性又有还原性
1. H2SO4 ___________
2. SO2 _____________________
3. Na2S ____________
只有氧化性
既有氧化性又有还原性
只有还原性
硫元素各个价态的氧化性和还原性
-2
0
+4
+6
氧化性
氧化性
还原性
氧化性
还原性
还原性
a、处于最高价态的元素 → 只有氧化性;
b、处于最低价态的元素 → 只有还原性;
c、处于中间价态的元素 → 既有氧化性又有还原性
价态律
注意:
物质的氧化性、还原性不同于元素的氧化性、还原性
例如:HCl
根据价态规律,你知道哪些物质可做氧化剂?
氧化剂 还原产物
类别 物质 活泼非金属单质
氧化性酸
高价盐
过氧化物
O2
O2-
Cl2
Cl-
浓硫酸
NO2 NO
HNO3
KMnO4(H+)
Mn2+
SO2
FeCl3
FeCl2
H2O2
H2O
根据价态规律,你知道哪些物质可做氧化剂?
还原剂 氧化产物
类别 物质 少数非金属单质
金属单质
阴离子
阳离子
C
CO CO2
H2
H2O
Na
Cu2+
Cu
I-
I2
Na+
S2-
S
Fe2+
Fe3+
根据价态规律,你知道哪些物质可做还原剂?
下列反应中双氧水表现什么性质(氧化性或还原性)?
Cl2+H2O2=2HCl+O2↑
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
2H2O2 H2O+O2↑
H2O2
在氧化还原反应中,化合价有升必有降
守恒律
还原剂失电子总数 = 氧化剂得电子总数
即:化合价升高总数 = 化合价降低总数
原子个数相等的镁、铝,分别与足量的硫酸反应,求产生氢气的个数之比。
2∶3
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
若溶液中有若干物质具有氧化性,加入一还有剂,哪种物质先和还原剂反应呢?
C
优先律
同等条件下,谁强谁先反应。
不同的氧化剂与同一还原剂反应,氧化性强的氧化剂先反应
强者优先
优先律
不同的还原剂与同一氧化剂反应,还原性强的还原剂先反应
如:将Zn和Fe同时投入稀HCl溶液中,谁先反应?
Zn先反应,因为还原性:Zn>Fe.
H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O
-2 +6 0 +4
失去2e-
得2e-
转化律
不同价态的同一元素的化合物间反应,遵循:
元素化合价只靠拢, 不交叉,最多到同价。
同种元素发生氧化还原反应有何要求?
-2
0
+4
+6
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 - 1 0
得到5e-
失去5×e-
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去6×e-
得到6e-
转化律
一些酸在反应中可以表现出多种性质,该反应盐酸表现什么性质?
氧化剂和还原剂个数之比是多少?
2NaOH+H2SO4=Na2SO4+H2O
例:分析下列反应中硫酸的作用
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
酸性
氧化性
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
酸性
氧化性
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 - 1 0
得到5e-
失去5×e-
转化律
反应盐酸表现什么性质?氧化剂和还原剂个数之比是多少?
酸性,还原性
1:5
如何证明维生素C还原性强于二价铁离子?
氧化还原反应的应用
维生素C+ → Fe2+
?
FeCl3溶液
2CO + 2NO=== 2CO2 + N2
高温
催化剂
还原剂
氧化剂
目前,汽车尾气系统中均安装了催化转化器(如图⒈-17)。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(1)请写出上述反应的化学方程式。
(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。
+2 +2 +4 0
化合价升高, 失2×2e-, 被氧化
化合价降低, 得2×2e-电子, 被还原
氧化产物
还原产物
教材P24【思考与讨论】
NO、CO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2,和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。
氧化还原反应的应用
碘缺乏病是机体因缺碘导致的疾病,即地方性甲状腺肿大和地方性克汀病,主要病因是环境缺碘,人体摄取碘不足所致。
我国政府对碘缺乏病相当重视,为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可用如下反应:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
问题探究:(1)上述反应中,氧化剂、还原剂、氧化产物、还原产物分别是什么物质?
(2)上述反应中,氧化产物与还原产物的质量比是多少?
(3)请分别用双线桥法和单线桥法标出该反应电子转移的方向和数目。
氧化剂是KIO3,还原剂是KI,氧化产物、还原产物均是I2
5∶1
氧化还原反应的应用
氧化还原反应
惯穿于整个中学化学
学好规律 解决问题
