化学人教版(2019)选择性必修第一册 3.1.1强电解质与弱电解质 课件(共18张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修第一册 3.1.1强电解质与弱电解质 课件(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 951.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-15 17:40:41 | ||
图片预览





文档简介
(共18张PPT)
第一节 电离平衡
第1课时
第三章 水溶液中的离子平衡
【学科素养】
了解强、弱电解质的概念;
掌握强电解质与弱电解质的判断;
3.掌握弱电解质的电离方程式的书写;
4.掌握弱电解质的电离平衡;
主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
化学与生活
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)。
你知道吗?
实验内容 0.1 mol·L-1 HCl 0.1 mol·L-1 CH3COOH
溶液的pH
溶液的H+浓度
【实验探究3-1】分别测等体积、等浓度的盐酸、醋酸溶液的pH。
1
2.8
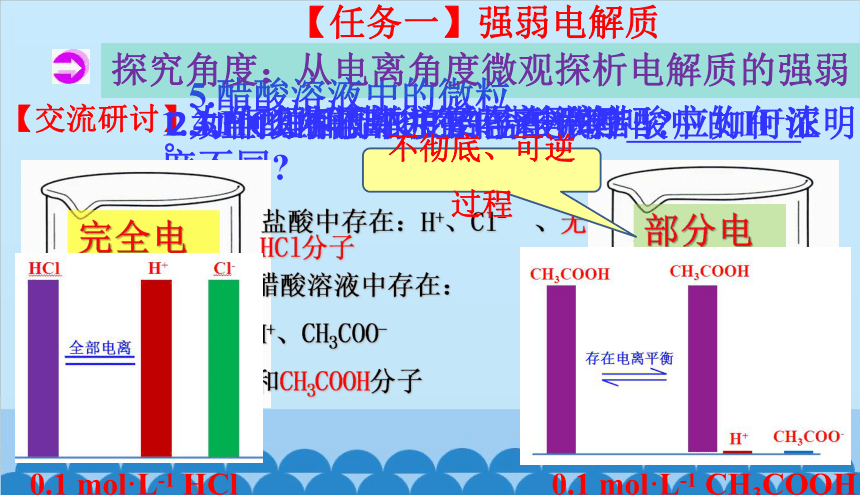
【任务一】强弱电解质
探究角度:从电离角度微观探析电解质的强弱
资料卡片:PH= - lgC(H+)
PH=1 C(H+) =0.1mol/L
PH=2.8 C(H+) =0.00168mol/L
0.1mol/L
0.00168mol/L
【交流研讨】
1.为什么相同浓度的盐酸和醋酸中的H+浓度不同
2.如何理解醋酸的部分电离
3.HCl的电离也有电离平衡吗 应如何证明
4.盐酸溶液中主要存在微粒 。
5.醋酸溶液中的微粒 。
盐酸中存在:H+、Cl- 、无HCl分子
【任务一】强弱电解质
探究角度:从电离角度微观探析电解质的强弱
完全电离
部分电离
0.1 mol·L-1 HCl
0.1 mol·L-1 CH3COOH
不彻底、可逆过程
醋酸溶液中存在:
H+、CH3COO-
和CH3COOH分子
常见的强电解质:
【任务一】强弱电解质
探究角度:从物质种类宏观辨识电解质的强弱
金属氧化物:
少数盐:醋酸铅、HgCl2等
H2O是极弱电解质。
强酸:
HCl、HBr、HI、H2SO4、HNO3、HClO4等。
强碱:
NaOH、KOH、Ba(OH)2、Ca(OH)2等
绝大多数盐:
NaCl、NH4Cl、Fe(NO3)3、BaSO4等
Na2O等
常见的弱电解质:
弱酸:
HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:
NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
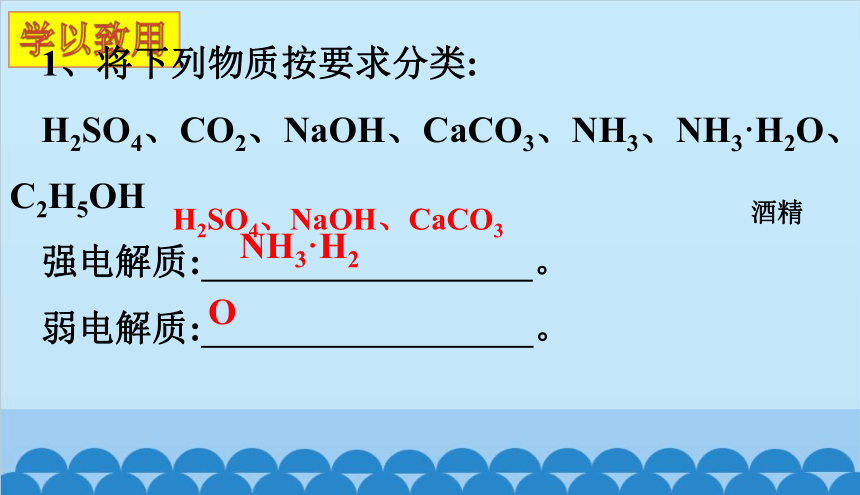
学以致用
1、将下列物质按要求分类:
H2SO4、CO2、NaOH、CaCO3、NH3、NH3·H2O、C2H5OH
强电解质: 。
弱电解质: 。
NH3·H2O
H2SO4、NaOH、CaCO3
酒精
学以致用
2、相同体积、相同浓度的盐酸和醋酸导电能力谁强?
0.1 mol·L-1 HCl
0.1 mol·L-1 CH3COOH
在相同条件下与相同的镁片反应现象相同吗?
1、原则:遵循质量守恒、电荷守恒、客观事实
2、书写:
①强电解质:“=”、弱电解质:“
”
②多元弱酸分步电离,以第一步电离为主,分 步书写。
③多元弱碱分步电离,一步书写。
④强酸酸式盐的电离:NaHSO4=Na++H++SO42- (水中)
NaHSO4=Na++HSO4-(熔融状态)
⑤弱酸酸式盐的电离:NaHCO3= Na++HCO3-
HCO3-
H++CO32-
【任务二】弱电解质的电离方程式的书写
特别提醒:
探究角度:强弱电解质电离符号表征
写法指导
先判断
后书写
【任务三】电离平衡状态
1.电离平衡态建立:
c(H+) C(CH3COO-) c(CH3COOH)
CH3COOH初溶于水时
达到电离平衡前
达到电离平衡时
速率
时间/t
时间/t
浓度/C
t1
t1
2.电离平衡状态的特征:
①逆:②等:③动:④定:⑤变:
最小
最小
最大
不变
不变
不变
变大
变大
变小
探究角度:变化观念和平衡思想认识电离平衡
o
o
υ电离
υ结合
υ电离 =υ结合
电离平衡状态
C(CH3COOH)
C(CH3COO-)、C(H+)
思考交流:影响化学平衡移动的因素有哪些?
在水溶液中影响电离平衡的因素有哪些?
①温度
②浓度
当外界条件改变时符合“勒夏特列原理”
探究角度:变化观念和平衡思想认识电离平衡
【任务三】电离平衡状态
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加CH3COONa(s)
加少量浓盐酸
CH3COOH CH3COO- + H+
逆向
减小
增大
减小
逆向
减小
增大
减小
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
c(CH3COO-) ↑
c(H+) ↑
同离子效应:增大电离出的离子浓度——抑制
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加NaOH(s)
加入金属Mg
CH3COOH CH3COO- + H+
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
c(H+) ↓
离子反应:减小电离出的离子浓度——促进
c(H+) ↓
正向
增大
减小
增大
正向
增大
减小
增大
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加热升温
CH3COOH CH3COO- + H+
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
升高T
正向
增大
增大
增大
越热越电离:升高温度——促进
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加水稀释
加入冰醋酸
CH3COOH CH3COO- + H+
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
增加反应物浓度
体积变大
正向
增大
减小
减小
正向
减小
增大
增大
越稀越电离:加水稀释——促进
化学与生活
你知道吗?
变化观念和平衡思想认识电离平衡
强弱电解质电离符号表征
微观探析电解质的强弱
物质种类宏观辨识
课堂小结
强电解质
弱电解质
第一节 电离平衡
第1课时
第三章 水溶液中的离子平衡
【学科素养】
了解强、弱电解质的概念;
掌握强电解质与弱电解质的判断;
3.掌握弱电解质的电离方程式的书写;
4.掌握弱电解质的电离平衡;
主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
化学与生活
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)。
你知道吗?
实验内容 0.1 mol·L-1 HCl 0.1 mol·L-1 CH3COOH
溶液的pH
溶液的H+浓度
【实验探究3-1】分别测等体积、等浓度的盐酸、醋酸溶液的pH。
1
2.8
【任务一】强弱电解质
探究角度:从电离角度微观探析电解质的强弱
资料卡片:PH= - lgC(H+)
PH=1 C(H+) =0.1mol/L
PH=2.8 C(H+) =0.00168mol/L
0.1mol/L
0.00168mol/L
【交流研讨】
1.为什么相同浓度的盐酸和醋酸中的H+浓度不同
2.如何理解醋酸的部分电离
3.HCl的电离也有电离平衡吗 应如何证明
4.盐酸溶液中主要存在微粒 。
5.醋酸溶液中的微粒 。
盐酸中存在:H+、Cl- 、无HCl分子
【任务一】强弱电解质
探究角度:从电离角度微观探析电解质的强弱
完全电离
部分电离
0.1 mol·L-1 HCl
0.1 mol·L-1 CH3COOH
不彻底、可逆过程
醋酸溶液中存在:
H+、CH3COO-
和CH3COOH分子
常见的强电解质:
【任务一】强弱电解质
探究角度:从物质种类宏观辨识电解质的强弱
金属氧化物:
少数盐:醋酸铅、HgCl2等
H2O是极弱电解质。
强酸:
HCl、HBr、HI、H2SO4、HNO3、HClO4等。
强碱:
NaOH、KOH、Ba(OH)2、Ca(OH)2等
绝大多数盐:
NaCl、NH4Cl、Fe(NO3)3、BaSO4等
Na2O等
常见的弱电解质:
弱酸:
HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:
NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
学以致用
1、将下列物质按要求分类:
H2SO4、CO2、NaOH、CaCO3、NH3、NH3·H2O、C2H5OH
强电解质: 。
弱电解质: 。
NH3·H2O
H2SO4、NaOH、CaCO3
酒精
学以致用
2、相同体积、相同浓度的盐酸和醋酸导电能力谁强?
0.1 mol·L-1 HCl
0.1 mol·L-1 CH3COOH
在相同条件下与相同的镁片反应现象相同吗?
1、原则:遵循质量守恒、电荷守恒、客观事实
2、书写:
①强电解质:“=”、弱电解质:“
”
②多元弱酸分步电离,以第一步电离为主,分 步书写。
③多元弱碱分步电离,一步书写。
④强酸酸式盐的电离:NaHSO4=Na++H++SO42- (水中)
NaHSO4=Na++HSO4-(熔融状态)
⑤弱酸酸式盐的电离:NaHCO3= Na++HCO3-
HCO3-
H++CO32-
【任务二】弱电解质的电离方程式的书写
特别提醒:
探究角度:强弱电解质电离符号表征
写法指导
先判断
后书写
【任务三】电离平衡状态
1.电离平衡态建立:
c(H+) C(CH3COO-) c(CH3COOH)
CH3COOH初溶于水时
达到电离平衡前
达到电离平衡时
速率
时间/t
时间/t
浓度/C
t1
t1
2.电离平衡状态的特征:
①逆:②等:③动:④定:⑤变:
最小
最小
最大
不变
不变
不变
变大
变大
变小
探究角度:变化观念和平衡思想认识电离平衡
o
o
υ电离
υ结合
υ电离 =υ结合
电离平衡状态
C(CH3COOH)
C(CH3COO-)、C(H+)
思考交流:影响化学平衡移动的因素有哪些?
在水溶液中影响电离平衡的因素有哪些?
①温度
②浓度
当外界条件改变时符合“勒夏特列原理”
探究角度:变化观念和平衡思想认识电离平衡
【任务三】电离平衡状态
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加CH3COONa(s)
加少量浓盐酸
CH3COOH CH3COO- + H+
逆向
减小
增大
减小
逆向
减小
增大
减小
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
c(CH3COO-) ↑
c(H+) ↑
同离子效应:增大电离出的离子浓度——抑制
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加NaOH(s)
加入金属Mg
CH3COOH CH3COO- + H+
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
c(H+) ↓
离子反应:减小电离出的离子浓度——促进
c(H+) ↓
正向
增大
减小
增大
正向
增大
减小
增大
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加热升温
CH3COOH CH3COO- + H+
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
升高T
正向
增大
增大
增大
越热越电离:升高温度——促进
3.影响因素:
加入试剂 外界条件改变 平衡移动方向 电离程度 平衡时微粒浓度
c(H+) c(CH3COO-)
加水稀释
加入冰醋酸
CH3COOH CH3COO- + H+
【任务三】电离平衡状态
探究角度:变化观念和平衡思想认识电离平衡
增加反应物浓度
体积变大
正向
增大
减小
减小
正向
减小
增大
增大
越稀越电离:加水稀释——促进
化学与生活
你知道吗?
变化观念和平衡思想认识电离平衡
强弱电解质电离符号表征
微观探析电解质的强弱
物质种类宏观辨识
课堂小结
强电解质
弱电解质
