2023-2024学年人教版化学必修第一册达标练习第2章 1.2氧化钠和过氧化钠(含解析)
文档属性
| 名称 | 2023-2024学年人教版化学必修第一册达标练习第2章 1.2氧化钠和过氧化钠(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 404.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 11:35:30 | ||
图片预览



文档简介
第二章 1.2氧化钠和过氧化钠
一.选择题
1.氧化钠与过氧化钠的相同点是( )
A.均是淡黄色固体
B.均是碱性氧化物
C.均能与水反应生成碱
D.均能与二氧化碳反应放出氧气
2.王刚同学将Na、Na2O、Na2O2、Na2CO3分别投入盛有足量盐酸的1号、2号、3号、4号四支试管中,结果他不会观察到有气泡生成的是( )
A.1号 B.2号
C.3号 D.4号
3.(2023·合肥高一检测)在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出
B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出
D.溶液pH增大,有O2放出
4.某溶液中含有H+、Na+、Mg2+、NO等4种离子,若向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是( )
A.H+ B.Na+
C.Mg2+ D.NO
5.将3.2 g H2和CO的混合气体(其密度为相同条件下氧气密度的),通入一盛有足量Na2O2的密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( )
A.3.2 g B.4.4 g
C.5.6 g D.6.4 g
6.在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其恰好完全反应,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( )
A.54.5% B.40%
C.36% D.33.3%
7.少数不法分子用过氧化钠来漂白、消毒莲子,漂白莲子之后生成的物质有强碱,附在物体上很难清洗干净,身体摄入过量碱是有害的。过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊试液中加入过量Na2O2粉末振荡,可观察到的现象是( )
A.溶液仍为紫色
B.最终溶液褪色,而无其他现象
C.溶液最终变蓝色
D.溶液中有气泡产生,溶液最终变为无色
8.某实验小组通过如图所示实验,探究Na2O2与水的反应。下列说法不正确的是( )
A.②中的大量气泡主要成分是氧气
B.③中溶液变红,说明有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
9.下列关于Na2O2的叙述中正确的是( )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
10.将等质量的下列物质分别投入等质量的足量水中,所得溶液中溶质质量最大的是( )
A.金属钠 B.氧化钠
C.过氧化钠 D.氢氧化钠
11.下列判断正确的是( )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.可利用在氧气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
12下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
A.Na和O2 B.澄清石灰水和CO2
C.Na2O2和CO2 D.木炭(C)和O2
二.非选择题
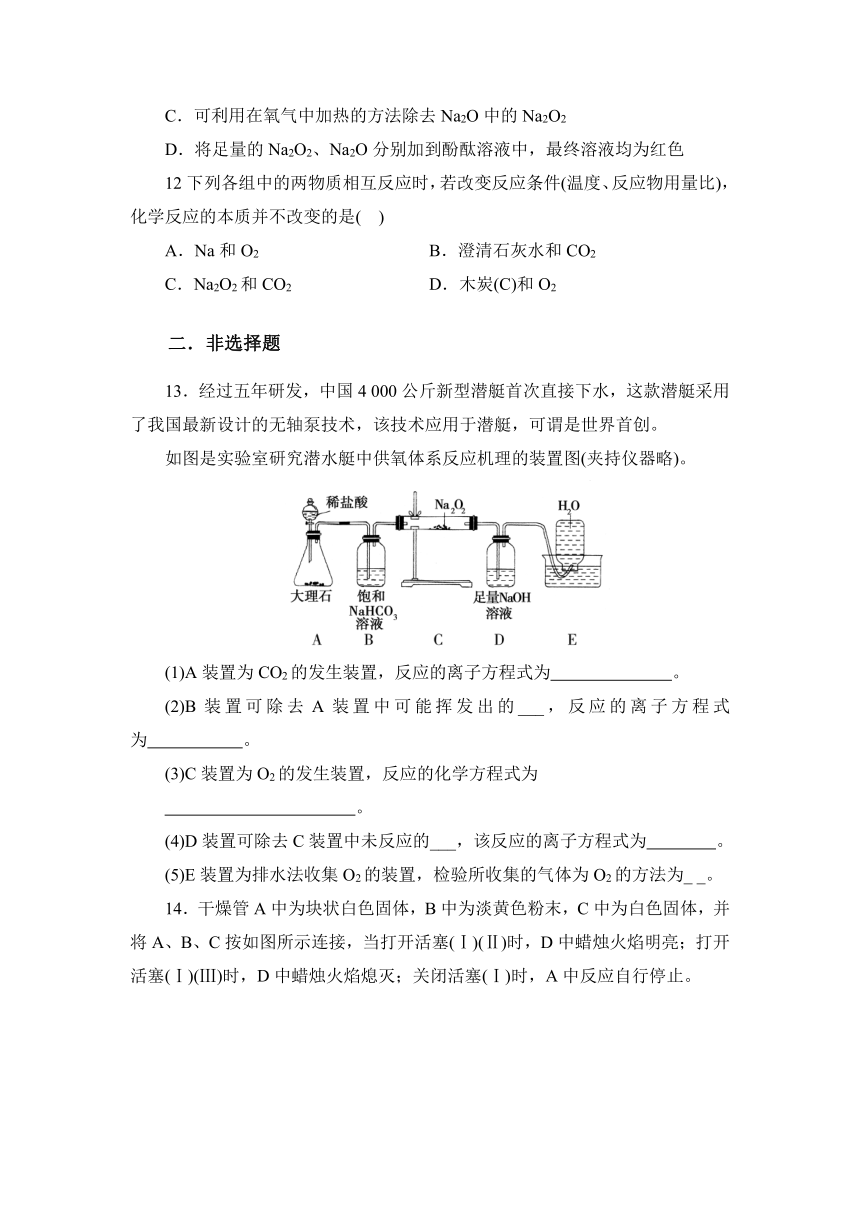
13.经过五年研发,中国4 000公斤新型潜艇首次直接下水,这款潜艇采用了我国最新设计的无轴泵技术,该技术应用于潜艇,可谓是世界首创。
如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为 。
(2)B装置可除去A装置中可能挥发出的___,反应的离子方程式为 。
(3)C装置为O2的发生装置,反应的化学方程式为
。
(4)D装置可除去C装置中未反应的___,该反应的离子方程式为 。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_ _。
14.干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是 。
(2)在装置B中的淡黄色粉末是___。
(3)在干燥管C中的白色固体应为___。
第二章 1.2氧化钠和过氧化钠
一.选择题
1.氧化钠与过氧化钠的相同点是( C )
A.均是淡黄色固体
B.均是碱性氧化物
C.均能与水反应生成碱
D.均能与二氧化碳反应放出氧气
解析:氧化钠为白色固体,A项错误;Na2O2不是碱性氧化物,B项错误;氧化钠和过氧化钠与水反应都生成氢氧化钠(碱),C项正确;Na2O与水反应不放出氧气,D项错误。
2.王刚同学将Na、Na2O、Na2O2、Na2CO3分别投入盛有足量盐酸的1号、2号、3号、4号四支试管中,结果他不会观察到有气泡生成的是( B )
A.1号 B.2号
C.3号 D.4号
解析:Na2O放入盐酸中生成NaCl和H2O,无气泡产生,故选B。
3.(2023·合肥高一检测)在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( C )
A.溶液中Na+浓度增大,有O2放出
B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出
D.溶液pH增大,有O2放出
解析: 2Na2O2+2H2O===4NaOH+O2↑,B错误;因反应时消耗水,同时生成溶质NaOH,所以有NaOH结晶析出,原NaOH饱和溶液中溶质NaOH和溶剂水的质量、物质的量以及数目均减少,C正确;因仍然是原温度下的饱和溶液,所以浓度不发生改变,pH也不变化,A、D错误。
4.某溶液中含有H+、Na+、Mg2+、NO等4种离子,若向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是( D )
A.H+ B.Na+
C.Mg2+ D.NO
解析:Na2O2在溶液中生成NaOH和O2,H+与OH-反应减少,Na+增多,Mg2+转为Mg(OH)2沉淀,只有NO浓度基本不变,故选D。
5.将3.2 g H2和CO的混合气体(其密度为相同条件下氧气密度的),通入一盛有足量Na2O2的密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( A )
A.3.2 g B.4.4 g
C.5.6 g D.6.4 g
6.在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其恰好完全反应,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( A )
A.54.5% B.40%
C.36% D.33.3%
解析: CO与氧气反应的化学方程式为2CO+O22CO2,二氧化碳与过氧化钠反应的化学方程式为2CO2+2Na2O2===2Na2CO3+O2,总反应的化学方程式为CO+Na2O2===Na2CO3,固体增加的质量为CO的质量;氢气与氧气反应的化学方程式为2H2+O22H2O,Na2O2与H2O反应的化学方程式为2H2O+2Na2O2===4NaOH+O2↑,总反应的化学方程式为H2+Na2O2===2NaOH,固体增加的质量为氢气的质量;Na2O2增重7.5 g,即CO与H2质量之和为7.5 g,ω(O2)=×100%≈54.5%。
7.少数不法分子用过氧化钠来漂白、消毒莲子,漂白莲子之后生成的物质有强碱,附在物体上很难清洗干净,身体摄入过量碱是有害的。过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊试液中加入过量Na2O2粉末振荡,可观察到的现象是( D )
A.溶液仍为紫色
B.最终溶液褪色,而无其他现象
C.溶液最终变蓝色
D.溶液中有气泡产生,溶液最终变为无色
解析:Na2O2与水反应生成O2和NaOH,NaOH溶液呈碱性使石蕊试液变蓝,Na2O2具有强氧化性又使溶液褪色,故选D。
8.某实验小组通过如图所示实验,探究Na2O2与水的反应。下列说法不正确的是( D )
A.②中的大量气泡主要成分是氧气
B.③中溶液变红,说明有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
解析:MnO2促进H2O2分解,D项不正确。
综合强化
9.下列关于Na2O2的叙述中正确的是( D )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
解析:Na2O2久置于空气中最终变成Na2CO3,A项错误;Na2O2与水反应时,Na2O2既是氧化剂又是还原剂,B项错误;Na2O2不属于碱性氧化物,C项错误;根据两反应中固体成分的变化:Na2O2Na2CO3、Na2O22NaOH可知,D项正确。
10.将等质量的下列物质分别投入等质量的足量水中,所得溶液中溶质质量最大的是( A )
A.金属钠 B.氧化钠
C.过氧化钠 D.氢氧化钠
解析: 等质量的钠、氧化钠、过氧化钠、氢氧化钠投入足量水中,由钠元素守恒可知,钠与水反应生成NaOH最多,故选A。
11.下列判断正确的是( A )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.可利用在氧气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
解析:Na2O2与水反应会产生气泡,可用水确定Na2O中是否有Na2O2,A项正确;Na2O2与CO2反应无明显现象,无法确定Na2O中是否有Na2O2,B项错误;Na2O在氧气中加热转化为Na2O2,C项错误;Na2O、Na2O2加到酚酞溶液中,二者所得溶液均变红,但Na2O2又会使溶液褪色,故D错误。
12下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( C )
A.Na和O2 B.澄清石灰水和CO2
C.Na2O2和CO2 D.木炭(C)和O2
二.非选择题
13.经过五年研发,中国4 000公斤新型潜艇首次直接下水,这款潜艇采用了我国最新设计的无轴泵技术,该技术应用于潜艇,可谓是世界首创。
如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为 CaCO3+2H+===Ca2++H2O+CO2↑ 。
(2)B装置可除去A装置中可能挥发出的_HCl__,反应的离子方程式为 HCO+H+===H2O+CO2↑ 。
(3)C装置为O2的发生装置,反应的化学方程式为
2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑ 。
(4)D装置可除去C装置中未反应的_CO2__,该反应的离子方程式为 2OH-+CO2===CO+H2O 。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_取出集气瓶正放于桌面上,将一根带火星的木条伸入集气瓶中,若木条复燃,证明所收集的气体为O2__。
解析:(1)实验室用稀盐酸与大理石反应制取CO2。
(2)制得的CO2中混有HCl,通过饱和NaHCO3溶液除去CO2中的HCl。
(3)从B装置中出来的CO2中含有水蒸气,通过C装置时CO2、H2O均能与Na2O2反应产生氧气。
(4)D装置中NaOH溶液的作用是除去CO2。
(5)利用带火星的木条检验氧气。
14.干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是 CaCO3+2HCl===CaCl2+CO2↑+H2O 。
(2)在装置B中的淡黄色粉末是_Na2O2__。
(3)在干燥管C中的白色固体应为_CaCl2或P2O5__。
一.选择题
1.氧化钠与过氧化钠的相同点是( )
A.均是淡黄色固体
B.均是碱性氧化物
C.均能与水反应生成碱
D.均能与二氧化碳反应放出氧气
2.王刚同学将Na、Na2O、Na2O2、Na2CO3分别投入盛有足量盐酸的1号、2号、3号、4号四支试管中,结果他不会观察到有气泡生成的是( )
A.1号 B.2号
C.3号 D.4号
3.(2023·合肥高一检测)在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出
B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出
D.溶液pH增大,有O2放出
4.某溶液中含有H+、Na+、Mg2+、NO等4种离子,若向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是( )
A.H+ B.Na+
C.Mg2+ D.NO
5.将3.2 g H2和CO的混合气体(其密度为相同条件下氧气密度的),通入一盛有足量Na2O2的密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( )
A.3.2 g B.4.4 g
C.5.6 g D.6.4 g
6.在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其恰好完全反应,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( )
A.54.5% B.40%
C.36% D.33.3%
7.少数不法分子用过氧化钠来漂白、消毒莲子,漂白莲子之后生成的物质有强碱,附在物体上很难清洗干净,身体摄入过量碱是有害的。过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊试液中加入过量Na2O2粉末振荡,可观察到的现象是( )
A.溶液仍为紫色
B.最终溶液褪色,而无其他现象
C.溶液最终变蓝色
D.溶液中有气泡产生,溶液最终变为无色
8.某实验小组通过如图所示实验,探究Na2O2与水的反应。下列说法不正确的是( )
A.②中的大量气泡主要成分是氧气
B.③中溶液变红,说明有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
9.下列关于Na2O2的叙述中正确的是( )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
10.将等质量的下列物质分别投入等质量的足量水中,所得溶液中溶质质量最大的是( )
A.金属钠 B.氧化钠
C.过氧化钠 D.氢氧化钠
11.下列判断正确的是( )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.可利用在氧气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
12下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
A.Na和O2 B.澄清石灰水和CO2
C.Na2O2和CO2 D.木炭(C)和O2
二.非选择题
13.经过五年研发,中国4 000公斤新型潜艇首次直接下水,这款潜艇采用了我国最新设计的无轴泵技术,该技术应用于潜艇,可谓是世界首创。
如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为 。
(2)B装置可除去A装置中可能挥发出的___,反应的离子方程式为 。
(3)C装置为O2的发生装置,反应的化学方程式为
。
(4)D装置可除去C装置中未反应的___,该反应的离子方程式为 。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_ _。
14.干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是 。
(2)在装置B中的淡黄色粉末是___。
(3)在干燥管C中的白色固体应为___。
第二章 1.2氧化钠和过氧化钠
一.选择题
1.氧化钠与过氧化钠的相同点是( C )
A.均是淡黄色固体
B.均是碱性氧化物
C.均能与水反应生成碱
D.均能与二氧化碳反应放出氧气
解析:氧化钠为白色固体,A项错误;Na2O2不是碱性氧化物,B项错误;氧化钠和过氧化钠与水反应都生成氢氧化钠(碱),C项正确;Na2O与水反应不放出氧气,D项错误。
2.王刚同学将Na、Na2O、Na2O2、Na2CO3分别投入盛有足量盐酸的1号、2号、3号、4号四支试管中,结果他不会观察到有气泡生成的是( B )
A.1号 B.2号
C.3号 D.4号
解析:Na2O放入盐酸中生成NaCl和H2O,无气泡产生,故选B。
3.(2023·合肥高一检测)在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( C )
A.溶液中Na+浓度增大,有O2放出
B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出
D.溶液pH增大,有O2放出
解析: 2Na2O2+2H2O===4NaOH+O2↑,B错误;因反应时消耗水,同时生成溶质NaOH,所以有NaOH结晶析出,原NaOH饱和溶液中溶质NaOH和溶剂水的质量、物质的量以及数目均减少,C正确;因仍然是原温度下的饱和溶液,所以浓度不发生改变,pH也不变化,A、D错误。
4.某溶液中含有H+、Na+、Mg2+、NO等4种离子,若向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是( D )
A.H+ B.Na+
C.Mg2+ D.NO
解析:Na2O2在溶液中生成NaOH和O2,H+与OH-反应减少,Na+增多,Mg2+转为Mg(OH)2沉淀,只有NO浓度基本不变,故选D。
5.将3.2 g H2和CO的混合气体(其密度为相同条件下氧气密度的),通入一盛有足量Na2O2的密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( A )
A.3.2 g B.4.4 g
C.5.6 g D.6.4 g
6.在一密闭容器中有CO、H2、O2共16.5 g和足量的Na2O2,用电火花引燃,使其恰好完全反应,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( A )
A.54.5% B.40%
C.36% D.33.3%
解析: CO与氧气反应的化学方程式为2CO+O22CO2,二氧化碳与过氧化钠反应的化学方程式为2CO2+2Na2O2===2Na2CO3+O2,总反应的化学方程式为CO+Na2O2===Na2CO3,固体增加的质量为CO的质量;氢气与氧气反应的化学方程式为2H2+O22H2O,Na2O2与H2O反应的化学方程式为2H2O+2Na2O2===4NaOH+O2↑,总反应的化学方程式为H2+Na2O2===2NaOH,固体增加的质量为氢气的质量;Na2O2增重7.5 g,即CO与H2质量之和为7.5 g,ω(O2)=×100%≈54.5%。
7.少数不法分子用过氧化钠来漂白、消毒莲子,漂白莲子之后生成的物质有强碱,附在物体上很难清洗干净,身体摄入过量碱是有害的。过氧化钠具有强氧化性,可用作漂白剂。向紫色石蕊试液中加入过量Na2O2粉末振荡,可观察到的现象是( D )
A.溶液仍为紫色
B.最终溶液褪色,而无其他现象
C.溶液最终变蓝色
D.溶液中有气泡产生,溶液最终变为无色
解析:Na2O2与水反应生成O2和NaOH,NaOH溶液呈碱性使石蕊试液变蓝,Na2O2具有强氧化性又使溶液褪色,故选D。
8.某实验小组通过如图所示实验,探究Na2O2与水的反应。下列说法不正确的是( D )
A.②中的大量气泡主要成分是氧气
B.③中溶液变红,说明有碱性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
解析:MnO2促进H2O2分解,D项不正确。
综合强化
9.下列关于Na2O2的叙述中正确的是( D )
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只做氧化剂
C.Na2O2属于碱性氧化物
D.Na2O2与CO2或H2O反应后,固体质量都将增大
解析:Na2O2久置于空气中最终变成Na2CO3,A项错误;Na2O2与水反应时,Na2O2既是氧化剂又是还原剂,B项错误;Na2O2不属于碱性氧化物,C项错误;根据两反应中固体成分的变化:Na2O2Na2CO3、Na2O22NaOH可知,D项正确。
10.将等质量的下列物质分别投入等质量的足量水中,所得溶液中溶质质量最大的是( A )
A.金属钠 B.氧化钠
C.过氧化钠 D.氢氧化钠
解析: 等质量的钠、氧化钠、过氧化钠、氢氧化钠投入足量水中,由钠元素守恒可知,钠与水反应生成NaOH最多,故选A。
11.下列判断正确的是( A )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.可利用在氧气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
解析:Na2O2与水反应会产生气泡,可用水确定Na2O中是否有Na2O2,A项正确;Na2O2与CO2反应无明显现象,无法确定Na2O中是否有Na2O2,B项错误;Na2O在氧气中加热转化为Na2O2,C项错误;Na2O、Na2O2加到酚酞溶液中,二者所得溶液均变红,但Na2O2又会使溶液褪色,故D错误。
12下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( C )
A.Na和O2 B.澄清石灰水和CO2
C.Na2O2和CO2 D.木炭(C)和O2
二.非选择题
13.经过五年研发,中国4 000公斤新型潜艇首次直接下水,这款潜艇采用了我国最新设计的无轴泵技术,该技术应用于潜艇,可谓是世界首创。
如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为 CaCO3+2H+===Ca2++H2O+CO2↑ 。
(2)B装置可除去A装置中可能挥发出的_HCl__,反应的离子方程式为 HCO+H+===H2O+CO2↑ 。
(3)C装置为O2的发生装置,反应的化学方程式为
2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑ 。
(4)D装置可除去C装置中未反应的_CO2__,该反应的离子方程式为 2OH-+CO2===CO+H2O 。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_取出集气瓶正放于桌面上,将一根带火星的木条伸入集气瓶中,若木条复燃,证明所收集的气体为O2__。
解析:(1)实验室用稀盐酸与大理石反应制取CO2。
(2)制得的CO2中混有HCl,通过饱和NaHCO3溶液除去CO2中的HCl。
(3)从B装置中出来的CO2中含有水蒸气,通过C装置时CO2、H2O均能与Na2O2反应产生氧气。
(4)D装置中NaOH溶液的作用是除去CO2。
(5)利用带火星的木条检验氧气。
14.干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是 CaCO3+2HCl===CaCl2+CO2↑+H2O 。
(2)在装置B中的淡黄色粉末是_Na2O2__。
(3)在干燥管C中的白色固体应为_CaCl2或P2O5__。
