化学人教版(2019)必修第一册1.1绪言 物质的分类及转化 课件(共70张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1绪言 物质的分类及转化 课件(共70张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 11:41:53 | ||
图片预览










文档简介
(共70张PPT)
化学
化学是什么?化学在研究什么?
化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然学科。
实用和自然哲学
炼金术和炼丹
医化学
燃素学说
近代化学
现代化学
公元前后
1500
1700
1774
21世纪
古代化学
1661 波义耳提出元素概念
1869 门捷列夫提出“元素周期表”
近代化学从萌芽到成熟
按生产工具划分时代:有旧石器时代、新石器时代、青铜时代、铁器时代、蒸汽时代、电气时代、自动化时代、 (信息时代)
《抱朴子内篇》
古代化学
“丹砂(HgS)烧之成水银,积变又还成丹砂”。
“凡石灰经火焚炼为用”
“凡炉中炽铁用炭,煤炭居十七,木炭居十三……”
“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成” (KNO3)
“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”。
作者是晋代葛洪,成书于公元三百一十七年,是对生命、疾病、炼丹养生方术所作的系统的总结。
近代化学
拉瓦锡
氧化学说
道尔顿
原子学说
阿伏加德罗
分子学说
门捷列夫
元素周期律
波义耳
元素概念
现代化学
化学的今天和明天——一门中心的、实用的和创造性的科学
(美) R.布里斯罗,哥伦比亚大学教授,美国化学会前会长
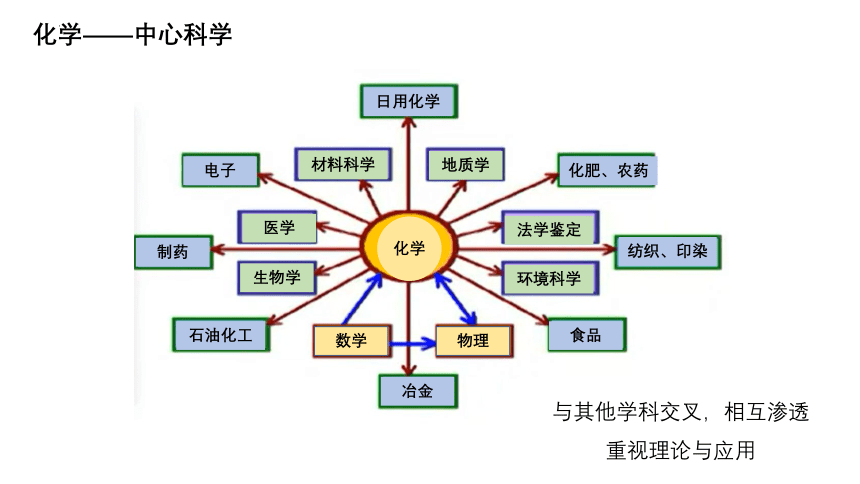
化学——中心科学
与其他学科交叉,相互渗透
重视理论与应用
化学
数学
物理
制药
电子
日用化学
化肥、农药
纺织、印染
食品
冶金
石油化工
材料科学
法学鉴定
环境科学
地质学
医学
生物学
化学——实用科学
主要成分SiO2
电脑芯片的主要材料是硅
光导纤维由SiO2制得
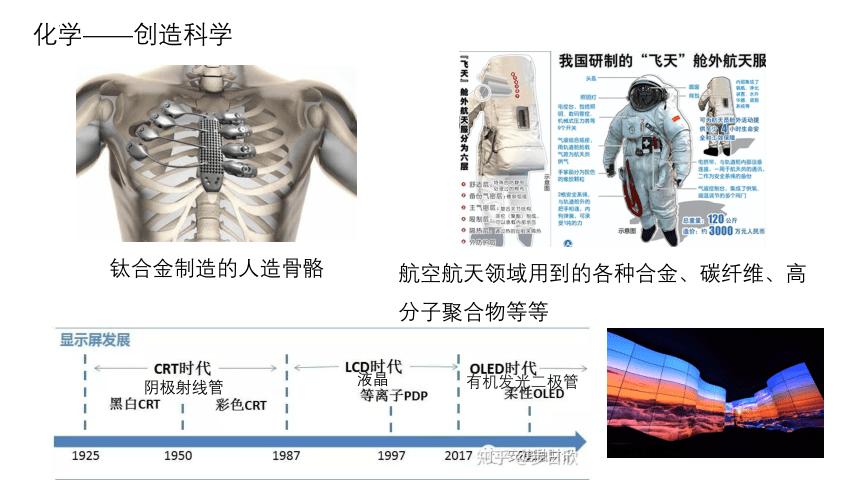
化学——创造科学
钛合金制造的人造骨骼
航空航天领域用到的各种合金、碳纤维、高分子聚合物等等
阴极射线管
液晶
有机发光二极管
我国的化学成就
20世纪以来,经过几代化学家的不懈努力,我国的化学基础研究和化学工业取得了丰硕的成果。
1943年 侯德榜发明联合制碱法
1965年合成了具有生物活性的结晶牛胰岛素
科
20世纪以来,经过几代化学家的不懈努力,我国的化学基础研究和化学工业取得了丰硕的成果。
20世纪80年代,人工合成核糖核酸
我国建成的煤间接液化示范项目
我国的化学成就
感受化学之美
化学分子结构
如何研究化学?
获取科学事实:观察、实验
整理科学事实:比较、分类、类比、归纳、演绎、分析、综合
构造科学理论:假说、模型、科学理论
如何学习化学?
实验、理论相结合
化学与社会
发展中的化学科学
物质结构与性质
化学反应原理
有机化学基础
实验化学
2+3
五大核心素养
1.元素观。 2.微粒观。
3.构性观。 4.作用力。
5.转化观。 6.分类观。
7.守恒观。 8.定量观。
9.动态平衡思想。 10.能量最低原理。
十大基本观念
大悲咒版元素周期表
一些基本要求:
课堂:课前做好准备工作,课本、步步高、笔记本+草稿纸
课上集中注意力、活跃有度、重点笔记
课后(每天):及时总结反思、补充完善笔记、作业独立完成、预习
假期:多思考多实践,联系化学与生活。
帮助你找到分析问题、解决问题的新途径;
获得从化学视角认识物质世界的基本能力;
理解社会可持续发展赋予化学的使命;
培养科学精神和社会责任,形成化学学科核心素养。
愿高中化学课程与你共同开启一段探索物质世界的新旅程!
高中化学学习的意义
第一章 物质及其变化
物质的分类及转化
分类依据:图书内容
图书:中图法(中国图书馆分类法)
超市、冰箱
世界是物质构成的,目前人类发现和合成的物质已超过1亿种。
对于众多的物质,我们通常需要先分类——分门别类
物质都是由元素组成的,根据元素组成可对物质进行分类。
一、物质的分类
物质:根据元素组成进行分类
单一元素
多种元素
同素异形体:
由同一种元素形成的几种性质不同的单质
人类已发现的元素大约有多少种?
人类已发现的单质大约有多少种?
金刚石 石 墨
色 态 无色晶体 灰黑色晶体
硬 度
熔 点
导电性
用 途
天然最硬物质
质地较软
很高(>3550℃)
很 高
导 电
不导电
装饰品、切割玻璃、大理石、钻探机钻头
铅笔芯、电极、润滑剂
1772年拉瓦锡证明金刚石可燃,
生成CO2,进一步测定后确定金刚石
是由碳元素组成的单质。
1779年舍勒证明石墨可燃,也生
成CO2,进一步测定后确定石墨是由
碳元素组成的单质。
1799年法国科学家摩尔沃将一颗金刚石转变为石墨。
1955年美国科学家霍尔在1650℃、95000个大气压下用石墨合成了金刚石。
金刚石和石墨中碳原子的连接方式不同
碳元素
同素异形体
同
种元
素
性质不同
单
质
化学史话
1845年瑞士化学家马里纳,对纯净的O2进行放电实验,获得了一种新的气体,并把它叫做臭氧。后来化学家拉登堡确定了臭氧的化学式为O3,并确定了其结构。
氧气 O2
臭氧 O3
物质 化学式 气体颜色 气味 氧化性
臭氧 O3
氧气 O2
无色
无味
强
淡蓝色
鱼腥味
极强
氧元素的同素异形体
3O2 = 2O3
放电
根据组成进行分类——交叉分类法
根据性质进行分类
根据物质的结构、用途进行分类
多种元素形成的化合物如何分类?
根据组成、性质进行分类——树状分类法
交流与讨论
在日常生活中,常会接触到下列物品:
空气 乙醇 铁 硫酸铵 铜 碘酒 碘 氧气 石墨 硫酸铜
你能对它们进行分类吗?
根据物质的组成进行树状分类:
空气、食盐水、碘酒是混合物;乙醇、硫酸铵、铜、碘、氢气、石墨是纯净物,其中乙醇、硫酸铵是化合物,铜、碘、氢气、石墨是单质,而铜是金属单质,碘、氢气、石墨是非金属单质…
物 质
混合物
纯净物
单 质
化合物
氧化物
金属
单质
非金属
单质
无机化合物
有机化合物
酸
碱
盐
……
(练习)对钠、氯气、氯化铁溶液、硫酸、碳酸钙、
氧化钙、氢氧化钠、葡萄糖从组成角度加以分类
稀有气体
(1).定义:
一种元素一定数目的原子跟其它元素一定数目的原子化合的性质,叫做这种元素的化合价。
化合价有正价、负价和零价。
(2).常见元素的化合价口诀:
氢钠钾银正一价
钙钡镁锌正二价
一二铜,二三铁
二四六硫二四碳
三铝四硅三五磷
变价还有锰氯氮
化合价
对氧化物、酸、碱、盐等进行细致分类
碱
盐
水
酸
盐
水
氧化物:由两种元素组成,其中一种是氧元素的化合物是氧化物。
酸性氧化物一般是某些非金属氧化物和某些过渡金属元素的高价氧化物
两性氧化物:Al2O3
不成盐氧化物:CO、H2O
酸
根据挥发性
挥发性酸:如HCl、HNO3等
难挥发性酸:如H2SO4等
根据酸中是否含氧
无氧酸(如HCl等)
含氧酸(如H2SO4、HNO3等)
对氧化物、酸、碱、盐等进行细致分类
根据酸性强弱
强酸:HCl、HBr、HI、HNO3、 H2SO4、HClO4
弱酸:
从一个分子可电离出的氢离子数
酸:电离出的阳离子全部都是氢离子的化合物
碱:根据______
溶解性
对氧化物、酸、碱、盐等进行细致分类
从碱性强弱分
弱碱
强碱
NaOH、KOH、Ca(OH) 2、Ba(OH)2
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
难溶性碱
可溶性碱
NaOH、KOH、Ca(OH) 2、Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
碱:电离时生成的阴离子全部是氢氧根离子的化合物。例如NaOH.
盐
根据酸根离子是否含氧元素
无氧酸盐(如MgCl2、Na2S等)
含氧酸盐(如KNO2、Na2CO3等)
根据溶解性
可溶性盐 NaCl、AgNO3、CuSO4
微溶性盐(如CaSO4等)
难溶性盐 CaCO3、BaSO4、AgCl
对氧化物、酸、碱、盐等进行细致分类
盐
酸式盐
——酸与碱发生中和反应时,酸中的氢离子未被完全中和所生成的盐。
NaHCO3、NaHSO4、NaHSO3、NaH2PO4、Na2HPO4
2.碱式盐
——碱与酸发生中和反应时,碱
中的氢氧根未被完全中和所生成
的盐。
Cu2(OH)2CO3 Ca(OH)Cl
3.正盐
——酸与碱恰好发生中和反应时所生成的盐。
NaCl Na2CO3 CuSO4
溶液:均一、稳定
浊液:不均一、不稳定
溶液
浊液
1 nm
100 nm
粒子尺寸
似稳非稳-胶体
1nm~100nm
>100nm
<1nm
均一透明
较稳定
不均一、不稳定
均一、透明、稳定
能
不能
能
微粒直径
外观特征稳定性
能否透
过滤纸
胶体
浊液
溶液
浊液粒子、溶液粒子、胶体粒子可以透过滤纸吗,可以透过半透膜吗?
定量滤纸分为快速、中速和慢速三种,其孔径分别大约是80~120微米、30~50微米、和1~3微米。总的来说,滤纸孔径均大于0.1微米。
半透膜是一种根据粒子的直径大小进行选择性的通过,只给某种分子或离子扩散进出的薄膜,而大分子粒子是不被允许通过的。不同类型的半透膜的孔径是不同的。半透膜孔径比较小,约1 nm。
实验探究:Fe(OH)3胶体的制备
FeCl3+3NaOH===== Fe(OH)3 +3NaCl
Fe(OH)3沉淀制备:
实验探究:Fe(OH)3胶体的制备
对于FeCl3溶液有:FeCl3+3H2O===== Fe(OH)3+3HCl
积小成大
少量发生。
对于Fe3+,离子半径约在0.1 nm大小范围内
[Fe(OH)3]m
请看课本第九页实验1-1,氢氧化铁制备的具体操作。
思考为什么要向沸水里加5-6滴饱和的三氯化铁溶液?什么时候停止加热?
取1只小烧杯,向烧杯中加入40
mL蒸馏水,将烧杯中的蒸馏水
加热至沸腾,向沸水中逐滴加入
5~6滴FeCl3饱和溶液,继续煮沸
至溶液呈红褐色,停止加热 把盛有CuSO4溶液和Fe(OH)3胶
体的烧杯置于暗处,分别用红色
激光笔照射烧杯中的液体,在与
光束垂直的方向进行观察
红褐色、透明的液体 盛Fe(OH)3胶体的烧杯中有一条
光亮的“通路”,盛CuSO4溶液
的烧杯无此现象
胶体粒子对光线散射而出现的光的“通路”就是丁达尔效应
硫酸铜溶液 氢氧化铁胶体
光路 无 有
固体大颗粒
胶体粒子
溶液粒子
胶体的性质
(1)丁达尔效应
胶体的结构——以Fe(OH)3为例
[Fe(OH)3]m
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
胶核
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
胶粒
胶团
胶粒带电,胶团不带电
(2)胶体的电泳
(3)胶体的聚沉
胶体粒子自身带电,在外加电场的作用下,在分散剂里作定向移动
胶体-介稳,表面电荷阻碍其进一步聚集
胶体粒子聚集成较大的颗粒,形成沉淀从分散剂里析出的过程。
a.加电解质溶液:电解质的阳离子(或阴离子)中和胶粒电荷从而聚沉。
加入电解质离子电荷数越多,对胶体的聚沉效果越好。
江河入海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成的胶体发生聚沉。
b.加热:热运动加剧,降低胶粒对离子吸附作用。
c.加入带相反电荷的胶粒的胶体。
常见的胶体:
Fe(OH)3胶体、Al(OH)3胶体、硅酸胶体、
淀粉溶液、蛋白质溶液、血液、豆浆、墨水、涂料,有色玻璃,雾等。
胶体的应用:
卤水点豆腐
明矾用于净水
按混合体系的状态分
气溶胶:云、雾、烟
液溶胶:Fe(OH)3胶体、淀粉溶液
固溶胶:有色玻璃
指出溶液、悬浊液、乳浊液的共同点:
1、溶液是一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
2、悬浊液是固体小颗粒分散到液体里形成的混合物
3、乳浊液是小液滴分散到液体里形成的混合物
共同点:一种或几种物质分散到另一种物质里,形成的混合物
水
小油滴
水
小土粒
水
Na+、Cl-
乳浊液(油水)
悬浊液 (泥水)
溶液 (NaCl溶液)
分散剂
分散质
分散系
混合体系——分散系
1.按分散质大小分
胶体
溶液
浊液
2.分散系的分类
按分散质和分散剂的状态分
气
液
固
气
液
固
分散剂状态 气态 液态 固态 实例 实例 实例
分散质状态 气态 空气 气态 泡沫 气态 泡沫塑料
液态 云、雾 液态 酒精水溶液 液态 珍珠(包藏水的碳酸钙)
固态 烟、灰尘 固态 碘酒 固态 有色玻璃
气态分散系
液态分散系
固态分散系
二、物质的转化
不同性质、不同种类的物质可以相互转化,制造出需要的新物质
使指示剂显色:遇紫色石蕊试液显( )色,遇无色酚酞显( )色
与活泼金属反应生成盐和氢气
Zn + H2SO4 ===== ZnSO4 + H2↑
能与碱性氧化物反应生成盐和水
CuO+ 2HCl ===== CuCl2 + H2O
CaCO3 + 2HCl ===== CaCl2 + CO2↑+ H2O
与碱发生中和反应生成盐和水
与某些盐反应生成新盐和新酸
NaOH + HCl ===== NaCl + H2O
红
无
酸、碱、盐的性质——酸:
溶液中存在的阳离子仅为H+
酸、碱、盐的性质——碱:
能使指示剂显色 :遇紫色石蕊试液显( )色 ,遇无色酚酞显( )色;
CO2 + 2NaOH ==== Na2CO3 + H2O
CuSO4 + 2NaOH ==== Cu(OH)2↓ + Na2SO4
能与酸发生中和反应
HCl +NaOH ==== NaCl + H2O
与酸性氧化物反应生成盐和水
能与某些盐反应生成新盐和新碱
蓝
红
溶液中含有的阴离子仅为OH-
酸、碱、盐的性质——盐:
盐跟某些金属的反应
CuSO4 + Fe ==== Cu + FeSO4
Na2CO3 + H2SO4 ====Na2SO4 + CO2↑ +H2O
盐跟酸的反应
盐跟碱的反应
Na2CO3 + Ca(OH)2 ==== CaCO3↓ + 2NaOH
盐跟另一种盐的反应
AgNO3 + NaCl====AgCl↓ + NaNO3
氧化物:
碱性氧化物:
酸性氧化物:
与碱反应
与碱性氧化物反应
与水反应
与酸反应
与碱反应
与水反应(对应碱可溶K、Na、Ca、Ba)
两性氧化物
不成盐氧化物
三、化学反应类型
依据 反应物和生成物的类别
反应前后物质种类的多少
化合反应——多变一
分解反应——一变多
置换反应(单质+化合物)
复分解反应
A + B === AB
AB === A + B
A + CD === C + AD
或 A+ CD === D+ CA
AB + CD === AD + CB
1. 四种基本反应类型
2.物质转化的条件
(1)酸、碱、盐在溶液中发生复分解反应的条件:
生成物:
①沉淀析出:如:Na2CO3+BaCl2=== +2NaCl。
②气体放出:如:CaCO3+2HCl===CaCl2+H2O+ 。
③水生成:如:HCl+NaOH===NaCl+H2O。
三个条件符合其一即可发生复分解反应。
BaCO3↓
CO2↑
反应物:一般而言,无酸必全溶
有H2O、↑、↓三者之一产生。
(2)置换反应发生的条件
①金属活动性顺序表中,排在前面的金属可以置换出排在后面的金属。
如:Fe+CuSO4===FeSO4+Cu,
Cu+2AgNO3===Cu(NO3)2+2Ag。
②金属活动性顺序表中,排在氢前面的金属与稀盐酸(或稀硫酸)发生置换反应,生成 和盐。
如:Fe+H2SO4===FeSO4+H2↑,
Zn+2HCl===ZnCl2+H2↑。
氢气
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
(3)无机化合物与有机化合物在一定条件下的相互转化
①无机化合物转化为有机化合物
1828年,德国化学家 用氰酸铵(NH4CNO)合成了 ,打破了无机物与有机物之间不可转化的观念,揭开了人工合成有机化合物的序幕。
②有机化合物转化为无机化合物
例如:甲烷燃烧生成CO2和H2O;葡萄糖(C6H12O6)在动物体内经缓慢氧化转化为CO2和H2O等。
维勒
尿素[CO(NH2)2]
写出下列物质之间转化的化学方程式:
从物质分类的角度看有什么规律:
物质的转化反应 实例(化学方程式,标注必要的反应条件)
单质→化合物 、_________________
碱性氧化物→碱 _______________________
酸性氧化物→酸 ____________________
酸→盐 __________________________________
碱→盐 ________________________________
碱性氧化物→盐 ___________________
酸性氧化物→盐 ________________________________
盐→盐 __________________________________
盐→氧化物 __________________________
2Ca+O2===2CaO
C+O2 CO2
CaO+H2O===Ca(OH)2
CO2+H2O===H2CO3
H2CO3+Ca(OH)2===CaCO3↓+2H2O
Ca(OH)2+CO2===CaCO3↓+H2O
CaO+CO2===CaCO3
CO2+Ca(OH)2===CaCO3↓+H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
归纳总结
(1)酸性氧化物不一定能与水反应生成酸,如SiO2不溶于水;碱性氧化物不一定能与水反应生成碱,如Fe2O3是碱性氧化物,但它不能与水反应。
(2)单质到盐的转化
部分金属单质 碱性氧化物 碱 盐;
部分非金属单质 酸性氧化物 酸 盐。
(3)物质之间的转化需要一定的条件,如高温、光照、点燃等。
常见无机物之间的相应转化关系
联系生产实际:课本P12
例题:下列各组物质之间可以按如图所示关系直接转化的是
物质A
―→
物质B
―→
物质C
―→
物质A
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
√
解析 A中,Fe2O3―→FeSO4不能一步实现;
B中,H2CO3―→CO不能一步实现;
C中,NaCl―→Na2CO3不能一步实现。
解析 碳酸钠可以与氢氧化钙反应生成氢氧化钠和碳酸钙,能一步实现,故A正确;
CaCO3不溶于水,所以不能与碱溶液反应,因此CaCO3不能通过一步反应得到Ca(OH)2,故B错误;
NaNO3因不能与其他任何物质反应生成沉淀、气体或水,所以NaNO3不能通过一步反应制得NaCl,故C错误;
铜的金属活动性比铁弱,FeSO4不能通过一步反应制得硫酸铜,故D错误。
例题: 下列物质间的转化能一步实现的是
A.Na2CO3―→NaOH B.CaCO3―→Ca(OH)2
C.NaNO3―→NaCl D.FeSO4―→CuSO4
√
化学
化学是什么?化学在研究什么?
化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然学科。
实用和自然哲学
炼金术和炼丹
医化学
燃素学说
近代化学
现代化学
公元前后
1500
1700
1774
21世纪
古代化学
1661 波义耳提出元素概念
1869 门捷列夫提出“元素周期表”
近代化学从萌芽到成熟
按生产工具划分时代:有旧石器时代、新石器时代、青铜时代、铁器时代、蒸汽时代、电气时代、自动化时代、 (信息时代)
《抱朴子内篇》
古代化学
“丹砂(HgS)烧之成水银,积变又还成丹砂”。
“凡石灰经火焚炼为用”
“凡炉中炽铁用炭,煤炭居十七,木炭居十三……”
“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁,后乃煎炼而成” (KNO3)
“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”。
作者是晋代葛洪,成书于公元三百一十七年,是对生命、疾病、炼丹养生方术所作的系统的总结。
近代化学
拉瓦锡
氧化学说
道尔顿
原子学说
阿伏加德罗
分子学说
门捷列夫
元素周期律
波义耳
元素概念
现代化学
化学的今天和明天——一门中心的、实用的和创造性的科学
(美) R.布里斯罗,哥伦比亚大学教授,美国化学会前会长
化学——中心科学
与其他学科交叉,相互渗透
重视理论与应用
化学
数学
物理
制药
电子
日用化学
化肥、农药
纺织、印染
食品
冶金
石油化工
材料科学
法学鉴定
环境科学
地质学
医学
生物学
化学——实用科学
主要成分SiO2
电脑芯片的主要材料是硅
光导纤维由SiO2制得
化学——创造科学
钛合金制造的人造骨骼
航空航天领域用到的各种合金、碳纤维、高分子聚合物等等
阴极射线管
液晶
有机发光二极管
我国的化学成就
20世纪以来,经过几代化学家的不懈努力,我国的化学基础研究和化学工业取得了丰硕的成果。
1943年 侯德榜发明联合制碱法
1965年合成了具有生物活性的结晶牛胰岛素
科
20世纪以来,经过几代化学家的不懈努力,我国的化学基础研究和化学工业取得了丰硕的成果。
20世纪80年代,人工合成核糖核酸
我国建成的煤间接液化示范项目
我国的化学成就
感受化学之美
化学分子结构
如何研究化学?
获取科学事实:观察、实验
整理科学事实:比较、分类、类比、归纳、演绎、分析、综合
构造科学理论:假说、模型、科学理论
如何学习化学?
实验、理论相结合
化学与社会
发展中的化学科学
物质结构与性质
化学反应原理
有机化学基础
实验化学
2+3
五大核心素养
1.元素观。 2.微粒观。
3.构性观。 4.作用力。
5.转化观。 6.分类观。
7.守恒观。 8.定量观。
9.动态平衡思想。 10.能量最低原理。
十大基本观念
大悲咒版元素周期表
一些基本要求:
课堂:课前做好准备工作,课本、步步高、笔记本+草稿纸
课上集中注意力、活跃有度、重点笔记
课后(每天):及时总结反思、补充完善笔记、作业独立完成、预习
假期:多思考多实践,联系化学与生活。
帮助你找到分析问题、解决问题的新途径;
获得从化学视角认识物质世界的基本能力;
理解社会可持续发展赋予化学的使命;
培养科学精神和社会责任,形成化学学科核心素养。
愿高中化学课程与你共同开启一段探索物质世界的新旅程!
高中化学学习的意义
第一章 物质及其变化
物质的分类及转化
分类依据:图书内容
图书:中图法(中国图书馆分类法)
超市、冰箱
世界是物质构成的,目前人类发现和合成的物质已超过1亿种。
对于众多的物质,我们通常需要先分类——分门别类
物质都是由元素组成的,根据元素组成可对物质进行分类。
一、物质的分类
物质:根据元素组成进行分类
单一元素
多种元素
同素异形体:
由同一种元素形成的几种性质不同的单质
人类已发现的元素大约有多少种?
人类已发现的单质大约有多少种?
金刚石 石 墨
色 态 无色晶体 灰黑色晶体
硬 度
熔 点
导电性
用 途
天然最硬物质
质地较软
很高(>3550℃)
很 高
导 电
不导电
装饰品、切割玻璃、大理石、钻探机钻头
铅笔芯、电极、润滑剂
1772年拉瓦锡证明金刚石可燃,
生成CO2,进一步测定后确定金刚石
是由碳元素组成的单质。
1779年舍勒证明石墨可燃,也生
成CO2,进一步测定后确定石墨是由
碳元素组成的单质。
1799年法国科学家摩尔沃将一颗金刚石转变为石墨。
1955年美国科学家霍尔在1650℃、95000个大气压下用石墨合成了金刚石。
金刚石和石墨中碳原子的连接方式不同
碳元素
同素异形体
同
种元
素
性质不同
单
质
化学史话
1845年瑞士化学家马里纳,对纯净的O2进行放电实验,获得了一种新的气体,并把它叫做臭氧。后来化学家拉登堡确定了臭氧的化学式为O3,并确定了其结构。
氧气 O2
臭氧 O3
物质 化学式 气体颜色 气味 氧化性
臭氧 O3
氧气 O2
无色
无味
强
淡蓝色
鱼腥味
极强
氧元素的同素异形体
3O2 = 2O3
放电
根据组成进行分类——交叉分类法
根据性质进行分类
根据物质的结构、用途进行分类
多种元素形成的化合物如何分类?
根据组成、性质进行分类——树状分类法
交流与讨论
在日常生活中,常会接触到下列物品:
空气 乙醇 铁 硫酸铵 铜 碘酒 碘 氧气 石墨 硫酸铜
你能对它们进行分类吗?
根据物质的组成进行树状分类:
空气、食盐水、碘酒是混合物;乙醇、硫酸铵、铜、碘、氢气、石墨是纯净物,其中乙醇、硫酸铵是化合物,铜、碘、氢气、石墨是单质,而铜是金属单质,碘、氢气、石墨是非金属单质…
物 质
混合物
纯净物
单 质
化合物
氧化物
金属
单质
非金属
单质
无机化合物
有机化合物
酸
碱
盐
……
(练习)对钠、氯气、氯化铁溶液、硫酸、碳酸钙、
氧化钙、氢氧化钠、葡萄糖从组成角度加以分类
稀有气体
(1).定义:
一种元素一定数目的原子跟其它元素一定数目的原子化合的性质,叫做这种元素的化合价。
化合价有正价、负价和零价。
(2).常见元素的化合价口诀:
氢钠钾银正一价
钙钡镁锌正二价
一二铜,二三铁
二四六硫二四碳
三铝四硅三五磷
变价还有锰氯氮
化合价
对氧化物、酸、碱、盐等进行细致分类
碱
盐
水
酸
盐
水
氧化物:由两种元素组成,其中一种是氧元素的化合物是氧化物。
酸性氧化物一般是某些非金属氧化物和某些过渡金属元素的高价氧化物
两性氧化物:Al2O3
不成盐氧化物:CO、H2O
酸
根据挥发性
挥发性酸:如HCl、HNO3等
难挥发性酸:如H2SO4等
根据酸中是否含氧
无氧酸(如HCl等)
含氧酸(如H2SO4、HNO3等)
对氧化物、酸、碱、盐等进行细致分类
根据酸性强弱
强酸:HCl、HBr、HI、HNO3、 H2SO4、HClO4
弱酸:
从一个分子可电离出的氢离子数
酸:电离出的阳离子全部都是氢离子的化合物
碱:根据______
溶解性
对氧化物、酸、碱、盐等进行细致分类
从碱性强弱分
弱碱
强碱
NaOH、KOH、Ca(OH) 2、Ba(OH)2
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
难溶性碱
可溶性碱
NaOH、KOH、Ca(OH) 2、Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
碱:电离时生成的阴离子全部是氢氧根离子的化合物。例如NaOH.
盐
根据酸根离子是否含氧元素
无氧酸盐(如MgCl2、Na2S等)
含氧酸盐(如KNO2、Na2CO3等)
根据溶解性
可溶性盐 NaCl、AgNO3、CuSO4
微溶性盐(如CaSO4等)
难溶性盐 CaCO3、BaSO4、AgCl
对氧化物、酸、碱、盐等进行细致分类
盐
酸式盐
——酸与碱发生中和反应时,酸中的氢离子未被完全中和所生成的盐。
NaHCO3、NaHSO4、NaHSO3、NaH2PO4、Na2HPO4
2.碱式盐
——碱与酸发生中和反应时,碱
中的氢氧根未被完全中和所生成
的盐。
Cu2(OH)2CO3 Ca(OH)Cl
3.正盐
——酸与碱恰好发生中和反应时所生成的盐。
NaCl Na2CO3 CuSO4
溶液:均一、稳定
浊液:不均一、不稳定
溶液
浊液
1 nm
100 nm
粒子尺寸
似稳非稳-胶体
1nm~100nm
>100nm
<1nm
均一透明
较稳定
不均一、不稳定
均一、透明、稳定
能
不能
能
微粒直径
外观特征稳定性
能否透
过滤纸
胶体
浊液
溶液
浊液粒子、溶液粒子、胶体粒子可以透过滤纸吗,可以透过半透膜吗?
定量滤纸分为快速、中速和慢速三种,其孔径分别大约是80~120微米、30~50微米、和1~3微米。总的来说,滤纸孔径均大于0.1微米。
半透膜是一种根据粒子的直径大小进行选择性的通过,只给某种分子或离子扩散进出的薄膜,而大分子粒子是不被允许通过的。不同类型的半透膜的孔径是不同的。半透膜孔径比较小,约1 nm。
实验探究:Fe(OH)3胶体的制备
FeCl3+3NaOH===== Fe(OH)3 +3NaCl
Fe(OH)3沉淀制备:
实验探究:Fe(OH)3胶体的制备
对于FeCl3溶液有:FeCl3+3H2O===== Fe(OH)3+3HCl
积小成大
少量发生。
对于Fe3+,离子半径约在0.1 nm大小范围内
[Fe(OH)3]m
请看课本第九页实验1-1,氢氧化铁制备的具体操作。
思考为什么要向沸水里加5-6滴饱和的三氯化铁溶液?什么时候停止加热?
取1只小烧杯,向烧杯中加入40
mL蒸馏水,将烧杯中的蒸馏水
加热至沸腾,向沸水中逐滴加入
5~6滴FeCl3饱和溶液,继续煮沸
至溶液呈红褐色,停止加热 把盛有CuSO4溶液和Fe(OH)3胶
体的烧杯置于暗处,分别用红色
激光笔照射烧杯中的液体,在与
光束垂直的方向进行观察
红褐色、透明的液体 盛Fe(OH)3胶体的烧杯中有一条
光亮的“通路”,盛CuSO4溶液
的烧杯无此现象
胶体粒子对光线散射而出现的光的“通路”就是丁达尔效应
硫酸铜溶液 氢氧化铁胶体
光路 无 有
固体大颗粒
胶体粒子
溶液粒子
胶体的性质
(1)丁达尔效应
胶体的结构——以Fe(OH)3为例
[Fe(OH)3]m
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
胶核
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
胶粒
胶团
胶粒带电,胶团不带电
(2)胶体的电泳
(3)胶体的聚沉
胶体粒子自身带电,在外加电场的作用下,在分散剂里作定向移动
胶体-介稳,表面电荷阻碍其进一步聚集
胶体粒子聚集成较大的颗粒,形成沉淀从分散剂里析出的过程。
a.加电解质溶液:电解质的阳离子(或阴离子)中和胶粒电荷从而聚沉。
加入电解质离子电荷数越多,对胶体的聚沉效果越好。
江河入海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成的胶体发生聚沉。
b.加热:热运动加剧,降低胶粒对离子吸附作用。
c.加入带相反电荷的胶粒的胶体。
常见的胶体:
Fe(OH)3胶体、Al(OH)3胶体、硅酸胶体、
淀粉溶液、蛋白质溶液、血液、豆浆、墨水、涂料,有色玻璃,雾等。
胶体的应用:
卤水点豆腐
明矾用于净水
按混合体系的状态分
气溶胶:云、雾、烟
液溶胶:Fe(OH)3胶体、淀粉溶液
固溶胶:有色玻璃
指出溶液、悬浊液、乳浊液的共同点:
1、溶液是一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
2、悬浊液是固体小颗粒分散到液体里形成的混合物
3、乳浊液是小液滴分散到液体里形成的混合物
共同点:一种或几种物质分散到另一种物质里,形成的混合物
水
小油滴
水
小土粒
水
Na+、Cl-
乳浊液(油水)
悬浊液 (泥水)
溶液 (NaCl溶液)
分散剂
分散质
分散系
混合体系——分散系
1.按分散质大小分
胶体
溶液
浊液
2.分散系的分类
按分散质和分散剂的状态分
气
液
固
气
液
固
分散剂状态 气态 液态 固态 实例 实例 实例
分散质状态 气态 空气 气态 泡沫 气态 泡沫塑料
液态 云、雾 液态 酒精水溶液 液态 珍珠(包藏水的碳酸钙)
固态 烟、灰尘 固态 碘酒 固态 有色玻璃
气态分散系
液态分散系
固态分散系
二、物质的转化
不同性质、不同种类的物质可以相互转化,制造出需要的新物质
使指示剂显色:遇紫色石蕊试液显( )色,遇无色酚酞显( )色
与活泼金属反应生成盐和氢气
Zn + H2SO4 ===== ZnSO4 + H2↑
能与碱性氧化物反应生成盐和水
CuO+ 2HCl ===== CuCl2 + H2O
CaCO3 + 2HCl ===== CaCl2 + CO2↑+ H2O
与碱发生中和反应生成盐和水
与某些盐反应生成新盐和新酸
NaOH + HCl ===== NaCl + H2O
红
无
酸、碱、盐的性质——酸:
溶液中存在的阳离子仅为H+
酸、碱、盐的性质——碱:
能使指示剂显色 :遇紫色石蕊试液显( )色 ,遇无色酚酞显( )色;
CO2 + 2NaOH ==== Na2CO3 + H2O
CuSO4 + 2NaOH ==== Cu(OH)2↓ + Na2SO4
能与酸发生中和反应
HCl +NaOH ==== NaCl + H2O
与酸性氧化物反应生成盐和水
能与某些盐反应生成新盐和新碱
蓝
红
溶液中含有的阴离子仅为OH-
酸、碱、盐的性质——盐:
盐跟某些金属的反应
CuSO4 + Fe ==== Cu + FeSO4
Na2CO3 + H2SO4 ====Na2SO4 + CO2↑ +H2O
盐跟酸的反应
盐跟碱的反应
Na2CO3 + Ca(OH)2 ==== CaCO3↓ + 2NaOH
盐跟另一种盐的反应
AgNO3 + NaCl====AgCl↓ + NaNO3
氧化物:
碱性氧化物:
酸性氧化物:
与碱反应
与碱性氧化物反应
与水反应
与酸反应
与碱反应
与水反应(对应碱可溶K、Na、Ca、Ba)
两性氧化物
不成盐氧化物
三、化学反应类型
依据 反应物和生成物的类别
反应前后物质种类的多少
化合反应——多变一
分解反应——一变多
置换反应(单质+化合物)
复分解反应
A + B === AB
AB === A + B
A + CD === C + AD
或 A+ CD === D+ CA
AB + CD === AD + CB
1. 四种基本反应类型
2.物质转化的条件
(1)酸、碱、盐在溶液中发生复分解反应的条件:
生成物:
①沉淀析出:如:Na2CO3+BaCl2=== +2NaCl。
②气体放出:如:CaCO3+2HCl===CaCl2+H2O+ 。
③水生成:如:HCl+NaOH===NaCl+H2O。
三个条件符合其一即可发生复分解反应。
BaCO3↓
CO2↑
反应物:一般而言,无酸必全溶
有H2O、↑、↓三者之一产生。
(2)置换反应发生的条件
①金属活动性顺序表中,排在前面的金属可以置换出排在后面的金属。
如:Fe+CuSO4===FeSO4+Cu,
Cu+2AgNO3===Cu(NO3)2+2Ag。
②金属活动性顺序表中,排在氢前面的金属与稀盐酸(或稀硫酸)发生置换反应,生成 和盐。
如:Fe+H2SO4===FeSO4+H2↑,
Zn+2HCl===ZnCl2+H2↑。
氢气
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
(3)无机化合物与有机化合物在一定条件下的相互转化
①无机化合物转化为有机化合物
1828年,德国化学家 用氰酸铵(NH4CNO)合成了 ,打破了无机物与有机物之间不可转化的观念,揭开了人工合成有机化合物的序幕。
②有机化合物转化为无机化合物
例如:甲烷燃烧生成CO2和H2O;葡萄糖(C6H12O6)在动物体内经缓慢氧化转化为CO2和H2O等。
维勒
尿素[CO(NH2)2]
写出下列物质之间转化的化学方程式:
从物质分类的角度看有什么规律:
物质的转化反应 实例(化学方程式,标注必要的反应条件)
单质→化合物 、_________________
碱性氧化物→碱 _______________________
酸性氧化物→酸 ____________________
酸→盐 __________________________________
碱→盐 ________________________________
碱性氧化物→盐 ___________________
酸性氧化物→盐 ________________________________
盐→盐 __________________________________
盐→氧化物 __________________________
2Ca+O2===2CaO
C+O2 CO2
CaO+H2O===Ca(OH)2
CO2+H2O===H2CO3
H2CO3+Ca(OH)2===CaCO3↓+2H2O
Ca(OH)2+CO2===CaCO3↓+H2O
CaO+CO2===CaCO3
CO2+Ca(OH)2===CaCO3↓+H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
归纳总结
(1)酸性氧化物不一定能与水反应生成酸,如SiO2不溶于水;碱性氧化物不一定能与水反应生成碱,如Fe2O3是碱性氧化物,但它不能与水反应。
(2)单质到盐的转化
部分金属单质 碱性氧化物 碱 盐;
部分非金属单质 酸性氧化物 酸 盐。
(3)物质之间的转化需要一定的条件,如高温、光照、点燃等。
常见无机物之间的相应转化关系
联系生产实际:课本P12
例题:下列各组物质之间可以按如图所示关系直接转化的是
物质A
―→
物质B
―→
物质C
―→
物质A
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
√
解析 A中,Fe2O3―→FeSO4不能一步实现;
B中,H2CO3―→CO不能一步实现;
C中,NaCl―→Na2CO3不能一步实现。
解析 碳酸钠可以与氢氧化钙反应生成氢氧化钠和碳酸钙,能一步实现,故A正确;
CaCO3不溶于水,所以不能与碱溶液反应,因此CaCO3不能通过一步反应得到Ca(OH)2,故B错误;
NaNO3因不能与其他任何物质反应生成沉淀、气体或水,所以NaNO3不能通过一步反应制得NaCl,故C错误;
铜的金属活动性比铁弱,FeSO4不能通过一步反应制得硫酸铜,故D错误。
例题: 下列物质间的转化能一步实现的是
A.Na2CO3―→NaOH B.CaCO3―→Ca(OH)2
C.NaNO3―→NaCl D.FeSO4―→CuSO4
√
