化学人教版(2019)必修第一册4.3离子键 共价键 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3离子键 共价键 课件(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-16 12:24:19 | ||
图片预览






文档简介
(共20张PPT)
离子键 共价键
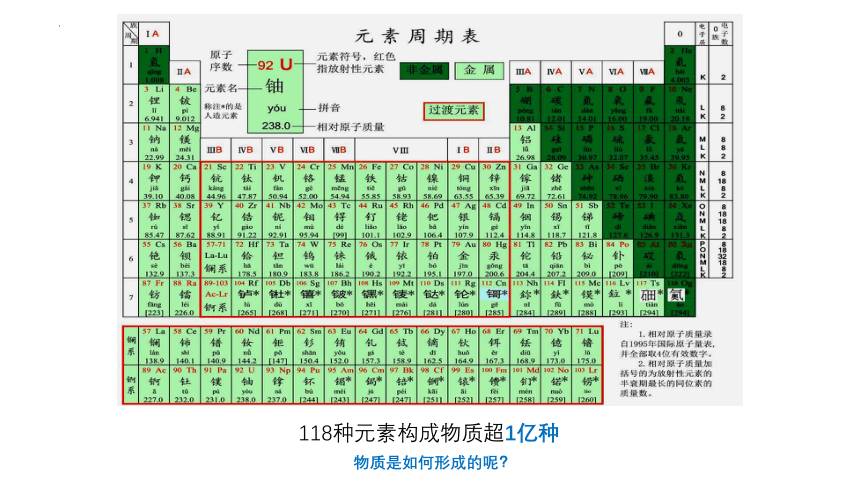
118种元素构成物质超1亿种
物质是如何形成的呢?
为什么Na和Cl的单质化学性质非常活泼,它们化合产物氯化钠却很稳定呢?
NaCl的形成过程
Na+
Cl-
电子转移
不稳定
稳定
体系能量降低
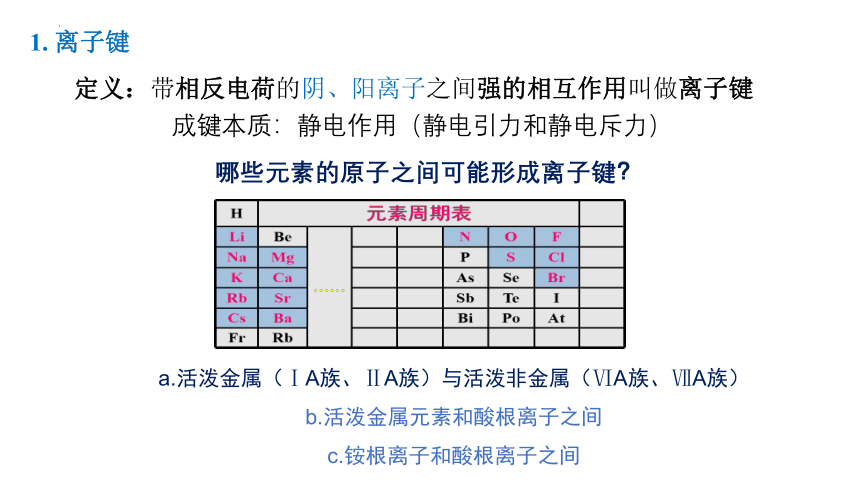
1. 离子键
定义:带相反电荷的阴、阳离子之间强的相互作用叫做离子键
成键本质:静电作用(静电引力和静电斥力)
哪些元素的原子之间可能形成离子键?
a.活泼金属(ⅠA族、ⅡA族)与活泼非金属(ⅥA族、ⅦA族)
b.活泼金属元素和酸根离子之间
c.铵根离子和酸根离子之间
下列哪些物质中存在离子键?
Na2O MgCl2 SO2 HCl
Na2O2 NaOH KNO3 NH4Cl
Na2O MgCl2
Na2O2 NaOH KNO3 NH4Cl
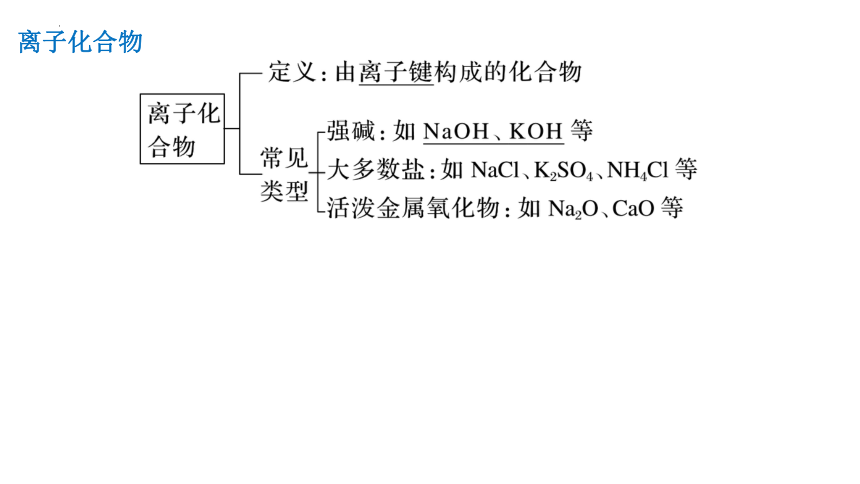
离子化合物
电子式的书写:
1.在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子就是该原子的电子式。
3.阴离子要加方括号,并注明所带电荷数。
2.简单阳离子的电子式就是其离子符号。
4.离子化合物的电子式中,相同离子不能合并,一般分布在两侧。
Mg2+
[ Cl ]-
··
··
:
:
Mg2+
[ Cl ]-
··
··
:
:
[ Cl ]-
··
··
:
:
NaCl的形成过程可以表示为:
1、离子须注明电荷数;
2 、相同的原子可以合并写,相同的离子要分开写;
3、阴离子要用方括号括起;
4、不能把 “→”写成 “ =”
5、用箭头表明电子转移方向
写出下列常见微粒的电子式:
(1)原子
Na: ,Cl:______。
(2)简单离子
Na+: ,F-:________。
Na×
Na+
OH-:__________。
(4)离子化合物
MgCl2:__________________,
Na2O:________________,
Na2O2:_________________。
图示过程 微观分析
如果2个氯原子各提供1个电子,形成共用电子对,2个氯原子就都形成了8电子稳定结构:
定义:像氯分子这样,原子间通过 形成的相互作用叫作共价键 共用电子对
从微观角度理解分子的形成过程(以Cl2为例)
2.共价键
(1)概念:原子间通过 形成的强烈的相互作用。
(2)成键三要素
①成键微粒:原子
②成键元素:一般是同种的或不同种的非金属元素
③成键条件:成键前原子最外层电子未达到饱和状态
共同电子对
3.共价分子及表示方法
(1)概念: 之间全部以 结合的分子叫作共价分子。
(2)共价分子结构的表示方法
①电子式:如H2:_____,N2:_________。
②结构式:化学上,常用“—”表示1对 ,如氯气分子可表示为“Cl—Cl”,这种图示叫作结构式。
原子
共价键
共用电子对
分子 HCl Cl2 H2O CH4
电子式 _______ _______ _________ _________
结构式 ________ ______ __________ ________
填写下表:
H—Cl
Cl—Cl
H
O
H
分子结构模型
归纳总结
离子化合物与共价化合物的比较
离子化合物 共价化合物
化学键 离子键或离子键和共价健 共价键
达到稳定结构的途径 通过电子的得失达到稳定结构 通过形成共用电子对达到稳定结构
构成微粒 阴、阳离子 原子
构成元素 活泼金属元素与活泼非金属元素 不同非金属元素
特例 NH4Cl是不含金属元素的离子化合物 AlCl3是含有金属元素的共价化合物
2.分类
静电作用
共用电子对
极性键
非极性键
1.化学键概念
之间强烈的相互作用。
相邻的原子
构成物质微粒间相互作用
3.化学反应的本质:旧化学键断裂,新化学键生成。
请用化学键的观点来解释H2和Cl2的反应过程。
1.分子间作用力
是指把 的作用力,又叫范德华力。范德华力比化学键
得多,对物质的熔点、沸点等有影响。
2.氢键
分子间形成的氢键也是一种分子间作用力。它比化学键 ,但比范德华力 ,氢键会使物质的熔点和沸点升高。
分子聚集在一起
弱
弱
强
2. 分子间作用力
二、物质变化过程中化学键的变化
1.由分子构成的物质发生三态变化时,克服的是分子间作用力,无化学键被破坏。
2.发生化学变化时,既有化学键的断裂又有化学键的形成。有化学键断裂或
形成的变化不一定是化学变化,发生物理变化时可能有化学键的断裂或形成,
如晶体的析出。
3.离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子, 离子键被破坏。
补充:
4.共价化合物的溶解过程
(1)有些共价化合物溶于水后,能与水反应,发生电离,其分子内共价键被破坏,如 CO2、SO2等。
(2)有些共价化合物溶于水后,发生电离,其分子内的共价键被破坏,如 HCl、H2SO4等。
(3)部分溶于水后,其分子内的化学键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH) 等。
5.单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
离子键 共价键
118种元素构成物质超1亿种
物质是如何形成的呢?
为什么Na和Cl的单质化学性质非常活泼,它们化合产物氯化钠却很稳定呢?
NaCl的形成过程
Na+
Cl-
电子转移
不稳定
稳定
体系能量降低
1. 离子键
定义:带相反电荷的阴、阳离子之间强的相互作用叫做离子键
成键本质:静电作用(静电引力和静电斥力)
哪些元素的原子之间可能形成离子键?
a.活泼金属(ⅠA族、ⅡA族)与活泼非金属(ⅥA族、ⅦA族)
b.活泼金属元素和酸根离子之间
c.铵根离子和酸根离子之间
下列哪些物质中存在离子键?
Na2O MgCl2 SO2 HCl
Na2O2 NaOH KNO3 NH4Cl
Na2O MgCl2
Na2O2 NaOH KNO3 NH4Cl
离子化合物
电子式的书写:
1.在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子就是该原子的电子式。
3.阴离子要加方括号,并注明所带电荷数。
2.简单阳离子的电子式就是其离子符号。
4.离子化合物的电子式中,相同离子不能合并,一般分布在两侧。
Mg2+
[ Cl ]-
··
··
:
:
Mg2+
[ Cl ]-
··
··
:
:
[ Cl ]-
··
··
:
:
NaCl的形成过程可以表示为:
1、离子须注明电荷数;
2 、相同的原子可以合并写,相同的离子要分开写;
3、阴离子要用方括号括起;
4、不能把 “→”写成 “ =”
5、用箭头表明电子转移方向
写出下列常见微粒的电子式:
(1)原子
Na: ,Cl:______。
(2)简单离子
Na+: ,F-:________。
Na×
Na+
OH-:__________。
(4)离子化合物
MgCl2:__________________,
Na2O:________________,
Na2O2:_________________。
图示过程 微观分析
如果2个氯原子各提供1个电子,形成共用电子对,2个氯原子就都形成了8电子稳定结构:
定义:像氯分子这样,原子间通过 形成的相互作用叫作共价键 共用电子对
从微观角度理解分子的形成过程(以Cl2为例)
2.共价键
(1)概念:原子间通过 形成的强烈的相互作用。
(2)成键三要素
①成键微粒:原子
②成键元素:一般是同种的或不同种的非金属元素
③成键条件:成键前原子最外层电子未达到饱和状态
共同电子对
3.共价分子及表示方法
(1)概念: 之间全部以 结合的分子叫作共价分子。
(2)共价分子结构的表示方法
①电子式:如H2:_____,N2:_________。
②结构式:化学上,常用“—”表示1对 ,如氯气分子可表示为“Cl—Cl”,这种图示叫作结构式。
原子
共价键
共用电子对
分子 HCl Cl2 H2O CH4
电子式 _______ _______ _________ _________
结构式 ________ ______ __________ ________
填写下表:
H—Cl
Cl—Cl
H
O
H
分子结构模型
归纳总结
离子化合物与共价化合物的比较
离子化合物 共价化合物
化学键 离子键或离子键和共价健 共价键
达到稳定结构的途径 通过电子的得失达到稳定结构 通过形成共用电子对达到稳定结构
构成微粒 阴、阳离子 原子
构成元素 活泼金属元素与活泼非金属元素 不同非金属元素
特例 NH4Cl是不含金属元素的离子化合物 AlCl3是含有金属元素的共价化合物
2.分类
静电作用
共用电子对
极性键
非极性键
1.化学键概念
之间强烈的相互作用。
相邻的原子
构成物质微粒间相互作用
3.化学反应的本质:旧化学键断裂,新化学键生成。
请用化学键的观点来解释H2和Cl2的反应过程。
1.分子间作用力
是指把 的作用力,又叫范德华力。范德华力比化学键
得多,对物质的熔点、沸点等有影响。
2.氢键
分子间形成的氢键也是一种分子间作用力。它比化学键 ,但比范德华力 ,氢键会使物质的熔点和沸点升高。
分子聚集在一起
弱
弱
强
2. 分子间作用力
二、物质变化过程中化学键的变化
1.由分子构成的物质发生三态变化时,克服的是分子间作用力,无化学键被破坏。
2.发生化学变化时,既有化学键的断裂又有化学键的形成。有化学键断裂或
形成的变化不一定是化学变化,发生物理变化时可能有化学键的断裂或形成,
如晶体的析出。
3.离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子, 离子键被破坏。
补充:
4.共价化合物的溶解过程
(1)有些共价化合物溶于水后,能与水反应,发生电离,其分子内共价键被破坏,如 CO2、SO2等。
(2)有些共价化合物溶于水后,发生电离,其分子内的共价键被破坏,如 HCl、H2SO4等。
(3)部分溶于水后,其分子内的化学键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH) 等。
5.单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
